94例前交通动脉瘤显微手术疗效分析
香耀先,孙正辉,许百男,武 琛,朱 蕾解放军总医院 神经外科,北京 00853;北京电力医院 放射科,北京 00073
动脉瘤破裂是引起蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的主要原因。前交通动脉瘤大约占动脉瘤的20%,在破裂的动脉瘤中约占30%[1]。因此其破裂引起SAH的可能性也较大。由于前交通动脉特殊的解剖位置,会引起较多的并发症,致残率及病死率都极高,早期死亡率达到36%[2]。随着影像技术的飞速发展,术前对动脉瘤的诊断技术已相对完善,数字减影血管造影(digital subtraction angiography,DSA)为其诊断的金标准[3]。笔者通过对解放军总医院神经外科2010年1月-2012年8月收治的前交通动脉瘤患者动脉瘤夹闭术疗效、术中辅助技术的评价和随访观察,探讨开颅显微镜下动脉瘤夹闭术对前交通动脉瘤治疗的有效性以及术中应用辅助技术的必要性。94例前交通动脉瘤病例报告如下。
资料和方法
1 临床资料 共收治本院神经外科2010年1月-2012年8月前交通动脉瘤94例,男51例,女43例,年龄28 ~ 78岁,平均47岁。术前CT提示71例有SAH史,脑内血肿7例(血肿破入脑室2例)。术前行数字减影血管造影(digital subtraction angiography,DSA)、计算机断层摄影血管造影术(computed tomographic angiography,CTA)检查提示前交通动脉瘤。术前Hunt-Hess分级:Ⅰ级19例,Ⅱ级54例,Ⅲ级14例,Ⅳ级7例。临床主要表现为突发头痛60例,头晕6例,视力、视野损害2例,一侧肢体功能障碍7例,意识障碍11例,无症状者8例。
2 治疗方法 根据术前评估,Hunt-HessⅠ~Ⅲ级的患者采取早期手术治疗,(出血或就诊24 ~ 48 h内,最好不超过72 h)。对于Hunt-Hess Ⅳ~Ⅴ患者进行手术耐受性评估,根据是否耐受考虑手术。采用翼点入路86例(其中右侧入路40例,左侧人路51例),前纵裂入路3例。翼点入路常规开颅后以蝶骨嵴为中心弧形剪开硬脑膜.在手术显微镜下打开外侧裂池、颈动脉池和视交叉池。抬起额叶,充分分离出颈内动脉分叉部,沿大脑前动脉A1段向中线分离达到动脉瘤。将瘤体及瘤颈与两侧大脑前动脉、前交通动脉向后发出的下丘脑穿通动脉、视神经、嗅神经等结构分开,选择合适的动脉瘤夹予以夹闭。夹闭后尽量清除脑池内的血肿。并用罂粟碱棉片覆盖动脉被阻断处数分钟。92例次术中采用载瘤动脉临时阻断,阻断时间1.5 ~ 45 min。术中均应用体感诱发电位监测脑缺血情况,60例术中应用微血管多普勒超声及28例应用吲哚菁绿荧光血管造影,同时应用两者28例。术后常规静脉滴注抗血管痉挛药物,严密监测各项生命体征。
3 随访方法 术后3、6、12个月行CTA复查,对未能来院复查的患者行电话随访。
结 果
1 手术完成情况及并发症 术中动脉瘤直接夹闭89个,动脉瘤切开再夹闭2个(1例患者曾经因蛛网膜下腔出血在外院行急性DSA并栓塞,这次再次破裂,本次手术切开动脉瘤取出弹簧圈重新夹闭动脉瘤,术后恢复良好;另1例患者为复杂动脉瘤,占位效应明显,切开并切除一部分动脉瘤体后夹闭动脉瘤),载瘤动脉近端孤立联合远端血管架桥1个(术后偏瘫,去骨瓣减压),未处理2个(1例入院DSA提示前交通动脉瘤并同时栓塞,但栓塞不全,动员家属手术被拒绝,术后14天再次破裂,放弃治疗;另1例家属拒绝手术),术后5天行CTA检查提示残颈1例。1例术中临时阻断载瘤动脉后体感诱发电位发生明显变化,立即恢复血流后体感诱发电位恢复,术后复查DSA夹闭完全。术后意识清楚83例,嗜睡6例,朦胧1例,昏迷4例。术后并发症偏瘫5例(2例因脑水肿行去骨瓣减压缓解),失明1例(术中动脉瘤与视神经黏连较紧密,分离性损伤),脑积水1例(行脑室穿刺后缓解),癫痫发作1例。1例进手术室之前突发动脉瘤破裂,意识及呼吸丧失,紧急气管插管按原计划手术,术后额颞脑回血肿,二次手术清除血肿。
2 随访情况 90例中80例得到随访,14例失访。出院时患者GOS评分5分85.11%。随访期间GOS评分5分为88.75%(71/80)、4分为6.25%(5/80),3分为2.5%(2/80),2例1分动脉瘤破裂患者家属放弃手术治疗,转入当地医院保守治疗不久后死亡(表1)。出院时单侧肢体肌力0级者2例,Ⅰ级者2例,Ⅱ级者2例,Ⅲ级者1例,Ⅳ级8者例,Ⅴ级80例,随访期间单侧肢体肌力0级者2例,Ⅲ级者2例,Ⅳ级5者例,Ⅴ级71例。出院时失语1例,随访期间恢复语言功能。随访期间失语1例。
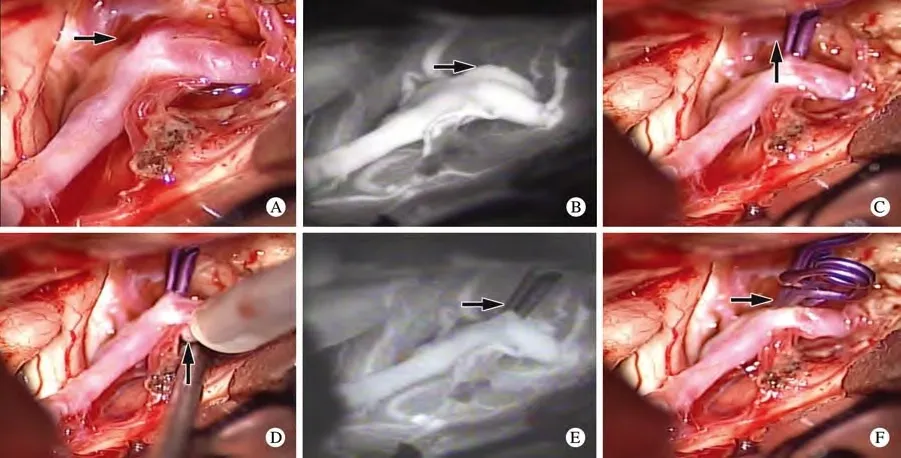
图1 术中荧光造影和多普勒血管超声应用图像 A: 暴露前交通动脉瘤; B: 术中荧光造影下前交通动脉瘤; C: 术中直动脉瘤夹夹闭动脉瘤; D: 术中多普勒超声探测血流; E: 术中荧光造影下提示动脉瘤残颈; F: 补夹完全夹闭动脉瘤Fig. 1 Intraoperative fluorescence angiography and Doppler ultrasonography showing ACOA before exposure (A), intraoperative ACOA (B), direct ACOA clipping (C), blood flow (D), intraoperative residual ACOA neck (E), and complete ACOA clipping (F)

表1 94例前交通动脉瘤患者GOS评分Tab. 1 GOS score of 94 ACOA patients(n, %)
讨 论
1 前交通动脉的解剖特点 前交通动脉及其复合体位于Willis环前部,前交通动脉一般长0.1 ~ 3 mm,正常管径为1.0 ~ 3.0 mm,但发育不良时为0.5 ~ 1.0 mm,极度不良时0.1 ~ 0.5 mm,增粗时可>3 mm但不常见。大约只有20%的前交通动脉是连接双侧粗细相等的A1段的,但大多数情况下,一次粗大的A1段分成两支远端大脑前动脉(A2段),对侧细小的A1段进入复合体的那一点即为前交通动脉的起始端。黄庆等[4]通过大量病例术中观察发现大多数前交通动脉瘤伴有一侧A1的发育不良,Karmonik等[5]认为前交通动脉瘤往往与大脑前动脉A1段优势侧血流的轴向一致,即瘤体指向前上型最多。由此我们可推断血流动力学的改变与动脉瘤形成有着密切的关系。
2 手术方式及时机的选择 有较多对于前交通动脉瘤手术和介入的选择的相关报道[6-7]。Gonzalez等[7]通过较多的影像资料研究表明前交通动脉瘤通常较小,介入治疗的难度较大,宜采用手术治疗。本组对Ⅰ~Ⅲ级患者优先手术治疗,Ⅳ~Ⅴ级患者优先介入治疗,如果是宽颈或微小动脉瘤介入难度较大时也应手术治疗。由于老年患者长期卧床更易引起排尿排便困难的因素,这些都是导致动脉瘤破裂的诱因,因此应尽早手术[8]。本组92例采取手术治疗。Drake[9]研究认为:当动脉瘤破裂时,血破入到蛛网膜下腔刺激周围血管会引起脑血管痉挛,出血量大时会引起血肿占位效应,影响脑池、导水管的通畅导致脑水肿引起颅内高压而造成手术分离及暴露动脉瘤困难,提倡晚期手术。然而本组经验体会当患者在等待手术期间,动脉瘤再次破裂或血管痉挛的危险性及可能性较大,甚至失去了手术的机会。Khandelwal等[10]也认为了避免再次出血导致的死亡,对于那些破裂的动脉瘤患者,应该尽快采取手术治疗。以往研究也显示早期手术会明显降低预后的死亡率,减少动脉瘤再出血[11-12]。而且Dalbayrak[13]等研究表明72 h以内行手术治疗的患者死亡率都低于96 h的患者。本组病人均在72 h内行手术治疗,1例进手术室前突发动脉瘤破裂,意识及呼吸丧失,紧急气管插管按原计划手术,术后额颞脑回血肿,脑室再次出血,二次手术清除血肿,但预后较差。因此我们提倡早期手术,尤其是Hunt-Hess分级较好的患者。术中通过脱水药或脑室穿刺引流降低颅压、临时阻断夹阻断载瘤动脉以及动脉瘤时血压的规范调节、术中严密的电生理监测[14]以及术者娴熟的手术技巧来克服这些困难。充分打开脑池释放脑脊液,小心分离蛛网膜组织,尽可能清楚陈旧积血而充分暴露动脉瘤,这样利于动脉瘤夹闭以及穿支血管的保护,并且利于术后的恢复,减少并发症[15]。必要时行去骨瓣减压术[16-17]。手术入路侧别的选择要考虑功能区的保护、A1优势供血侧及动脉瘤指向等因素,本组采用翼点入路86例,其中右侧入路40例,左侧人路51例,数量没有明显的差异,主要是根据A1优势供血侧,Weil等[18]已给出了A1优势征的判断标准,但动脉瘤位于两侧大脑前动脉A2之间,动脉瘤被优势侧增粗的A2遮挡住时,为了利于暴露动脉瘤可选择非优势侧入路[19]。术前结合DSA等影像学资料选择符合个体的手术侧别。
3 微血管多普勒超声(microvascular Doppler sonography,mDs)及荧光造影术中的应用 为了保证动脉瘤的完全夹闭以及载瘤动脉和穿支血管的通畅性,无疑术中DSA是最理想的手段,但是受各种客观因素的限制使其不能成为术中常规检查方法。微血管多普勒超声运用于动脉瘤夹闭前及夹闭后测量并比较载瘤动脉、穿支血管以及动脉瘤血流,其因为技术局限也存在应用限制[20]。荧光造影术是通过大脑血管内注入特定造影剂而直接对血管内血流显影的一种技术。在手术中动脉瘤的大小及能暴露的位置差异性很大,术者往往很难暴露并看到全部的瘤颈,这时多普勒就可以指导我们获取一个合适的夹闭位置[21],尤其是对待巨大的、复杂的动脉瘤时,对责任动脉瘤的通畅性及动脉瘤的完全夹闭性的控制就显得尤其重要,前者可以通过荧光造影,后者可通过动脉瘤穿刺来判断(但有时存在不确定性),荧光造影术同样因为不能准确反映血流动力学的情况而同样有局限性[22]。但是微血管多普勒超声检测血流动力学观察血流方向更能及时通过血流的方向判断载瘤动脉以及周围动脉瘤狭窄程度以调整动脉瘤夹。术中动脉瘤夹闭后,荧光造影技术的应用可以帮助术者评估动脉瘤夹闭效果,直观反映夹闭情况。甚至这项技术新的发展告诉我们还可以动态显示显微镜下血流的速度与方向[23]。这两项技术相结合使用能更进一步提高术中评估的准确性。本组60例术中应用微血管多普勒超声及28例应用吲哚菁绿荧光血管造影,同时应用两者的28例。当遇到穿支血管较多、动脉瘤复杂瘤颈较宽以及位置较深暴露困难等多种情况下,单用多普勒超声不能绝对把握评估时,随后同时应用荧光造影技术协助评估往往能得到更好的处理策略[24]。尤其是较小穿支及深穿支血管,荧光造影术更可取。因为荧光显影对于动脉瘤以及周围血管的解剖显示更直观,所以对于动脉瘤夹闭后是否有残疾的判断更优于微血管多普勒超声。当然相比与其他手段,多普勒超声不需要造影剂、更无创、运用起来更方便。
4 躯体感觉诱发电位(somatosensory evoked potential,SEP)监测技术应用 动脉瘤形状、位置的深浅、暴露的难易程度直接影响了夹闭其的难易程度,在分离并夹闭动脉瘤时会遇到很多问题,为了方便夹闭动脉瘤而降低瘤体内血流的充盈及压力,以及为了避免动脉瘤突然破裂引起的难以控制的大出血,动脉瘤近端和远端临时阻断夹的应用就显得尤其重要,但当临时阻断载瘤动脉时,为了避免因阻断动脉后脑供血不足而引起的缺血性梗死而导致的不可逆的神经功能障碍,我们就应该随时监测阻断过程中脑灌注情况,术中体感诱发电位的监测可以提示血流阻断后脑供血情况及功能区脑灌注状态[25]。而且Szelenyi等[26]报道证明SEP监测还可以有效预测术后的神经功能状态。
5 术中穿支血管的保护 在手术中穿支血管的良好保护也是术后是否有并发症的关键。当蛛网膜下腔出血时,包裹血管的蛛网膜下腔黏连较严重,所以分离时要注意穿支血管的保护。部分前交通动脉有很多穿支小血管(尤其是其下后壁)紧靠着漏斗及视交叉区,穿入脑实质,继续走行进入下丘脑的视前区。因此在手术中这些穿支血管的保护对术后减少并发症也显得尤其重要。尤其是复杂动脉瘤,当手术视野受限时完全夹闭动脉瘤可能会损伤到穿支血管,可部分夹闭动脉瘤并行载瘤血管塑形,必要时行血管架桥。本组1例患者,位于前交通的复杂动脉瘤,从动脉瘤体发出3支穿支血管,夹闭困难,可在体感电位密切监测下行载瘤动脉近端孤立联合远端动脉架桥[27]。
综上,我组术后患者出院时疗效GOS评分5分为85.11%、4分为8.51%,随访期间GOS评分5分为88.75%、4分为6.25%,与Lozier等[28]的研究结果相同。说明只要通过及时的完善的手术,患者是可以得到理想的预后的。对于前交通动脉瘤的手术治疗,除了手术者娴熟的技术外,同时也离不开术前的计划以及术中各种辅助手段的配合。
1 Riina HA, Lemole GM Jr, Spetzler RF. Anterior communicating artery aneurysms[J]. Neurosurgery, 2002, 51(4):993-996.
2 Lindekleiv HM, Valen-Sendstad K, Morgan MK, et al. Sex differences in intracranial arterial bifurcations[J]. Gend Med,2010, 7(2): 149-155.
3 Klompenhouwer EG, Dings JT, van Oostenbrugge RJ, et al. Singlecenter experience of surgical and endovascular treatment of ruptured intracranial aneurysms[J]. AJNR Am J Neuroradiol, 2011, 32(3):570-575.
4 黄庆,李铁林,苏正,等.126例前交通动脉瘤血管影像特点分析[J].第一军医大学学报,2001,21(S1):26-27.
5 Karmonik C, Yen C, Grossman RG, et al. Intra-aneurysmal flow patterns and wall shear stresses calculated with computational flow dynamics in an anterior communicating artery aneurysm depend on knowledge of patient-specific inflow rates[J]. Acta Neurochir(Wien),2009, 151(5):479-485.
6 Tsutsumi M, Aikawa H, Onizuka M, et al. Endovascular treatment of tiny ruptured anterior communicating artery aneurysms[J]. Neuroradiology, 2008, 50(6): 509-515.
7 Gonzalez N, Sedrak M, Martin N, et al. Impact of anatomic features in the endovascular embolization of 181 anterior communicating artery aneurysms[J]. Stroke, 2008, 39(10): 2776-2782.
8 马金良,朱晓波.老年颅内动脉瘤的外科治疗体会[J].中国老年学杂志,2010,30(5):701-702.
9 Drake CG. Ruptured intracranial aneurysms[J]. Proc R Soc Med,1971, 64(5):477-481.
10 Khandelwal P, Kato Y, Sano H, et al. Treatment of ruptured intracranial aneurysms: our approach[J]. Minim Invasive Neurosurg, 2005, 48(6):325-329.
11 Horiuchi T, Tanaka Y, Hongo K, et al. Aneurysmal subarachnoid hemorrhage in young adults: a comparison between patients in the third and fourth decades of life[J]. J Neurosurg, 2003, 99(2):276-279.
12 Hashemi SM, Golchin N, Nejad EA, et al. Timing of surgery for aneurysmal subarachnoid hemorrhage[J]. Acta Med Iran, 2011,49(7):420-424.
13 Dalbayrak S, Altas M, Arslan R. The effects of timing of aneurysm surgery on vasospasm and mortality in patients with subarachnoid hemorrhage[J]. Acta Neurol Belg, 2011, 111(4): 317-320.
14 Grigorian AA, Marcovici A, Flamm ES. Intraoperative factors associated with surgical outcome in patients with unruptured cerebral aneurysms: the experience of a single surgeon[J]. J Neurosurg,2003, 99(3): 452-457.
15 Hernesniemi J, Dashti R, Lehecka M, et al. Microneurosurgical management of anterior communicating artery aneurysms[J]. Surg Neurol, 2008, 70(1): 8-28.
16 Bohnstedt BN, Nguyen HS, Kulwin CG, et al. Outcomes for clip ligation and hematoma evacuation associated with 102 patients with ruptured middle cerebral artery aneurysms[J]. World Neurosurg,2013, 80(3/4): 335-341.
17 de los Reyes K, Patel A, Bederson JB, et al. Management of subarachnoid hemorrhage with intracerebral hematoma: clipping and clot evacuation versus coil embolization followed by clot evacuation[J]. J Neurointerv Surg, 2013, 5(2): 99-103.
18 Weil AG, Bojanowski MW, Scholtes F, et al. Angiographic pitfall:duplicated tapered A1 segment of the anterior cerebral artery mimicking an anterior communicating artery aneurysm[J]. Interv Neuroradiol, 2011, 17(2): 179-182.
19 李俊,张戈,陈刚,等.非优势供血侧翼点入路手术夹闭前交通动脉瘤(附12例报告)[J].中国临床神经外科杂志,2011,16(6):327-328.
20 Gruber A, Dorfer C, Standhardt H, et al. Prospective comparison of intraoperative vascular monitoring technologies during cerebral aneurysm surgery[J]. Neurosurgery, 2011, 68(3): 657-673.
21 Laborde G, Gilsbach J, Harders A. The microvascular Doppler--an intraoperative tool for the treatment of large and giant aneurysms[J]. Acta Neurochir Suppl(Wien), 1988, 42:75-80.
22 Towle EL, Richards LM, Kazmi SM, et al. Comparison of indocyanine green angiography and laser speckle contrast imaging for the assessment of vasculature perfusion[J]. Neurosurgery, 2012,71(5): 1023-1030.
23 Chen SF, Kato Y, Oda J, et al. The application of intraoperative near-infrared indocyanine green videoangiography and analysis of fluorescence intensity in cerebrovascular surgery[J]. Surg Neurol Int, 2011, 2:42.
24 Fischer G, Stadie A, Oertel JM. Near-infrared indocyanine green videoangiography versus microvascular Doppler sonography in aneurysm surgery[J]. Acta Neurochir (Wien), 2010, 152(9):1519-1525.
25 Karmonik C, Yen C, Grossman RG, et al. Intra-aneurysmal flow patterns and wall shear stresses calculated with computational flow dynamics in an anterior communicating artery aneurysm depend on knowledge of patient-specific inflow rates[J]. Acta Neurochir(Wien),2009, 151(5):479-485.
26 Szelényi A, Langer D, Kothbauer K, et al. Monitoring of muscle motor evoked potentials during cerebral aneurysm surgery:intraoperative changes and postoperative outcome[J]. J Neurosurg,2006, 105(5): 675-681.
27 Jafar JJ, Russell SM, Woo HH. Treatment of giant intracranial aneurysms with saphenous vein extracranial-to-intracranial bypass grafting: indications, operative technique, and results in 29 patients[J]. Neurosurgery, 2002, 51(1): 138-144.
28 Lozier AP, Kim GH, Sciacca RR, et al. Microsurgical treatment of basilar apex aneurysms: perioperative and long-term clinical outcome[J]. Neurosurgery, 2004, 54(2): 286-296.

