伊立替康联合奥沙利铂三线治疗晚期胃癌的疗效分析
韩雅琳,陈 丽,吴志勇,秦 锐,王治宽,石 燕,戴广海
解放军总医院 肿瘤综合治疗科一病区,北京 100853
不能手术的局部进展及术后发生远处转移的晚期胃癌患者,多数需要通过系统的姑息性化疗改善生活质量、延长生存期。二线化疗失败后疾病进展且一般状况良好的晚期胃癌患者可接受三线治疗。但晚期胃癌患者一般机体免疫功能低下、耐受性差、对化疗药物相对不敏感,目前国内外尚无标准的三线治疗方案。因此探寻疗效显著、耐受性良好的化疗方案作为二线化疗失败后的解救治疗具有积极的意义。本研究回顾性分析31例接受伊立替康联合奥沙利铂三线治疗的晚期胃癌患者的临床资料,探讨其近期临床有效率、不良反应及生存预后。
资料和方法
1 一般资料 收集2007年7月- 2012年7月在我院接受伊立替康联合奥沙利铂三线治疗的晚期胃癌患者31例。入选标准:经病理组织学或细胞学证实为胃癌;有至少一处可测量的靶病灶;在3个月内未接受含有伊立替康或奥沙利铂方案的化疗,二线治疗后疗效评价为疾病进展(PD)。美国东部肿瘤协作组(Eastern Cooperative Oncology Group)评分标准0 ~ 2分;心肺、肝肾、骨髓、凝血功能无明显异常;接受伊立替康联合奥沙利铂方案治疗至少2个周期以上;化疗前签署知情同意书。出现下列情况之一者终止化疗:疾病进展,出现不能耐受的不良事件,死亡。31例中男性27例(87.1%),女性4例(12.9%),中位年龄为55岁(27 ~ 71岁);高中分化腺癌5例(16.1%),低分化腺癌23例(74.2%),神经内分泌癌3例(9.7%);接受手术治疗19例(61.3%),未行手术治疗12例(38.7%);肝转移11例(35.5%),腹腔种植性转移9例(29.0%),淋巴结转移21例(67.7%),肺转移3例(9.7%),骨转移2例(6.5%),两个以上部位转移24例(77.4%)。患者既往均未接受含伊立替康方案化疗,接受含奥沙利铂方案化疗6例(19.4%)。详见表1。
2 治疗方案 21天为1个周期,均按CPT-11 180 mg/m2静脉滴注2 h,LOHP 85 mg/m2静脉滴注2 h,进行三线治疗。化疗过程中出现相关不良反应,进行对症治疗。常规应用阿托品预防乙酰胆碱能综合征。
3 疗效评价 每完成2周期化疗后进行疗效评价。检测方法包括针对靶病灶复查CT、浅表淋巴结超声等常规检查,必要时行MRI、全身骨扫描、PET-CT扫描及胃镜等。近期疗效评价按实体肿瘤疗效评价标准RECIST 1.1版。完全缓解(CR):所有病灶消失;部分缓解(PR):治疗开始后记录到的最小靶病灶长径总和缩小≤30%;病情进展(PD):基线病灶长径总和增加≥20%或出现新病灶;病情稳定(SD):基线病灶长径总和缩小但未达PR或增加但未达PD。有效率(0RR)以CR+PR计算,疾病控制率(DCR)以CR+PR+SD计算。
4 不良反应 每完成1周期化疗后进行不良反应评价,检测方法包括复查患者血常规及肝肾功能等。不良反应评价按CTCAE3.0分级标准分为1 ~ 4级。
5 随访 随访截止时间为2013年4月31日,中位随访时间为32.0个月(20.5 ~ 43.0月)。无进展生存期(PFS)为自治疗开始至疾病进展或死亡的时间,总生存时间(OS)为自治疗开始至死亡或末次随访的时间。
6 统计学分析 采用SPSS19.0软件包进行统计分析,分别统计临床有效率、不良反应发生率,并采用Kaplan-Meier进行生存分析。
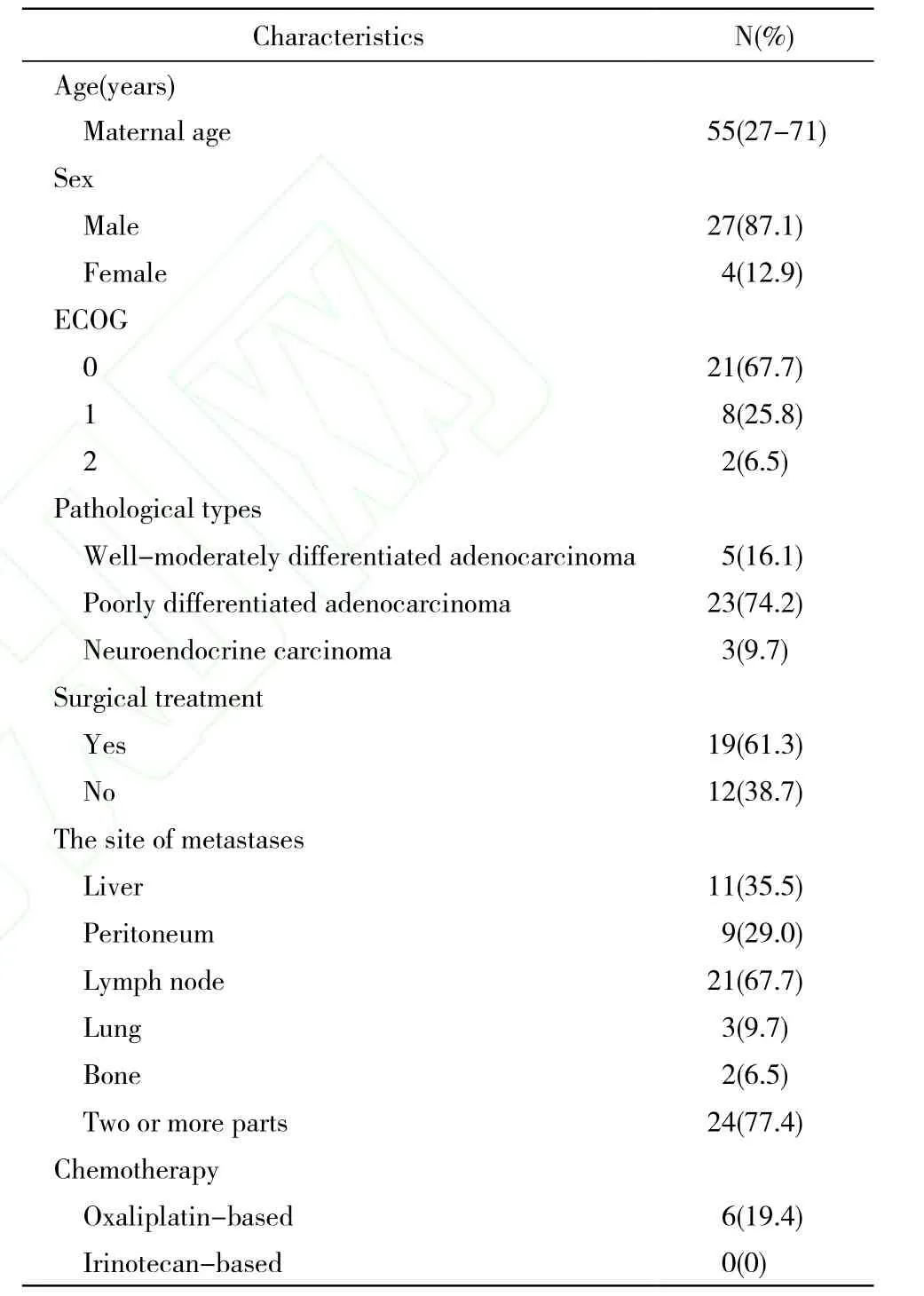
表1 31例患者一般临床特征Tab. 1 General clinical parameters of 31 patients included in this study
结 果
1 疗效评价 全部患者均可评价疗效。31例均完成2个周期以上化疗,共接受132周期化疗,中位化疗时间为4周期(2 ~ 9周期)。完全缓解(CR)1例(3.2%),部分缓解(PR)6例(19.4%),稳定(SD)19例(61.3%),进展(PD)5例(16.1%),有效率(CR+PR)22.6%,疾病控制率(CR+PR+SD)83.9%。
2 生存时间 31例中位无进展生存期(PFS)5.0个月(95% CI:3.2 ~ 6.8),无进展生存曲线如图1所示,中位总生存时间(OS)7.8个月(95% CI:6.7 ~ 8.9)。总生存曲线如图2所示。
3 不良反应 全部患者均可评价不良反应。主要不良反应是骨髓抑制,腹泻、恶心呕吐,无治疗相关性死亡。其中严重不良反应包括粒细胞减少3级以上5例(16.1%),白细胞减少3级以上6例(19.4%),血小板减少3级以上3例(9.7%),贫血3级以上2例(6.5%),腹泻3级以上2例(6.5%)。详见表2。
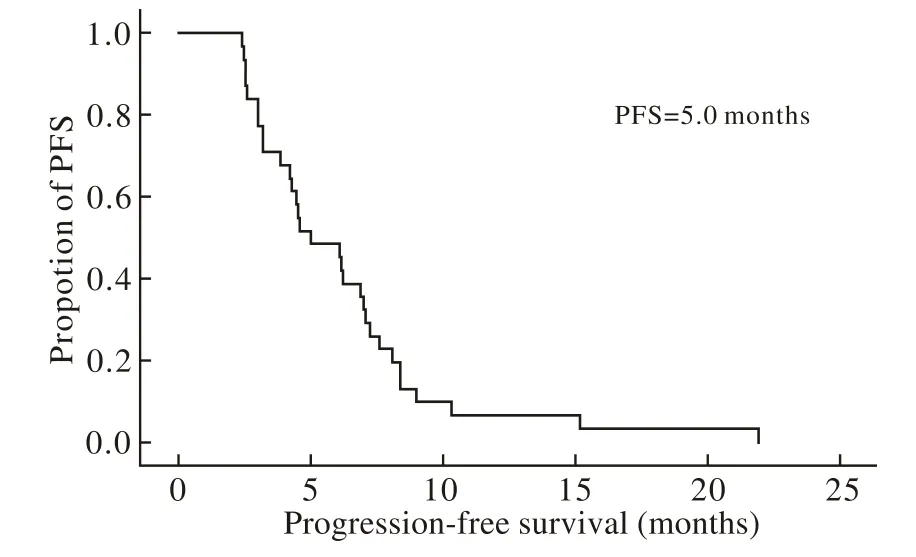
图1 无进展生存曲线Fig. 1 Progression-free survival curve
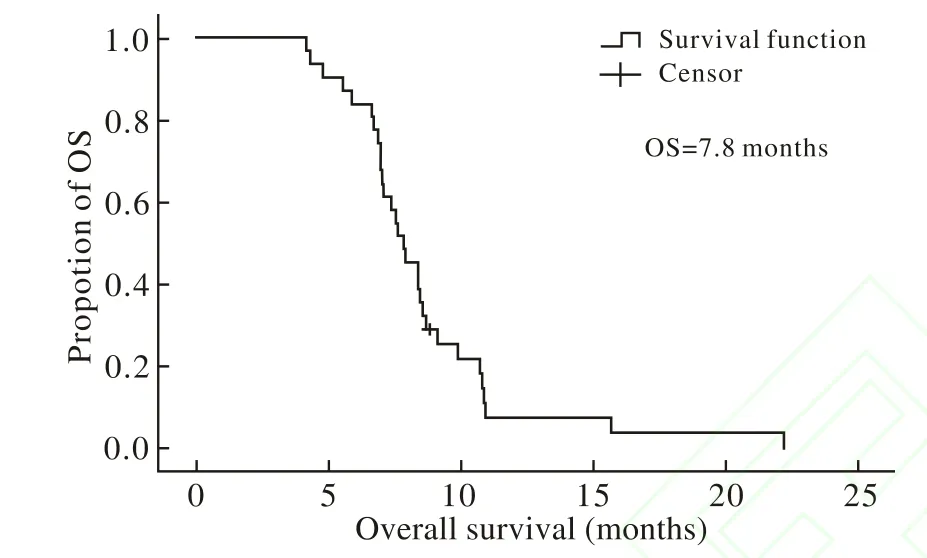
图2 总生存曲线Fig. 2 Overall survival curve
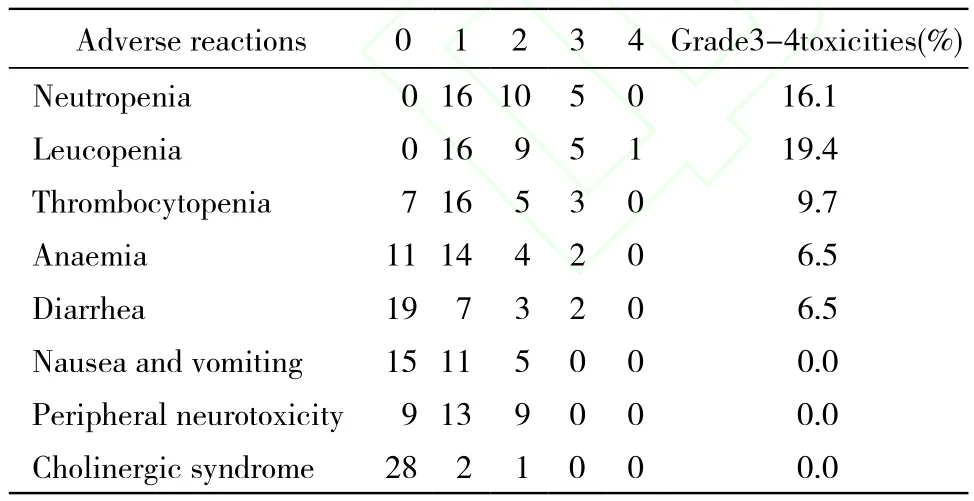
表2 31例患者化疗后不良反应分级Tab. 2 Adverse reactions in 31 patients after chemotherapy
讨 论
晚期胃癌在二线化疗失败后至今尚无标准治疗方案推荐,且此时患者免疫力低下、耐受性差,临床上需探寻有效、安全、可耐受的化疗方案。有关晚期胃癌三线治疗方案疗效及安全性的临床研究相对较少。近年来,随着伊立替康、奥沙利铂、紫杉类药物等新药的出现,国内外对三线治疗晚期胃癌均作了一些尝试,有关研究证实FOLFIRI、伊立替康联合顺铂等方案对晚期胃癌三线治疗疗效确切,患者可耐受(表3)。
伊立替康(CPT-11)是经化学修饰的天然喜树碱衍生物,能够特异性抑制拓扑异构酶Ⅰ(Topo-Ⅰ),阻断DNA复制和转录过程,使DNA产生不可逆损伤从而导致细胞死亡,不易与其他化疗药物产生交叉耐药性[6]。伊立替康单药的有效率可达18% ~ 23%,并对已产生多药耐药的肿瘤仍然有效[7]。一项Ⅲ期随机临床研究结果也显示伊立替康较最佳支持治疗能显著延长总生存期[8]。另有多项研究也显示含伊立替康方案一线、二线治疗晚期胃癌安全有效,中位总生存在5.8-9.1月不等[9-13]。因此NCCN指南推荐含伊立替康方案可用于晚期胃癌的一、二线化疗。
奥沙利铂(L-0HP)作为新一代的周期非特异性铂类药物,以1,2-二氨环己烷(DACH)基团取代顺铂(DDP)的NH4,以DNA为作用靶点,与DNA结合速率比DDP快10倍以上。临床研究表明,奥沙利铂对多种消化道肿瘤均有显著抑制作用,且与多种化疗药物有协同效应[14]。多项研究结果显示含奥沙利铂方案一线、二线治疗晚期胃癌是安全有效的[15-17]。
最近研究认为新的联合治疗方案[18-19],与传统单药治疗相比可明显提高晚期胃癌的疗效。理论上,伊立替康与奥沙利铂的联合,有非常广谱的抗肿瘤活性,二者的药理作用互不叠加,不产生交叉耐药,在某种程度上有协同效应,可以作为晚期胃癌解救治疗的一种选择。因此若患者能够耐受,伊立替康与奥沙利铂两药联合方案或许可以更好地延长患者的生存期。与国外其他的三线研究相比,本研究中伊立替康和奥沙利铂联合,近期有效率肯定,PFS、OS均有所延长。奥地利一项Ⅱ期多中心临床试验研究结果显示,38例晚期胃癌患者一线接受奥沙利铂(85 mg/m2)联合伊立替康(125 mg/m2)双周方案化疗,其中CR(8%)3例,PR(50%)19例,SD(29%)11例,PD(13%)5例 ,PFS为5.3月,OS为9.5月[20]。该研究也证实了伊立替康联合奥沙利铂化疗的有效性和安全性。
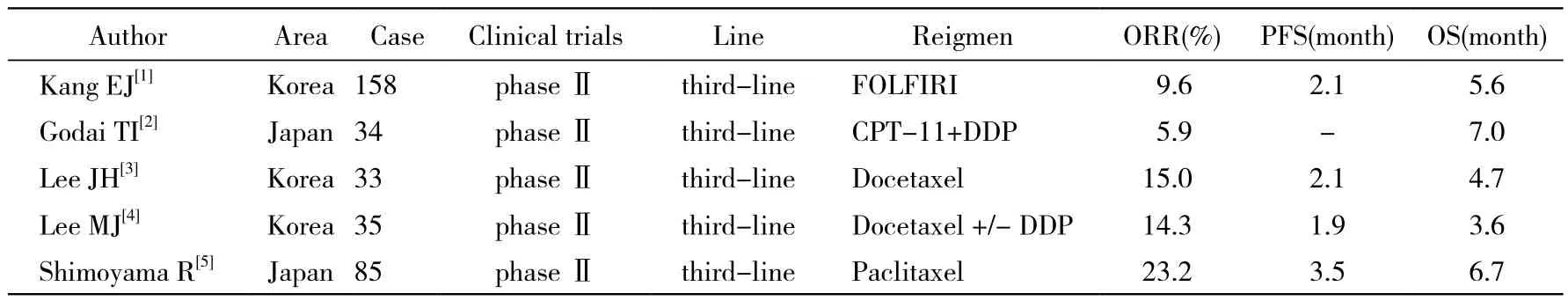
表3 国内外三线治疗晚期胃癌的临床研究Tab. 3 Clinical study of third-line chemotherapy for advanced gastric cancer both in domestic and foreign
本研究全部31例患者,既往均未接受含伊立替康方案化疗,其中接受含奥沙利铂方案一线化疗6例,且6例患者疾病控制率为100%(3例SD,2例PR,1例CR)。因此笔者思考既往接受含奥沙利铂方案治疗并获益的患者,更有可能在三线伊立替康联合奥沙利铂的治疗中获益。日本的一项研究认为胃癌一线治疗的反应情况可预测二线、三线治疗的疗效,即一线治疗后疾病是否稳定是影响患者二、三线治疗后生存预后的一个重要因素[21],这也进一步证实了我们的考虑。
另外,既往含奥沙利铂方案治疗进展的患者,不除外对氟尿嘧啶产生耐药的可能,或许可以继续从奥沙利铂联合伊立替康的治疗中获益。Suzuki等应用伊立替康联合顺铂二线治疗对5-FU耐药的晚期胃癌,有效率仍达到36.4%[22]。奥沙利铂与顺铂相比,抑制DNA作用显著提高,其抗癌活性更优于顺铂,毒副作用更小。
需要特别强调的是该方案化疗的剂量强度。因患者既往经多线治疗,本研究中采用CPT-11 180 mg/m2静注,LOHP 85mg/m2静注,21天为1个周期。治疗后主要不良反应表现为骨髓抑制包括粒细胞、白细胞、血小板减少及贫血,腹泻,恶心呕吐,但Ⅲ~Ⅳ度不良反应发生率低。神经系统毒性主要表现为对冷刺激敏感和肢端发麻,大多为Ⅰ~Ⅱ度,停药后症状消失。与国外报道的三线治疗[3-5]相比不良反应相对较轻,患者均可耐受。
综上所述,伊立替康联合奥沙利铂三线治疗晚期胃癌近期疗效确切,远期生存状况有所改善,不良反应可耐受,可作为晚期胃癌的三线挽救治疗方案,值得临床上进一步推广。但由于本研究样本量较小,同时也需要大规模、多中心的临床试验进一步深入研究。
1 Kang EJ, Im SA, Oh DY, et al. Irinotecan combined with 5-fluorouracil and leucovorin third-line chemotherapy after failure of fluoropyrimidine, Platinum, and taxane in gastric Cancer: treatment outcomes and a prognostic model to predict survival[J]. Gastric Cancer, 2013, 16(4): 581-589.
2 Godai TI, Oshima T, Numata M, et al. Clinical efficacy and safety of CPT-11+CDDP therapy as third-line chemotherapy for advanced and recurrent gastric Cancer[J]. Gan To Kagaku Ryoho, 2011, 38(6):945-949.
3 Lee JH, Kim SH, Oh SY, et al. Third-line docetaxel chemotherapy for recurrent and metastatic gastric Cancer[J]. Korean J Intern Med, 2013, 28(3): 314-321.
4 Lee MJ, Hwang IG, Jang JS, et al. Outcomes of third-line docetaxelbased chemotherapy in advanced gastric Cancer who failed previous oxaliplatin-based and irinotecan-based chemotherapies[J]. Cancer Res Treat, 2012, 44(4): 235-241.
5 Shimoyama R, Yasui H, Boku N, et al. Weekly paclitaxel for heavily treated advanced or recurrent gastric Cancer refractory to fluorouracil,irinotecan, and cisplatin[J]. Gastric Cancer, 2009, 12(4):206-211.
6 Sena K, Morotome Y, Baba O, et al. Gene expression of growth differentiation factors in the developing periodontium of rat molars[J]. J Dent Res, 2003, 82(3): 166-171.
7 Beretta E, Di Bartolomeo M, Buzzoni R, et al. Irinotecan,fluorouracil and folinic acid (FOLFIRI) as effective treatment combination for patients with advanced gastric Cancer in poor clinical condition[J]. Tumori, 2006, 92(5): 379-383.
8 Thuss-Patience PC, Kretzschmar A, Bichev D, et al. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer--a randomised phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO)[J]. Eur J Cancer, 2011, 47(15): 2306-2314.
9 Baek JH, Kim JG, Sohn SK, et al. Biweekly irinotecan and cisplatin as second-line chemotherapy in pretreated patients with advanced gastric Cancer: a multicenter phase II study[J]. J Korean Med Sci, 2005, 20(6): 966-970.
10 Sun Q, Hang M, Xu W, et al. Irinotecan plus capecitabine as a second-line treatment after failure of 5-fluorouracil and Platinum in patients with advanced gastric Cancer[J]. Jpn J Clin Oncol, 2009,39(12): 791-796.
11 Sym SJ, Chang HM, Kang HJ, et al. A phase II study of irinotecan and docetaxel combination chemotherapy for patients with previously treated metastatic or recurrent advanced gastric cancer[J]. Cancer Chemother Pharmacol, 2008, 63(1):1-8.
12 Ajani JA, Baker J, Pisters PW, et al. Irinotecan/cisplatin in advanced, treated gastric or gastroesophageal junction carcinoma[J]. Oncology(Williston Park), 2002, 16(5 Suppl 5):16-18.
13 Mochizuki Y, Ohashi N, Kojima H, et al. CPT-11 as a second-line treatment for patients with advanced/metastatic gastric Cancer who failed S-1 (CCOG0702)[J]. Cancer Chemother Pharmacol, 2013,72(3): 629-635.
14 Persiani R, D'Ugo D, Rausei S, et al. Prognostic indicators in locally advanced gastric Cancer (LAGC) treated with preoperative chemotherapy and D2-gastrectomy[J]. J Surg Oncol, 2005, 89(4):227-236.
15 Yeh YS, Tsai HL, Ma CJ, et al. A retrospective study of the safety and efficacy of a first-line treatment with modified FOLFOX-4 in unresectable advanced or recurrent gastric cancer patients[J]. Chemotherapy, 2012, 58(5):411-418.
16 Catalano V, Bisonni R, Graziano F, et al. A phase II study of modified FOLFOX as first-line chemotherapy for metastatic gastric Cancer in elderly patients with associated diseases[J]. Gastric Cancer, 2013, 16(3): 411-419.
17 Tsuji K, Yasui H, Onozawa Y, et al. Modified FOLFOX-6 therapy for heavily pretreated advanced gastric Cancer refractory to fluorouracil, irinotecan, cisplatin and taxanes: a retrospective study[J]. Jpn J Clin Oncol, 2012, 42(8): 686-690.
18 Pozzo C, Barone C. Is there an optimal chemotherapy regimen for the treatment of advanced gastric Cancer that will provide a platform for the introduction of new biological agents?[J]. Oncologist, 2008,13(7): 794-806.
19 Koizumi W, Takiuchi H, Yamada Y, et al. Phase II study of oxaliplatin plus S-1 as first-line treatment for advanced gastric Cancer (G-SOX study)[J]. Ann Oncol, 2010, 21(5): 1001-1005.
20 Wöll E, Kühr T, Eisterer W, et al. Biweekly oxaliplatin and irinotecan chemotherapy in advanced gastric Cancer. A first-line multicenter phase II trial of the Arbeitsgemeinschaft Medikamentöse Tumortherapie (AGMT)[J]. Anticancer Res, 2008, 28(5B):2901-2905.
21 Kodera Y, Ito Y, Ohashi N, et al. Impact of clinical response to firstline chemotherapy on gastric Cancer patients treated with second-line and third-line chemotherapy[J]. Hepatogastroenterology, 2011,58(107-108): 1041-1045.
22 Suzuki S, Harada N, Takeo Y, et al. Bi-weekly irinotecan hydrochloride and cisplatin as a second-line chemotherapy for patients with advanced gastric Cancer[J]. Gan To Kagaku Ryoho,2007, 34(13): 2245-2248.

