直肠癌术前同期加量放疗三种不同照射技术的剂量学比较
杨咏强,冯林春,王运来,解传滨,葛瑞刚,巩汉顺,丛小虎,王金媛,陈 静
1解放军总医院 放疗科,北京 100853;2解放军总医院海南分院 放疗科,海南三亚 572000
术前同步放化疗是局部中晚期直肠癌的首选治疗方法。但采用三维适形放疗技术(threedimensional conformal radiotherapy,3DCRT),3/4级急性不良反应的发生率较高(15% ~ 29%)[1-2]。近年来,调强放疗(intensity-modulated radiotherapy,IMRT)已广泛应用于直肠癌术前放疗,IMRT较3DCRT能减少小肠等组织的照射剂量,进而减少腹泻等不良反应的发生率[3-5]。此外,采用同期加量IMRT技术可以实现肿瘤局部加量照射,提高了生物有效剂量(biologically effective dose,BED),进而提高病理完全反应率(pathological complete response,ypCR)、局部控制率和生存率[6-7]。螺旋断层放疗(helical tomotherapy,HT)技术应用于直肠癌术前放疗也有研究报道[8-12]。但目前国内外尚无3DCRT、静态IMRT和HT 3种照射技术应用于直肠癌术前同期加量放疗的系统剂量学比较研究。本研究探讨了3野3DCRT、9野IMRT和HT的剂量分布特点,为临床上选择直肠癌术前放疗方法提供参考。
资料和方法
1 临床资料 选取10例2011- 2012年间在我院放疗科行直肠癌术前同步放化疗患者的定位CT图像。所选患者肿瘤临床分期均为Ⅱ~Ⅲ期。在定位前,所有患者充分充盈膀胱,定位时采用仰卧位,热塑体模固定,在Philips Brilliance CT定位机下行CT增强扫描,扫描范围为L2下缘至坐骨结节下5 cm,扫描层厚为5 mm。使用Pinancle3 8.0 m治疗计划系统勾画靶区及危及器官。
2 靶区及危及器官勾画 参照ICRU 50号和62号报告[13],GTV为肿瘤原发病灶和转移淋巴结,pGTV为GTV三维方向各外扩1 cm。CTV为GTV、直肠、骶前区、盆腔侧壁、坐骨直肠窝及盆腔区域淋巴结(直肠系膜区、直肠上动脉区、低位髂总、髂内及闭孔动脉区),如果肿瘤侵犯前列腺、膀胱或子宫,CTV还应包括髂外淋巴结区,若阴道下1/3或肛管受累及,CTV则需包括腹股沟淋巴结区。PTV为CTV三维方向各外扩0.5 cm。危及器官包括:小肠(勾画至PTV上3 cm)、膀胱、骨盆(仅勾画骨窗上骶骨、髂骨、坐骨及耻骨的低密度区)、双侧股骨头。
3 治疗计划设计 为每例患者分别设计3野3DCRT、9野IMRT和HT计划。3DCRT和IMRT计划在Pinancle3 8.0 m治疗计划系统上完成,HT计划在TomoPlan治疗计划系统上完成,所有计划均采用6 MV X线。处方剂量:PTV给予50 Gy分25次,2.0 Gy/次,要求至少95%的PTV达到47.5 Gy (95%×50 Gy);pGTV同期加量至56.25 Gy分25次,2.25 Gy/次,要求至少95%的pGTV达到53.5 Gy (95%×56.25 Gy),D1<60.2 Gy(107%×56.25 Gy)。危及器官剂量限制要求:小肠V30<40%,膀胱V40<45%,骨盆V40<50%,双侧股骨头V40<5%。3DCRT计划采用一后两侧野,根据具体情况调节射野权重和楔形板角度以达到最优剂量分布。IMRT计划采用9个野均分共面照射,机架角度分别为20°、60°、100°、140°、180°、220°、260°、300°、340°,最大子野个数限定为100个。HT计划采用360°旋转照射。
4 治疗计划评价 利用剂量体积直方图评价靶区剂量分布和危及器官照射剂量。1)靶区的评价参数:①D95、中位剂量(D50)、最低剂量(D98)及最高剂量(D2);②适形指数(conformity index,CI):CIpGTV定义为VTV/VpGTV,VTV为53.5 Gy等剂量线包绕的所有区域体积,VpGTV为pGTV体积。CIPTV定义为VTV/VPTV,VTV为47.5 Gy等剂量线包绕的所有区域体积,VPTV为PTV体积。CI值越接近1则说明靶区适形度越好。③均匀指数(homogeneity index,HI):HIpGTV定 义 为 (D2-D98)/DRx,,DRx为pGTV的处方剂量56.25 Gy。HI值越接近0表示剂量均匀性越好。2)危及器官的评价参数:小肠平均剂量(Dmean)、V50、V45、V40、V30、V20、V15、V10,膀胱及骨盆Dmean、V50、V40、V30、V20、V10,双侧股骨头Dmean、V45、V40、V30、V20、V15、V10。
5 统计学处理 用SPSS19.0统计软件分析,行配对t检验或配对样本非参数秩和检验。P<0.05为差异有统计学意义。
结 果
1 3种治疗计划均可满足靶区处方剂量要求 53.5 Gy等剂量曲线对pGTV及47.5 Gy等剂量曲线对PTV的适形程度HT计划最优,IMRT计划略优于3DCRT计划(图1)。靶区剂量参数、CI和HI的比较结果,其中pGTV中位剂量HT计划<3DCRT计划<IMRT计划,PTV中位剂量HT计划<IMRT及3DCRT计划,CIpGTV及CIPTV值HT计划<IMRT计划<3DCRT计划,HIpGTV值HT计划<IMRT及3DCRT计划(表1)。3种治疗计划比较HT计划的剂量梯度最优(图2A)。
2 IMRT和HT计划可满足所有危及器官剂量限制要求 小肠体积为 (467.5±132.8) cc,对小肠的保护,IMRT和HT计划明显优于3DCRT计划,HT计划略优于IMRT计划。对膀胱、骨盆及股骨头的保护,IMRT计划均明显优于3DCRT计划而逊于HT计划。3DCRT计划未满足膀胱、骨盆与股骨头的剂量限制要求。详见表2和图2B。
讨 论
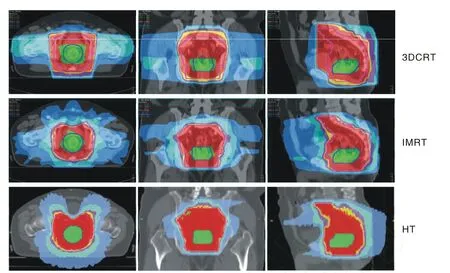
图1 同一临床分期为T3N0低位直肠癌患者的等剂量曲线分布Fig. 1 Isodose distribution curve for a patient with a cT3N0 lower rectal cancer

图2 同一患者3种治疗计划靶区及危及器官的剂量体积直方图 A.靶区;B.危及器官Fig. 2 Dose-volume histogram of target areas (A) and involved organs (B) in a patient undergoing 3 radiotherapies
表1 3种治疗计划靶区参数比较Tab 1 Dose statistics comparison for planning target volumes(±s)
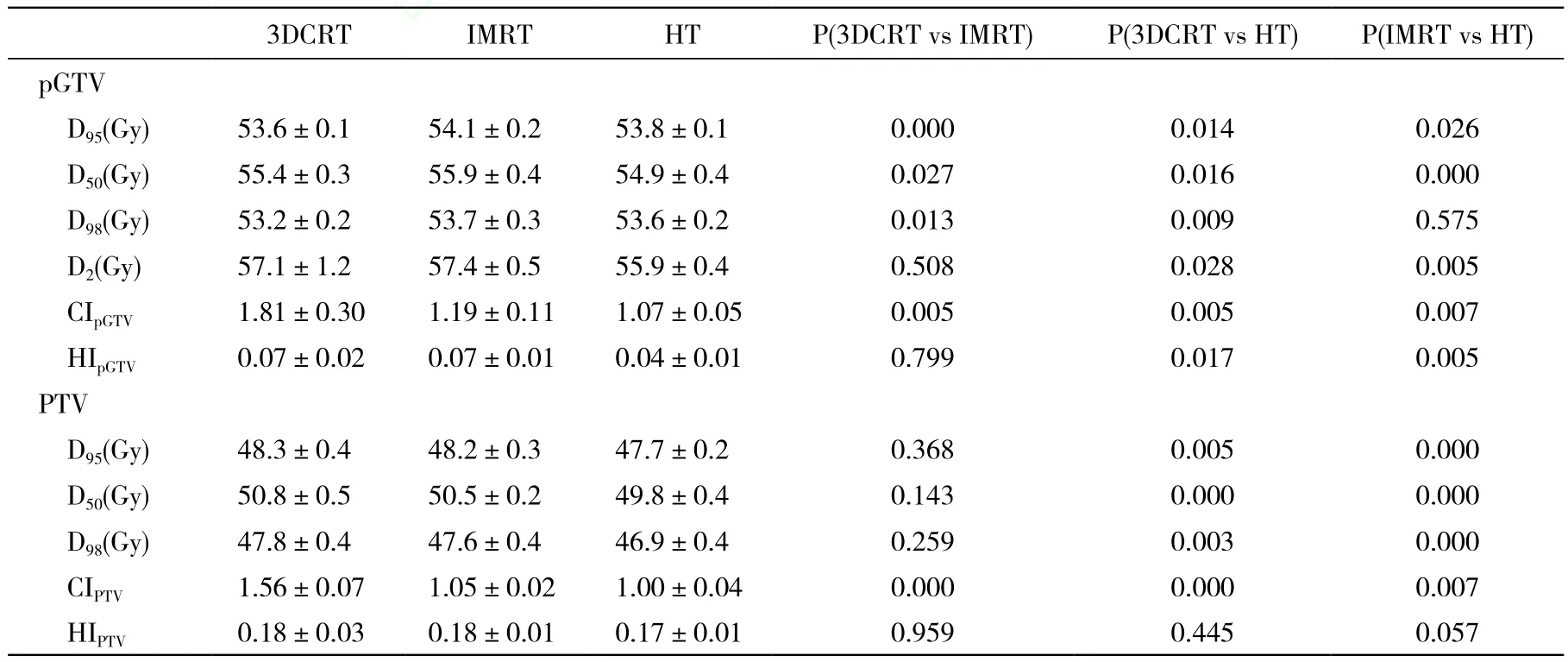
表1 3种治疗计划靶区参数比较Tab 1 Dose statistics comparison for planning target volumes(±s)
HT: helical tomotherapy; IMRT: intensity-modulated radiotherapy; 3DCRT: 3-dimensional conformal radiotherapy; CI: conformity index; HI: homogeneity index
3DCRT IMRT HT P(3DCRT vs IMRT) P(3DCRT vs HT) P(IMRT vs HT) pGTV D95(Gy) 53.6±0.1 54.1±0.2 53.8±0.1 0.000 0.014 0.026 D50(Gy) 55.4±0.3 55.9±0.4 54.9±0.4 0.027 0.016 0.000 D98(Gy) 53.2±0.2 53.7±0.3 53.6±0.2 0.013 0.009 0.575 D2(Gy) 57.1±1.2 57.4±0.5 55.9±0.4 0.508 0.028 0.005 CIpGTV 1.81±0.30 1.19±0.11 1.07±0.05 0.005 0.005 0.007 HIpGTV 0.07±0.02 0.07±0.01 0.04±0.01 0.799 0.017 0.005 PTV D95(Gy) 48.3±0.4 48.2±0.3 47.7±0.2 0.368 0.005 0.000 D50(Gy) 50.8±0.5 50.5±0.2 49.8±0.4 0.143 0.000 0.000 D98(Gy) 47.8±0.4 47.6±0.4 46.9±0.4 0.259 0.003 0.000 CIPTV 1.56±0.07 1.05±0.02 1.00±0.04 0.000 0.000 0.007 HIPTV 0.18±0.03 0.18±0.01 0.17±0.01 0.959 0.445 0.057
表2 3种治疗计划危及器官参数比较Tab. 2 Dose parameters for involved organs in 3 radiotherapies(±s)

表2 3种治疗计划危及器官参数比较Tab. 2 Dose parameters for involved organs in 3 radiotherapies(±s)
HT, helical tomotherapy; IMRT, intensity-modulated radiotherapy; 3DCRT, three-dimensional conformal radiotherapy
3DCRT IMRT HT P(3D-CRT vs. IMRT) P(3D-CRT vs. HT) P(IMRT vs. HT) Small bowel Dmean(Gy) 23.5±6.5 20.8±5.6 19.3±5.9 0.010 0.001 0.029 V50(cc) 41.5±45.3 7.5±9.7 6.5±7.7 0.028 0.028 0.779 V45(cc) 72.7±55.7 32.2±29.0 25.2±23.2 0.005 0.005 0.005 V40(cc) 85.5±59.8 49.1±36.6 38.3±30.5 0.001 0.002 0.013 V30(cc) 134.9±80.6 111.5±63.1 92.7±63.7 0.037 0.016 0.017 V20(cc) 237.4±110.5 248.8±116.9 198.3±96.4 0.398 0.009 0.002 V15(cc) 304.7±113.2 283.5±124.8 240.7±102.0 0.038 0.000 0.003 V10(cc) 356.8±112.4 315.2±129.0 301.9±119.9 0.003 0.001 0.055 Bladder Dmean(Gy) 43.7±2.0 35.7±1.3 27.0±1.9 0.000 0.000 0.000 V50(%) 50.1±11.8 7.6±3.6 5.6±3.3 0.005 0.005 0.093 V40(%) 69.7±7.4 35.7±5.1 25.9±6.5 0.000 0.000 0.000 V30(%) 79.8±6.8 62.7±5.3 40.6±6.8 0.000 0.000 0.000 V20(%) 99.7±0.7 99.3±1.2 58.4±4.7 0.176 0.005 0.005 V10(%) 100.0±0.0 99.9±0.2 89.7±7.1 0.180 0.008 0.008 Pelvic bones Dmean(Gy) 39.1±1.3 34.1±1.0 31.3±1.0 0.000 0.000 0.000 V50(%) 11.9±3.7 6.1±1.7 4.8±2.0 0.000 0.000 0.213 V40(%) 58.2±4.4 36.8±3.3 33.4±4.3 0.000 0.000 0.004 V30(%) 77.4±4.9 65.2±3.6 47.7±2.3 0.005 0.005 0.005 V20(%) 91.3±1.8 86.6±2.6 78.2±4.5 0.005 0.005 0.005 V10(%) 94.3±1.4 94.7±1.9 96.3±1.7 0.334 0.001 0.001 Femoral heads Dmean(Gy) 30.8±3.3 26.7±1.5 23.0±2.6 0.001 0.000 0.001 V45(%) 7.1±7.4 0.4±0.6 0.1±0.1 0.005 0.005 0.015 V40(%) 12.2±9.2 2.3±1.7 1.2±1.4 0.005 0.005 0.037 V30(%) 46.9±31.2 23.3±6.5 12.2±8.1 0.022 0.005 0.009 V20(%) 95.0±6.2 91.3±7.9 65.2±24.1 0.203 0.022 0.005 V10(%) 99.1±1.3 100.0±0.0 100.0±0.0 0.068 1.000 1.000
直肠癌的放疗靶区多为凹形靶区,3DCRT计划要想取得理想的靶区覆盖,必然会增加靶区周围小肠和膀胱等组织的照射剂量,导致放疗不良反应的发生率增加。IMRT在直肠癌术前放疗中的优势已有多项研究报道,采用同期加量IMRT技术提高肿瘤照射剂量取得了可喜的治疗结果[6-7]。有研究结果显示,HT计划较IMRT计划能进一步减少小肠照射剂量、体积,有望降低肠道不良反应的发生率[8,11-12]。
我科初步研究结果显示,此同期加量处方剂量模式下,5野与3野3DCRT计划靶区适形度相似,但5野计划明显增加了骨盆和股骨头的照射剂量,差异有统计学意义,因此,本研究采用了3野3DCRT计划,9野IMRT计划。9野IMRT计划的膀胱V30、V40及股骨头V20、V30、V40略低于7野IMRT计划,差异有统计学意义,2种计划靶区剂量参数和适形指数相似。
本研究结果显示,此同期加量处方剂量模式下,3DCRT计划无法满足膀胱、骨盆与股骨头的剂量限制要求。在满足靶区处方剂量的前提下,IMRT及HT计划在靶区适形度和危及器官保护方面均优于3DCRT计划,HT计划又略优于IMRT计划。
小肠是直肠癌放疗最主要的剂量限制器官,肠道不良反应的发生率与小肠的照射剂量、体积密切相关。Baglan等[14]的研究结果显示,急性肠道不良反应的发生率与小肠低剂量照射体积尤其是V15关系密切,在V15<150 cc、150 ~ 299 cc和≥300 cc时,3级急性肠道不良反应的发生率分别为0、30%和70%。Gallagher等[15]报道,小肠高剂量照射体积V45>78 cc或V50>17 cc会明显增加晚期肠道不良反应的发生率。著名的德国CAO/ARO/AIO-94Ⅲ期临床研究中,术前放疗采用3DCRT技术,3/4级急性和晚期肠道不良反应的发生率分别为12%和9%[16]。Engels等[12]的Ⅱ期临床研究共入组了108例直肠癌术前HT治疗患者,其中51例单纯给予盆腔照射46 Gy分23次,另外57例肿瘤区同期加量至55.2 Gy分23次,仅有1例发生3级腹泻,3/4级晚期肠道不良反应的发生率为6%,显示了HT在小肠保护方面的优势。本研究结果中,HT计划的小肠V15<IMRT计划<3DCRT计划,分别为(240.7±102.0)、(283.5± 124.8)及(304.7±113.2) cc,两两差异均有统计学意义。3种治疗计划的小肠V45分别为(25.2±23.2)、(32.2±29.0)及(72.7±55.7) cc,两两差异有统计学意义。因此,HT有望进一步降低肠道不良反应的发生率,但具体治疗结果有待进一步临床评估。
成人约50%有造血活性的骨髓组织位于骨盆,属于放射敏感组织。Rose等[17]报道,对于盆腔肿瘤行同步放化疗患者,急性血液毒性与骨盆低剂量照射体积V10及V20明显相关,V10≥95%和V10<95%组患者的严重骨髓抑制发生率分别为68.8%和24.6%(P<0.001),V20≥76%和V20<76%组分别为57.7%和21.8%(P=0.001)。本研究中,HT计划的骨盆V20<IMRT计划<3DCRT计划(P=0.005)。但HT计划的骨盆V10略高于IMRT及3DCRT计划(P=0.001)。HT在减少直肠癌术前放化疗中血液毒性方面的价值有待进一步研究。
此研究中,IMRT计划较3DCRT计划明显降低了膀胱和股骨头高、低剂量照射体积,HT计划较IMRT计划进一步降低了照射剂量。但考虑到直肠癌放疗中严重膀胱不良事件发生率低,与IMRT相比HT在保护膀胱方面的价值可能有限。对于双侧股骨头,IMRT计划和HT计划均可满足股骨头V40<5%,而且既往罕有直肠癌放疗引起股骨头不良事件的文献报道,HT较IMRT在保护股骨头方面的临床价值可能有限。
综上所述,在处方剂量为pGTV给予56.25 Gy分25次、PTV给予50 Gy分25次的直肠癌术前同期加量放疗中,3DCRT计划无法满足危及器官剂量限制要求,IMRT计划和HT计划均能满足靶区处方剂量和各危及器官剂量限制要求。IMRT和HT计划在靶区适形度和危及器官保护方面均明显优于3DCRT计划,HT较IMRT计划进一步降低了小肠、膀胱、骨盆及股骨头的照射剂量,但HT的疗效还有待进一步临床评估。
1 Gérard JP, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203[J]. J Clin Oncol, 2006, 24(28):4620-4625.
2 Braendengen M, Tveit KM, Berglund A, et al. Randomized phase III study comparing preoperative radiotherapy with chemoradiotherapy in nonresectable rectal Cancer[J]. J Clin Oncol, 2008, 26(22):3687-3694.
3 Arbea L, Ramos LI, Martínez-Monge R, et al. Intensity-modulated radiation therapy (IMRT) vs. 3D conformal radiotherapy (3DCRT) in locally advanced rectal cancer (LARC): dosimetric comparison and clinical implications[J]. Radiat Oncol, 2010, 5:17.
4 Mok H, Crane CH, Palmer MB, et al. Intensity modulated radiation therapy (IMRT): differences in target volumes and improvement in clinically relevant doses to small bowel in rectal carcinoma[J]. Radiat Oncol, 2011, 6:63.
5 Samuelian JM, Callister MD, Ashman JB, et al. Reduced acute bowel toxicity in patients treated with intensity-modulated radiotherapy for rectal Cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 82(5):1981-1987.
6 Ballonoff A, Kavanagh B, McCarter M, et al. Preoperative capecitabine and accelerated intensity-modulated radiotherapy in locally advanced rectal cancer: a phase II trial[J]. Am J Clin Oncol, 2008, 31(3):264-270.
7 Li JL, Ji JF, Cai Y, et al. Preoperative concomitant boost intensitymodulated radiotherapy with oral capecitabine in locally advanced mid-low rectal cancer: a phase II trial[J]. Radiother Oncol,2012, 102(1):4-9.
8 Engels B, De Ridder M, Tournel K, et al. Preoperative helical tomotherapy and megavoltage computed tomography for rectal Cancer: impact on the irradiated volume of small bowel[J]. Int J Radiat Oncol Biol Phys, 2009, 74(5): 1476-1480.
9 Jhaveri PM, Teh BS, Paulino AC, et al. Helical tomotherapy significantly reduces dose to normal tissues when compared to 3DCRT for locally advanced rectal cancer[J]. Technol Cancer Res Treat, 2009, 8(5):379-385.
10 De Ridder M, Tournel K, Van Nieuwenhove Y, et al. Phase II study of preoperative helical tomotherapy for rectal Cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 728-734.
11 Nguyen NP, Ceizyk M, Almeida F, et al. Effectiveness of imageguided radiotherapy for locally advanced rectal Cancer[J]. Ann Surg Oncol, 2011, 18(2): 380-385.
12 Engels B, Tournel K, Everaert H, et al. Phase II study of preoperative helical tomotherapy with a simultaneous integrated boost for rectal Cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1):142-148.
13 Chavaudra J, Bridier A. Definition of volumes in external radiotherapy: ICRU reports 50 and 62[J]. Cancer Radiother,2001, 5(5): 472-478.
14 Baglan KL, Frazier RC, Yan D, et al. The dose-volume relationship of acute small bowel toxicity from concurrent 5-FU-based chemotherapy and radiation therapy for rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2002, 52(1):176-183.
15 Gallagher MJ, Brereton HD, Rostock RA, et al. A prospective study of treatment techniques to minimize the volume of pelvic small bowel with reduction of acute and late effects associated with pelvic irradiation[J]. Int J Radiat Oncol Biol Phys, 1986, 12(9):1565-1573.
16 Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351(17):1731-1740..
17 Rose BS, Aydogan B, Liang Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical Cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(3): 800-807.

