周围神经Wallerian变性不同时间点对干细胞归巢的趋化作用
高旭鹏,彭 江,孙 逊,郭志远,王 玉,卢世璧,赵 庆
解放军总医院 骨科研究所,北京 100853
周围神经Wallerian变性不同时间点对干细胞归巢的趋化作用
高旭鹏,彭 江,孙 逊,郭志远,王 玉,卢世璧,赵 庆
解放军总医院 骨科研究所,北京 100853
目的观察周围神经损伤后不同时间点Wallerian变性对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)归巢的影响。方法 成年雄性SD大鼠72只,体质量220 ~ 250 g,按体质量编号随机分为6组(n=12),每组内再按注射细胞和药物的不同随机分为A、B两组,A组(n=6)经尾静脉注射红色荧光间充质干细胞(red fluorescence proteinbone marrow mesenchymal stem cells,RFP-BMSCs)和0.9%氯化钠注射液,B组(n=6)经尾静脉注射RFP-BMSCs和膜蛋白CXCR4特异性拮抗剂(AMD3100);所有实验动物均在无菌条件下暴露坐骨神经,并于梨状肌下缘切断坐骨神经,近端结扎,远端旷置,然后分别在坐骨神经切断后的1 d、3 d、7 d、14 d、1个月、2个月行尾静脉RFP-BMSCs+0.9%氯化钠注射液(A组)和RFP-BMSCs+AMD3100(B组)注射,并在注射后的第3天行活体成像系统观察。结果随着时间的延长,RFPBMSCs在发生Wallerian变性的坐骨神经中的聚集呈现先增高后降低的现象;坐骨神经Wallerian变性的早期(1 ~ 3 d),注射RFP-BMSCs+AMD3100(B组)的RFP-BMSCs聚集现象明显弱于RFP-BMSCs+0.9%氯化钠注射液(A组),其差异有统计学意义。结论干细胞可以向发生Wallerian变性的神经组织聚集,在不同的时间点,其归巢现象存在先增高后降低的现象;在Wallerian变性的早期,其归巢现象可能部分受到SDF-1-CXCR4轴的调控,可以被CXCR4特异性拮抗剂AMD3100所抑制。
骨髓间充质干细胞;周围神经损伤;干细胞归巢
间充质干细胞在某些信号的影响下具有向某类组织迁移聚集的能力,被称之为细胞归巢。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为一种被深入研究的组织工程种子细胞,不仅具有促进神经轴突生长,分泌神经营养因子,调控雪旺细胞活性等作用,而且能够通过SDF1-CXCR4等细胞通路向中枢神经、心肌等损伤部位迁移和归巢,参与修复过程[1-6]。周围神经损伤后,其远端发生一系列代谢及结构变化,称为Wallerian变性[7]。Wallerian变性的神经能否趋化骨髓干细胞归巢,其时间特点如何,以及能否被CXCR4的特异性抑制剂AMD3100所抑制?本实验尝试采用活体成像系统观察周围神经损伤后不同时间Wallerian变性对BMSCs归巢能力的影响。
材料和方法
1 主要材料与仪器 OriCellTM表达红色荧光蛋白(red fluorescent protein-bone marrow stromal cells,RFP-BMSCs)的骨髓间质干细胞,由赛业(广州)生物科技有限公司提供。SD大鼠骨髓间质干细胞完全培养基[赛业(广州)生物科技有限公司],0.25%胰蛋白酶(Gibco公司,美国),10%胎牛血清(FBS)(杭州四季青生物工程有限公司),10 μmol/ml AMD3100(SIGMA公司,美国),CO2培养箱B5060型(Hereus公司,德国),光学显微镜及成像系统BX51型(Olympus公司,日本),图像分析系统Image Pro Plus(Media Cybernetics公司,美国),小动物活体成像系统NightOwlⅡLB 983型(Berthold公司,德国),生物净化台SW-CJ-1F(苏州净化设备有限公司)。
2 实验动物 成年雄性SD大鼠72只,清洁级,体质量220 ~ 250 g;均由解放军总医院实验动物中心提供。
3 大鼠RFP-BMSCs的体外培养 将冻存的第3代RFP-BMSCs(由广州赛业生物科技有限公司提供)在1 800 r/m条件下离心5 min,收集细胞成分,置于含血清的培养液中;在5% CO2、37℃下培养,每3 ~ 4 d更换新培养液;在细胞生长达到80% ~90%融合的时候,使用Hank's液洗涤2次,使用含0.25%胰酶的胰酶液在37℃下消化3 min,胎牛血清终止消化,然后按照1∶3的比例接种于新的培养瓶,获得稳定表达RFP的细胞。同法扩增细胞至第5代,备用。
4 细胞免疫荧光检测RFP-BMSCs的CXCR4表达对大鼠第4代RFP-BMSCs爬片,并使用CXCR4抗体行免疫荧光染色,Hoechst 33258标记细胞核,荧光显微镜下观察CXCR4在RFP-BMSCs在细胞膜上的分布。
5 周围神经损伤模型的建立 取SD大鼠72只,按体质量编号随机分为6组(n=12),每组内再按注射细胞和药物的不同随机分为A和B两个小组,A组(n=6)经尾静脉注射RFP-BMSCs和0.9%氯化钠注射液,B组(n=6)经尾静脉注射RFP-BMSCs和膜蛋白CXCR4特异性拮抗剂(AMD3100)。电子秤称量大鼠体质量,采用10%的水合氯醛0.3 ml/100 g行腹腔注射麻醉,麻醉稳定的大鼠剃除右侧后肢被毛,固定于手术台上,俯卧位。碘伏消毒双后肢,铺手术单,纵向剪开右后肢背侧皮肤1.5 ~ 2 cm,分离皮下组织及肌肉,沿肌间隙暴露坐骨神经至梨状肌下,在梨状肌下缘使用显微剪断坐骨神经主干,近端2/0结扎,远端旷置,逐层缝合肌肉皮肤,松开大鼠,放鼠回笼。
6 RFP-BMSCs的尾静脉注射移植及AMD3100尾静脉注射干预 所有SD大鼠于造模后1 d、3 d、7 d、14 d、1个月、2个月行尾静脉RFP-BMSCs+0.9%氯化钠注射液(A组)和RFP-BMSCs+AMD3100(B组)注射。步骤:以0.25%胰酶收集RFP-BMSCs,并用血细胞计数板行细胞计数,以无血清DMEM液重悬浮细胞,调整细胞浓度为1×107/ml,使用特制固定器固定大鼠,以温水浸泡鼠尾,使尾静脉扩张。A组从尾静脉缓慢注射0.9%氯化钠注射液0.5 ml,B组注射无菌PBS稀释的终浓度为10 μmol/ml AMD3100溶液0.5 ml,30 min后A、B两组分别经尾静脉注射0.5 ml细胞悬液,注射时间为5 min[8-10]。
7 活体成像系统检测RFP-BMSCs向损伤神经段的归巢 由于被激发的RFP-BMSCs的红色荧光无法穿透肥厚的SD大鼠的肌肉组织,因此我们通过处死SD大鼠获取神经组织来对其直接进行观察。各组SD大鼠于细胞静脉移植后3 d处死,取术侧和检测神经段行活体成像检测:采用过量10%的水合氯醛行腹腔注射处死大鼠,固定于手术台上,俯卧位,纵向剪开双后肢背侧皮肤,分离皮下组织及肌肉,沿肌间隙暴露坐骨神经,手术显微镜下在皮神经分叉远端使用显微剪断取下双侧坐骨神经主干,长度约1.5 cm,剔除神经周围结缔组织,4℃PBS中保存。将修剪好的双侧坐骨神经平放于黑色背景纸上,置于活体成像系统中,使用环状激发光源均匀激发成像,激发光波长为530 nm,曝光时间1 s。使用IndiGo图像系统分析得到的荧光图像,可获得每份神经组织上的平均光子强度,将每组各只动物右侧损伤神经与左侧正常对照神经的平均荧光光子强度比值进行比较。
8 神经组织免疫荧光染色 取活体成像系统检测完的神经组织,行冷冻切片,厚度为10 μm,Hoechst 33258标记细胞核,荧光显微镜下观察RFP-BMSCs在神经组织中的分布。
9 统计学方法 数据采用SPSS13.0统计分析软件处理,以表示,组间比较采用方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
结 果
1 RFP-BMSCs体外培养普通光镜及荧光显微镜观察 SD大鼠RFP-BMSCs在复苏12 h后开始贴壁生长,24 h后开始增殖,细胞的集落增多,呈现典型的间充质干细胞的“漩涡状”生长方式(图1A),4 ~ 5 d后可传代,荧光显微镜观察稳定表达红色荧光(图1B)。
2 RFP-BMSCs免疫荧光染色 对第4代RFP-BMSCs行免疫荧光染色,荧光显微镜下观察,细胞自身表达红色荧光(图2A),绿色荧光标记CXCR4膜蛋白(图2B),蓝色标记细胞核(图2C)。由此,CXCR4蛋白广泛表达于RFP-BMSCs中(图2D)。
3 Wallerian变性神经段大体观察 周围神经损伤后,其远端发生一系列代谢及结构变化,称为Wallerian变性,变性的神经较健侧粗大。见图3。
4 RFP-BMSCs向损伤的神经段归巢的荧光成像在1 d、3 d、7 d、14 d、1个月、2个月不同时间点,A组(RFP-BMSCs+0.9%氯化钠注射液)和B组(RFP-BMSCs+AMD3100)术侧荧光强度均强于对侧;另外,在每个时间点,A组(RFP-BMSCs+0.9%氯化钠注射液)的术侧荧光强度均强于B组(RFPBMSCs+AMD3100)术侧。见图4。
5 损伤侧与健侧的神经荧光成像平均光子密度比值比较 不同时间点的RFP-BMSCs+0.9%氯化钠注射液组的光子强度比值具有先增高后降低的趋势,并且在7 d的时间点达到顶峰;1 d与3 d、7 d比较、7 d与14 d比较,RFP-BMSCs组的光子强度比值差异均有统计学意义(P<0.05),见表1、图5。在1 d和3 d两个时间点,RFP-BMSCs组的平均光子强度比值高于RFP-BMSCs+AMD3100组,差异有统计学意义(P<0.05),见表1、图6。
6 神经组织免疫荧光染色 荧光显微镜下观察,RFP-BMSCs在某些趋化因子的作用下迁徙到了损伤的神经组织内。另外,该病理结果也提示我们活体成像系统是一种可信赖的用于观察干细胞归巢现象的方法。见图7。
讨 论
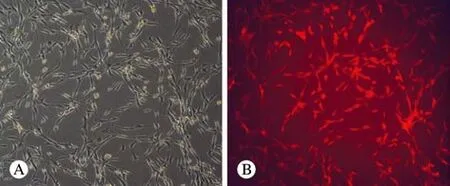
图 1 复苏增殖的第4代RFP-BMSCs A: 倒置相差显微镜观察(×100); B: 荧光显微镜观察(×100)Fig. 1 The fourth generation of BMSCs under inverted phase contrast microscope (A, ×100) and fl uorescence microscope(B, ×100)
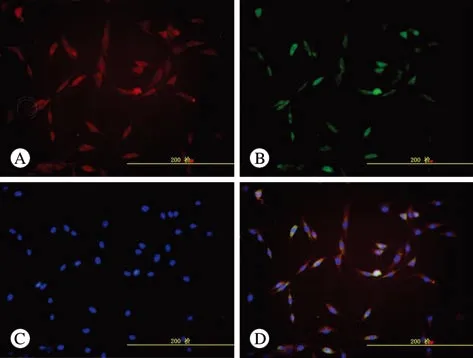
图 2 荧光显微镜观察第4代RFP-BMSCs的CXCR4表达A: 红色荧光显示RFP表达阳性细胞; B: 绿色荧光显示CXCR4表达阳性细胞; C: 蓝色荧光显示Hoechst 33258标记的细胞核; D: A、 B和C图叠加Fig. 2 Red fl uorescence microscopy (A) showing CXCR4 expression in BMSCs, green fluorescence microscopy (B) showing CXCR4 expression in positive cells, blue fluorescence microscopy (C) showing Hoechst 33258 stained nuclei, and merged A, B and C (D)
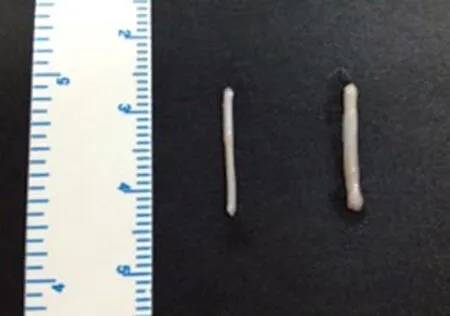
图 3 Wallerian变性神经(右)与正常侧神经(左)对比Fig. 3 Nerves with Wallerianian degeneration(right) and normal nerves(left)
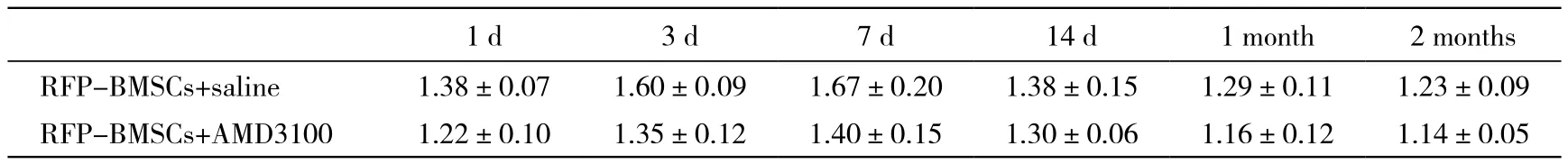
表1 平均光子强度Tab. 1 Average photon intensity in injured and normal nerves
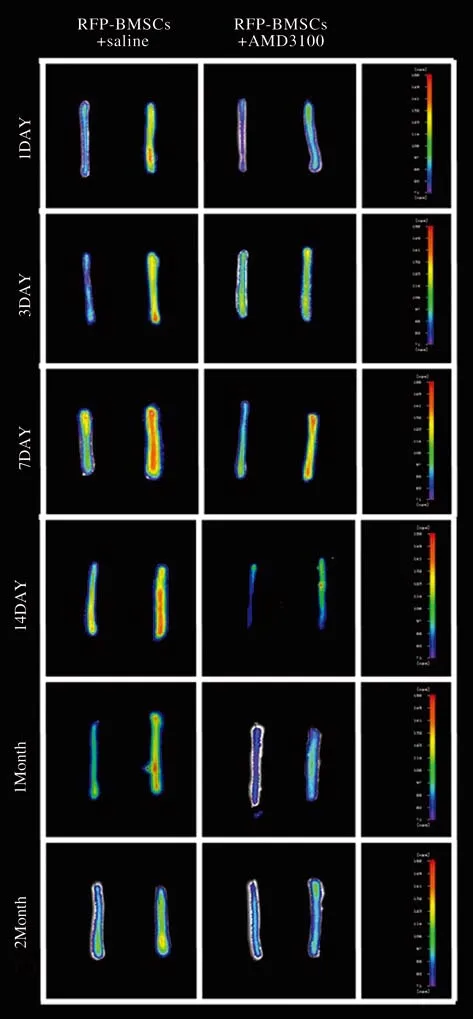
图 4 1 d、 3 d、 7 d、 14 d、 1个月、 2个月的RFP-BMSCs归巢后坐骨神经荧光成像图,左侧为正常对照侧坐骨神经,右侧为切断后坐骨神经Fig. 4 Fluorescence imaging of normal sciatic nerve (left) and removed sciatic nerve (right) 1, 3, 7, 14 days, 1 and 2 months after homing of BMSCs
周围神经损伤后,与近端失去联系的远端神经发生Wallerian变性,髓鞘崩解,雪旺细胞增殖,并与巨噬细胞共同参与坏死髓鞘碎屑的清除,另外,发生Wallerian变性的神经组织还释放一系列化学物质,如SDF-1、Fractalkine,动员外周血中和外源性骨髓间充质干细胞向损伤部位迁移和聚集。作为一种理想且成熟的种子细胞,骨髓间充质干细胞不仅能够促进轴突生长,还能够分泌神经营养物质支持轴突的延长[1-2]。据相关文献报道,在心肌梗死、脑挫裂伤、脊髓损伤等模型中,通过静脉移植或损伤组织周围局部移植的间充质干细胞均能够迁移并聚集在损伤组织内,参与损伤组织器官修复过程[3-6]。
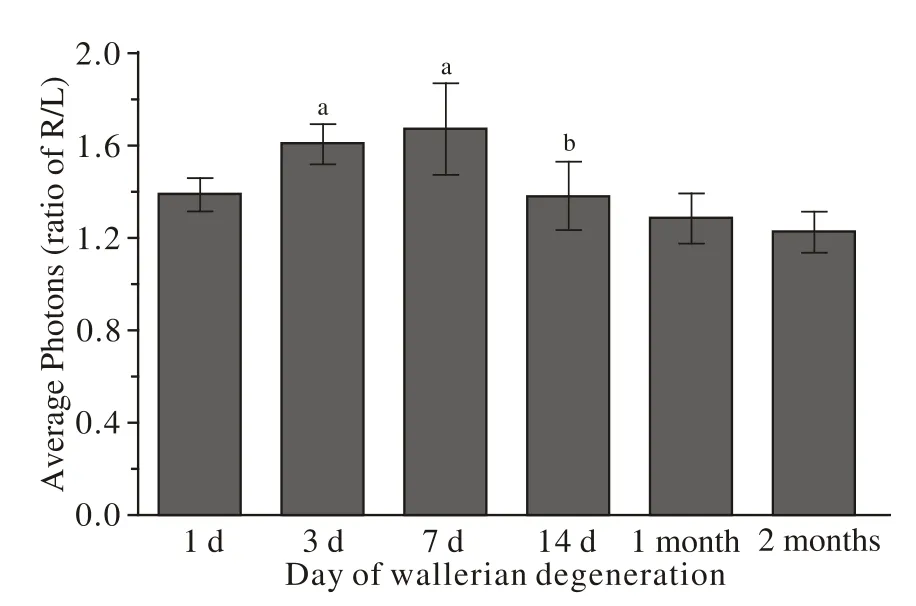
图 5 不同时间点A组(RFP-BMSCs+0.9%氯化钠注射液)的光子强度比值(aP<0.05, vs 1 d, bP<0.01, vs 7 d)Fig. 5 Photon intensity ratio in group A at different time points(aP<0.05, vs 1 d, bP<0.01, vs 7 d)
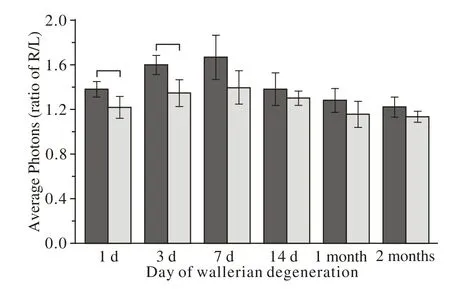
图 6 1 d和3 d, RFP-BMSCs+0.9%氯化钠注射液组的平均光子强度比值高于RFP-BMSCs+AMD3100组(P<0.05)Fig. 6 The average phonton intensity ratio is higher in group A than in group B (P<0.05)
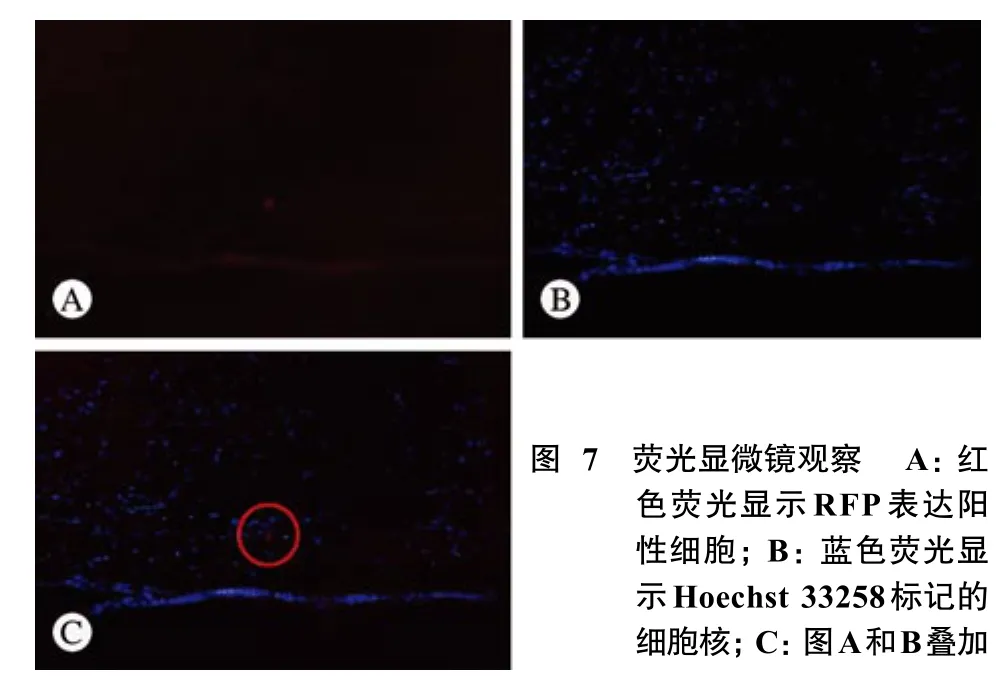
Fig. 7 Red fl uorescence microscopy showing RFP positive cells (A),and blue fluorescence microscopy showing Hoechst 33258 stained nuclei(B) and merged A and B (C)
本实验中,我们采用表达红色荧光蛋白的RFP-BMSCs作为种子细胞,在SD大鼠周围神经损伤模型建立后的6个不同时间点,尾静脉注射移植骨髓间充质干细胞,然后采用小动物活体成像系统观察RFP-BMSCs在损伤的周围神经段中的聚集情况。实验结果显示,周围神经损伤后,6个不同时间点通过血管途径移植的RFP-BMSCs均成功迁移到了损伤部位,且RFP-BMSCs在损伤段中的聚集呈现先增高后降低的现象,在神经损伤后的第7天达到峰值。所以,实验提示我们在通过静脉移植干细胞治疗周围神经损伤时,可能存在最佳的治疗时间点。
Ji等[11]发现大鼠间充质干细胞可以表达CXCR4(SDF-1的特异性受体)、CX3CR1(Fractalkine特异性受体)、CCR2、CCR5四种受体,且证实了脑室内局部注射SDF-1可以诱导干细胞向损伤的舌下神经节内迁移。间充质干细胞向损伤的周围神经迁移和聚集,其本质是一种趋化现象,可能通过SDF-1-CXCR4、Fractalkine-CX3CR1等细胞信号传导通路实现。作为细胞表面蛋白CXCR4的特异性阻断剂AMD3100可以阻止SDF-1与CXCR4的结合,从而在周围神经损伤中抑制间充质干细胞向损伤部位迁徙[8-9]。本实验中A组作为实验组,尾静脉注射RFP-BMSCs和0.9%氯化钠注射液,B组作为条件对照组,尾静脉注射RFPBMSCs和AMD3100。实验结果提示,在坐骨神经损伤的早期(1 ~ 3 d),A组(RFP-BMSCs+0.9%氯化钠注射液)的平均光子强度比值高于B组(RFP-BMSCs+AMD3100),差异有统计学意义。在坐骨神经损伤的中晚期(3 d ~2个月),尽管注射了AMD3100,间充质干细胞也可以向损伤迁移。因此,我们认为,神经损伤后可能释放多种细胞因子,如SDF-1、Fractalkine等,诱导间充质干细胞的归巢,但是SDF-1可能只参与周围神经损伤后早期的干细胞归巢,至于中晚期干细胞归巢的实现,可能是由于其他细胞因子的参与。因此,对于陈旧性神经损伤的病例,我们可以尝试通过在损伤神经周围或神经内添加趋化因子(SDF-1、Fractalkine等)促进干细胞的归巢以提高神经修复效果。
综上所述,RFP-BMSCs在损伤的周围神经中存在归巢现象,并且在损伤后的不同时间呈现先增高后降低的归巢现象;RFP-BMSCs的归巢现象可能受到SDF-1-CXCR4轴的调控,可以被CXCR4特异性拮抗剂AMD3100所抑制。
1 Yang J, Wu H, Hu N, et al. Effects of bone marrow stromal cellconditioned medium on primary cultures of peripheral nerve tissues and cells[J]. Neurochem Res, 2009, 34(9): 1685-1694.
2 Wang J, Ding F, Gu Y, et al. Bone marrow mesenchymal stem cells promote cell proliferation and neurotrophic function of Schwann cells in vitro and in vivo[J]. Brain Res, 2009, 1262(1262): 7-15.
3 Chen J, Li Y, Wang L, et al. Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats[J]. J Neurol Sci, 2001, 189(1/2): 49-57.
4 Wang L, Li Y, Chen J, et al. Ischemic cerebral tissue and MCP-1 enhance rat bone marrow stromal cell migration in interface culture[J].Exp Hematol, 2002, 30(7): 831-836.
5 Yanqing Z, Yu-Min L, Jian Q, et al. Fibronectin and neuroprotective effect of granulocyte colony-stimulating factor in focal cerebral ischemia[J]. Brain Res, 2006, 1098(1): 161-169.
6 Wang Y, Deng Y, Zhou GQ. SDF-1alpha/CXCR4-mediated migration of systemically transplanted bone marrow stromal cells towards ischemic brain lesion in a rat model[J]. Brain Res, 2008,1195(1195): 104-112.
7 张西峰.Wallerian变性研究进展[J].国外医学:创伤与外科基本问题分册,1997,18(3):145-152.
8 Hu X, Dai S, Wu WJ, et al. Stromal cell derived factor-1 alpha confers protection against myocardial ischemia/reperfusion injury:role of the cardiac stromal cell derived factor-1 alpha CXCR4 axis[J].Circulation, 2007, 116(6): 654-663.
9 Huang C, Gu H, Zhang W, et al. SDF-1/CXCR4 mediates acute protection of cardiac function through myocardial STAT3 signaling following global ischemia/reperfusion injury[J]. Am J Physiol Heart Circ Physiol, 2011, 301(4): H1496-H1505.
10 Shichinohe H, Kuroda S, Lee JB, et al. In vivo tracking of bone marrow stromal cells transplanted into mice cerebral infarct by fluorescence optical imaging[J]. Brain Res Brain Res Protoc,2004, 13(3): 166-175.
11 Ji JF, He BP, Dheen ST, et al. Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury[J].Stem Cells, 2004, 22(3):415-427.
Chemotaxis of peripheral nerve Wallerianian degeneration at different time points on homing of stem cells
GAO Xu-peng, PENG Jiang, SUN Xun, GUO Zhi-yuan, WANG Yu, LU Shi-bi, ZHAO Qing Institute of Orthopedics, Chinese PLA General Hospital, Beijing 100853, China
Corresponding Author: PENG Jiang. Email: pengjiang301@126.com
ObjectiveTo observe the effect of peripheral nerve Wallerianian degeneration at different time points on homing of bone marrow mesenchymal stem cells (BMSCs).MethodsSeventy-two adult male SD rats weighing 220-250 g were randomly divided into 6 groups (n=12) according to their weight. Each group was divided into group A and group B according to the injected cells and drugs. Rats in group A (n=6) were injected with BMSCs and saline via their tail vein and those in group B (n=6) were injected with BMSCs and AMD3100. Their sciatic nerve was cut off along the inferior border of piriformis under aseptic condition with its proximal end ligated and distal end excluded. The rats in group A were injected with BMSCs and saline 1, 3, 7, 14 days, 1 and 2 months after sciatic nerve transaction and those in group B were injected with BMSCs and AMD3100. Three days after injection,the effect of peripheral nerve Wallerianian degeneration on homing of BMSCs was observed through the in vivo imaging system.Results The aggregation of BMSCs in sciatic nerve with Wallerianian degeneration increased at fi rst and then decreased with the prolonged time, and was weaker in group B than in group A during the early Wallerianian degeneration of sciatic nerve (1-3 d).Conclusion BMSCs can migrate into the peripheral nerve tissue with Wallerianian degeneration. Their homing increases at fi rst and then decreases with time, which is regulated by the SDF-1-CXCR4 axis and inhibited by the CXCR4 speci fi c antagonist AMD3100.
bone marrow mesenchymal stem cells; peripheral nerve injury; stem cells homing
R 319
A
2095-5227(2014)05-0458-05
10.3969/j.issn.2095-5227.2014.05.017
时间:2014-04-01 17:38
http://www.cnki.net/kcms/detail/11.3275.R.20140401.1738.002.html
2013-11-06
国家自然科学基金项目(31170946);国家“863”主题项目(2012AA020502);全军十二五重点项目(BWS11J025)
Supported by the National Natural Science Foundation of China(31170946);'863' Program of China(2012AA020502); Military Special-purpose Program of "Twelfth Five-Year"(BWS11J025)
高旭鹏,男,在读硕士,医师。研究方向:周围神经创伤与修复。Email: gysgxp@126.com
彭江,男,副主任医师,副教授。Email: pengjiang301@126.com

