紫杉醇对兔耳增生性瘢痕的作用
黄丽萍,王兴林,张 冷,毕 胜,林碧文解放军总医院,北京 00853;大连市中医医院,辽宁大连 603
紫杉醇对兔耳增生性瘢痕的作用
黄丽萍1,王兴林1,张 冷2,毕 胜1,林碧文1
1解放军总医院,北京 100853;2大连市中医医院,辽宁大连 116032
目的观察药物紫杉醇对兔耳增生性瘢痕的作用。方法 在兔耳腹侧面建立增生性瘢痕模型,将紫杉醇药品配制成浓度为12 mg/L、24 mg/L、48 mg/L、96 mg/L;18 mg/L、54 mg/L、162 mg/L、486 mg/L;30 mg/L、150 mg/L、750 mg/L、3 750 mg/L的药液,观察不同浓度的药物对兔耳增生性瘢痕的作用,寻找疗效最佳的药物浓度。结果在48 ~ 162 mg/L浓度范围内,兔耳瘢痕增生指数随药物浓度的增加而减少。结论紫衫醇对兔耳增生性瘢痕的成纤维细胞增殖、胶原沉积、微血管增生均有抑制作用。
增生性瘢痕;紫杉醇;模型,动物
病理性瘢痕的形成,与伤口愈合过程中皮肤成纤维细胞大量增殖与凋亡障碍、细胞外基质合成与降解失衡、细胞因子调节机制紊乱、组织微血管过度增生等因素密切相关[1-2]。紫杉醇是从红豆杉属植物中提取的一种具有抗癌、抗微管增生作用的药物,有研究表明紫杉醇可以抑制成纤维细胞的增殖以及血管的形成[3]。我们将不同浓度的紫杉醇药液以瘢痕内注射的形式作用于兔耳瘢痕模型上,观察紫杉醇对瘢痕组织的作用,验证药物疗效、摸索药物应用的最佳浓度范围。
材料和方法
1 材料 紫杉醇注射液(生产厂家:Corden Pharma Latina S.P.A;规格:5 ml:30 mg;进口药品注册证号H20110470),苏木素-伊红、天狼猩红染液、酸性品红液、苯胺蓝液。日本大耳白兔18只,兔耳健全,体质量2.0 ~ 2.5 kg。
2 增生性瘢痕动物模型的建立 将动物麻醉后,兔耳腹侧面去毛,消毒铺洞巾,避开血管,于每只兔耳腹侧面中线两侧分别做4个1.5 cm×1.5 cm方形全层皮肤缺损创面,用手术刀刮除软骨膜、保留软骨,36只兔耳共144个创面,制成后创面包扎,术后第2天摘除敷料,暴露创面,待其自然愈合。见图1。
3 药物配制 紫杉醇注射液(浓度为6 000 mg/L),以注射用水稀释,以6 mg/L为基础浓度,按2倍、3倍和5倍浓度梯度递增,分别配制成浓度为12 mg/L、24 mg/L、48 mg/L、96 mg/L;18 mg/L、54 mg/L、162 mg/L、486 mg/L;30 mg/L、150 mg/L、750 mg/L、3 750 mg/L的药液。
4 药物注射与取材 每只兔子两耳共8个瘢痕组织块,于造模术后28 d兔耳瘢痕生长最高峰时,取1个组织块作为空白对照,仅注射注射用水,1个注射基础浓度6 mg/L的药液,其余6个瘢痕组织块按浓度梯度递增,分别被注射6个不同浓度的药液。给药方法:以1 ml注射器从兔耳瘢痕边缘基底部选取3 ~ 5个进针点,以瘢痕灶中心为进针方向,在针体行进过程中逐步推针管给药,注射完毕后局部压迫1 ~ 2 min以防药液从针孔渗漏。每个瘢痕块注射药液总量为0.8 ml。用药后10 d取材,中性甲醛固定48 h,石蜡包埋。
5 测定瘢痕增生指数(hypertrophic index,HI) HE染色切片低倍镜下用显微测量尺测量,按公式:HI=A/B计算瘢痕增生指数[4]。见图2。
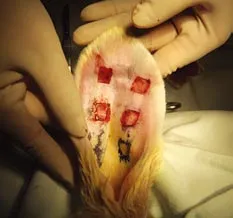
图 1 兔耳瘢痕造模手术示意图Fig. 1 Rabbit ear scar operation model
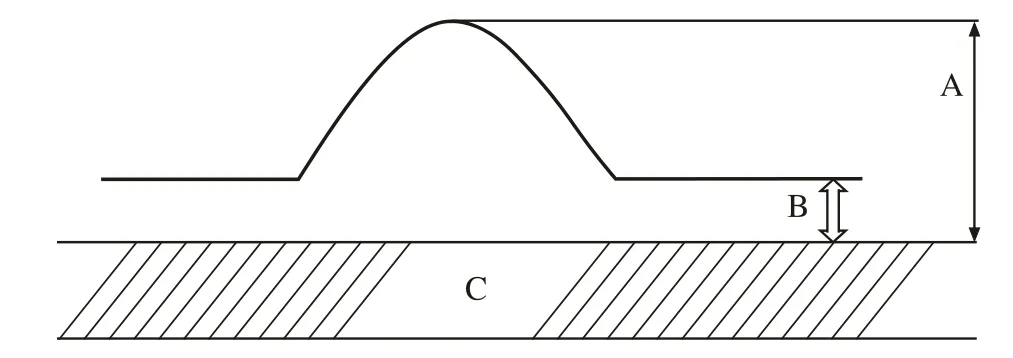
图 2 瘢痕增生指数(HI)计算示意图: 瘢痕最高点至软骨表面的垂直厚度(A),正常皮肤至软骨表面的垂直厚度(B),兔耳软骨(C),HI=A/BFig. 2 Calculation of hyperplastic scar index A: The vertical thickness from the top of scar to the cartilage surface; B: The vertical thickness from the normal skin to cartilage surface;C: The rabbit ear cartilage
6 成纤维细胞密度 HE染色切片,400倍光镜下用Lumenera Infinity2-1 CDD相机动态观察并进行矩形视野选择,在瘢痕厚度最大区域内,于浅部、深部各选择3个不重叠视野;在瘢痕两侧边缘各选2个不重叠视野,共10个视野。每个视野按相同的平行网格进行区域划分,分别统计各网格内的成纤维细胞数求和即为该矩形视野的总成纤维细胞数。10个矩形视野分别计数,结果取均数即为该张切片的成纤维细胞密度。
7 胶原纤维面密度 天狼猩红染色切片,400倍光镜下在瘢痕浅部和深部、两侧边缘部各随机选取10个视野,应用计算机辅助病理图像分析系统计算红染胶原面的密度,结果取均数[5-6]。
8 微血管密度 HE染色切片切片,400倍光镜下选择血管密集的区域,计数5个视野内的微血管(管腔>8个红细胞直径的微血管则不计数),取其平均数即为微血管增生密度。
9 统计学分析 用EXCEL建立数据库,SPSS16.0统计软件分析,数据结果以表示。采用单因素方差分析进行差异显著性检验,P<0.05为差异有统计学意义。
结 果
1 HE染色 空白对照组:可见瘢痕组织中成纤维细胞数量较多,细胞体积较大,微血管较丰富,可见炎细胞浸润。瘢痕组织浅层胶原纤维致密,排列紊乱,多为Ⅰ型胶原纤维。深层胶原纤维呈线条状排列,无规律,胶原纤维较浅层长(图3A);紫杉醇治疗组(浓度162 mg/L):成纤维细胞数量较治疗前减少,胶原疏松呈线条状排列,微血管较用药前稀疏(图3B)。
2 天狼猩红染色 空白对照组:瘢痕组织内胶原纤维呈不规则的纤维网状条索,分布密集,纤维较粗大(图4A);紫杉醇治疗组:瘢痕组织内胶原纤维排列较规则,较空白对照组稀疏,纤维较纤细 (图 4B)。
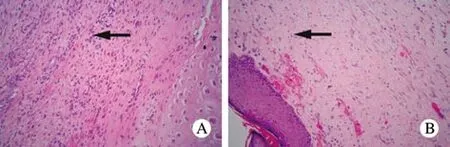
图 3 HE染色下空白对照组(A)与治疗组(B)的瘢痕组织成纤维细胞、胶原及血管(×200)Fig. 3 HE staining (×200) showing fi broblasts, collagen and blood vessels in scar tissue of control group (A) and treatment group (B)
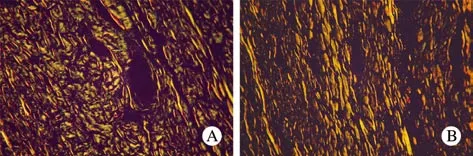
图 4 天狼猩红染色下空白对照组(A)与治疗组(B)的瘢痕组织胶原示意图(×400)Fig. 4 Sirius red staining (×400) showing collagen in scar tissue of control group (A) and treatment group (B)
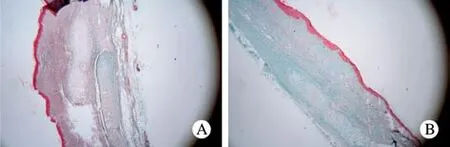
图 5 三色染色下空白对照组(A)与治疗组(B)的瘢痕组织大体观察及血管、胶原情况(×40)Fig. 5 Masson trichrome staining (×40) showing blood vessels and collagen in scar tissue of control group (A) and treatment group (B)

表1 不同浓度的紫杉醇药液对兔耳瘢痕增生指数、成纤维细胞、胶原、微血管密度的影响Tab. 1 Effect of paclitaxel at different concentrations on hyperplastic scars, fi broblasts, collagen and micro-vessels of rabbit ear scar
3 三色染色 空白对照组:瘢痕较厚,血管丰富,胶原密集(图5A);紫杉醇治疗组:瘢痕较平坦,血管减少,胶原密度较对照组低(图5B)。
4 不同浓度紫杉醇药液的作用效果 当紫杉醇药液浓度>400 mg/L时,兔耳瘢痕组织会出现局部坏死;与空白组比较,药液浓度为96 mg/L、150 mg/L、162 mg/L时疗效显著。见表1。
讨 论
病理性瘢痕的形成是十分复杂的生物学过程,从组织形态上是以成纤维细胞为主的过度增殖,细胞外基质中胶原过量沉积、排列紊乱,且难以被机体吸收或重塑的病理状态[7-9]。瘢痕的实验研究一般包括离体细胞培养、动物造模和临床实验观察3种形式[10]。在体外细胞模型中,多为将病理性瘢痕组织中的成纤维细胞体培养、人工传代后,将各类干预手段作用于细胞[7]。它的局限性在于人工细胞培养的外环境与人体复杂的内环境有较大差异,作用条件单一,在体外细胞模型上得出的实验结果往往有偏移。将各种治疗手段直接作用于病理性瘢痕的病变局部,虽然可以得出较可靠、直接的实验结果,但实验的受限条件较多且取材不便。因而许多学者选择在动物模型上进行治疗病理性瘢痕的新疗法或药物的研究。目前较公认的动物模型有裸鼠模型和兔耳瘢痕模型[11-14]。裸鼠模型是将人类瘢痕的组织移植于裸鼠皮肤上进行生长,但由于物种差异较大,移植后因免疫排斥反应等因素,移植的人类瘢痕组织会发生萎缩,影响了实验结果的可靠性。兔耳瘢痕模型是在瘢痕研究中被较多应用的另一类动物模型,兔耳腹侧面缺乏肉膜结构,创面的修复、愈合过程及瘢痕形成后的组织病理学特点与人类瘢痕的形成有许多相似处。因此,在本研究中我们采用了兔耳瘢痕模型作为研究对象,在成功生长于兔耳腹侧面的瘢痕组织上以局部注射的方式给药,并观察不同药物浓度对兔耳瘢痕组织的作用,摸索药物作用的最佳浓度范围。紫杉醇是已被临床广泛应用的抗肿瘤药物,它通过进入靶细胞与细胞内微管结合,促进微管聚集、阻碍微管正常的生理性解聚,从而使细胞增殖受阻,并诱导细胞凋亡,紫杉醇对胶原合成及成纤维细胞的过度增生均有抑制作用,此外紫杉醇还具有抗微血管增生的作用[15-16]。我们观察到,在48 ~ 162 mg/L浓度范围内,兔耳瘢痕增生指数随药物浓度的增加而减少。在病理观察中我们发现,用药后的兔耳瘢痕组织中,无明显的炎症细胞浸润,成纤维细胞密度降低,部分细胞胞核淡染,呈现凋亡现象;而对照组兔耳瘢痕组织中,炎症细胞浸润明显,成纤维细胞密度较用药组显著增高,真皮层中可见大量排列无序、细胞核呈深染状态的成纤维细胞。进一步验证了紫杉醇可直接抑制成纤维细胞生长增殖这一结论[17]。在病理性瘢痕的形成中,胶原纤维是组织构成的结构性支架,具有极其重要的作用[18]。在本实验中我们观察到,空白对照组的瘢痕组织中,胶原纤维粗大,排列紊乱、屈曲扭结、呈环状改变;而用药后的瘢痕组织中,胶原纤维纤细、排列规则有序,密度较空白对照组显著降低。瘢痕组织的生长需要血管的增殖和架构,紫杉醇因具有抗微血管增生的作用,故可抑制病理性瘢痕组织的形成,经药物处理后的瘢痕组织血管密度较空白组明显减小,组织体积较对照组明显萎缩。在大体目测观察中我们还发现,在48 ~ 162 mg/L这一浓度范围内,以注射方式给药的紫衫醇药液不但可抑制兔耳瘢痕的增生,而且对瘢痕表皮的破坏较小,无组织溃烂、坏死,作用温和,是较理想的抗瘢痕药物[19]。
1 李红,张静,刘宾娜.病理性瘢痕的成因及临床治疗方法[J].中国医药导刊,2010,12(2):327-328.
2 丁丹霞,马刚,陈婷.TGF-β1和MMP-2在病理性瘢痕表皮中的表达和意义[J].皮肤性病诊疗学杂志,2013,20(1):22-25.
3 Choritz L, Grub J, Wegner M, et al. Paclitaxel inhibits growth,migration and collagen production of human Tenon’s fibroblasts--potential use in drug-eluting glaucoma drainage devices[J].Graefes Arch Clin Exp Ophthalmol, 2010, 248(2): 197-206.
4 Morris DE, Wu L, Zhao LL, et al. Acute and chronic animal models for excessive dermal scarring : quantitative studies[J]. Plast Reconstr Surg, 1997, 100(3): 674-681.
5 张维娜,毛凯平,崔童星,等.小分子蛋白多糖decorin对兔耳增生性瘢痕的抑制作用[J].中华实验外科杂志,2011,28(5):691-693.
6 汤苏阳,杨 力,卢丙仑,等.苦参碱对兔耳增生性瘢痕治疗作用的组织形态学研究[J].中国美容医学,2002,11(4):311-313.
7 刘杜鹃,张可佳,丁玉红,等.病理性瘢痕综合治疗的研究进展[J].中国老年学杂志,2013,33(7):1731-1733.
8 李荟元,鲁开化,郭树忠,等.新编瘢痕学[M].西安:第四军医大学出版社,2003.
9 Baisch A, Riedel F. Hyperplastic scars and keloids: part II:Surgical and non-surgical treatment modalities[J]. HNO, 2006,54(12): 981-992.
10 张奇,刘达恩.病理性瘢痕基础研究进展[J].医学综述,2010,16(4):490-493.
11 Wang J, Ding J, Jiao H, et al. Human hypertrophic scar-like nude mouse model: characterization of the molecular and cellular biology of the scar process[J]. Wound Repair Regen, 2011, 19(2):274-285.
12 Wu JG, Wei YJ, Ran X, et al. Inhibitory effects of essential oil from rhizomes of Ligusticum chuanxiong on hypertrophic scarring in the rabbit ear model[J]. Pharm Biol, 2011, 49(7): 764-769.
13 Yagmur C, Guneren E, Kefeli M, et al. The effect of surgical denervation on prevention of excessive dermal scarring: a study on rabbit ear hypertrophic scar model[J]. J Plast Reconstr Aesthet Surg, 2011, 64(10): 1359-1365.
14 Kimura T. Hairless descendants of Mexican hairless dogs: an experimental model for studying hypertrophic scars[J]. J Cutan Med Surg, 2011, 15(6): 329-339.
15 程占刚, 张富, 刘宏伟. 气管切口术后药物预防切口粘连[J].中国美容医学, 2012, 21(12): 503.
16 梁恭博,郝壮,袁野,等.紫杉醇联合铂系配合物抗肿瘤作用的研究进展[J].国际检验医学杂志,2013,34(2):184-186.
17 王荔,孙红,杨翎,等.紫杉醇对TGF-β_1促人Tenon’s囊成纤维细胞增殖的影响[J].南京医科大学学报:自然科学版,2011,31(6):794-798.
18 Robson MC, Barnett RA, Leitch IO, et al. Prevention and treatment of postburn scars and contracture[J]. World J Surg, 1993, 16(1):87-96.
19 黄丽萍. 病理性瘢痕的射频消融治疗及基于基因表达谱的药物筛选实验研究[D]. 北京:解放军医学院,2012.
Role of paclitaxel in treatment of hyperplastic scars on rabbit ears
HUANG Li-ping1, WANG Xing-lin1, ZHANG Leng2, BI Sheng1, LIN Bi-wen1
1Chinese PLA General Hospital, Beijing 100853, China;2Dalian Hospital of Traditional Chinese Medicine, Dalian 116032, Liaoning Province, China
Corresponding author: WANG Xing-lin. Email: Wangxingl301@126.com
ObjectiveTo observe the role of paclitaxel in treatment of hyperplastic scars on rabbit ears.MethodsA rabbit ear hyperplastic scar model was established. The role of paclitaxel in treatment of hyperplastic scars on rabbit ears was observed at the concentrations of 12 mg/L, 24 mg/L, 48 mg/L, 96 mg/L, 18 mg/L, 54 mg/L, 162 mg/L, 486 mg/L, 30 mg/L, 150 mg/L, 750 mg/L, and 3 750 mg/L, respectively. Results Paclitaxel at the concentration of 48-162 mg/L reduced the number of hyperplastic scars on rabbit ears.ConclusionPaclitaxel can inhibit the proliferation of fi broblasts, deposition of collagen, and micro-angiogenesis in hyperplastic scars on rabbit ears.
hyperplastic scar; paclitaxel; models, animal
R363
A
2095-5227(2014)05-0485-04
10.3969/j.issn.2095-5227.2014.05.024
2013-09-25
解放军总医院临床科研扶持基金(2013FC-TSYS-1027)
黄丽萍,女,博士,主治医师。研究方向:瘢痕康复、体表射频消融。Email: ping-online@163.com
王兴林,男,硕士,教授,主任医师。Email: Wangxingl301@126.com

