金黄色葡萄球菌GapC蛋白与鼠伤寒沙门氏菌Flic融合蛋白的构建与免疫原性研究
赵 达,王 鹤,梁宏儒,胡 旭,姜东君,尹 辉,高佳滨,陈为宏,乔 波,朱战波
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是一种革兰氏阳性球菌,广泛分布于自然界中,在人和畜禽的皮肤、黏膜、肠道、呼吸道及乳腺中也有寄生,常引起化脓性疾病和毒素性疾病,是一种重要的人畜共患致病菌[1]。在感染性疾病中,S.aureus仅次于大肠杆菌,位居第二。随着S.aureus耐药菌株的出现,如耐甲氧西林金黄色葡萄球菌(MRSA),新型高效S.aureus疫苗的研发迫在眉睫。
GapC蛋白一种具有甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)活性的蛋白,研究表明人源和牛源S.aureus分离株表面均存在高度保守的GapC蛋白,并且具有高度的同源性[2-3]。本实验室前期研究结果证明S.aureus的GapC蛋白具有较好的保护力[4]。细菌的鞭毛蛋白是Toll样受体5(Toll-like receptor 5,TLR5)的配体,通过TLR5能够激发机体的天然免疫应答,从而发挥免疫佐剂作用[5-6]。Nguyen CT等[7]将鞭毛蛋白与肺炎链球菌的保护性蛋白PspA融合表达,诱导了高水平的抗PspA特异性抗体,并且该融合蛋白能够有效保护小鼠免遭肺炎链球菌的攻击。国内王鹤[8]、潘志明[9]的研究也证明了鼠伤寒沙门氏菌(Salmonellatyphimurium,S.typhimurium)鞭毛蛋白的佐剂作用。
因此,本研究以鞭毛蛋白为佐剂,融合表达S.typhimurium鞭毛蛋白与S.aureusGapC蛋白,研究该融合蛋白的细胞、体液免疫反应及免疫保护性,为S.aureus疫苗的研制提供一定科学参考。
1 材料与方法
1.1菌株和实验动物S.aureus标准株Wood46株由黑龙江八一农垦大学预防兽医学实验室保存;6~8 w龄昆明系清洁级雌性小鼠,购于中国农业科学院哈尔滨兽医研究所。
1.2质粒和试剂 质粒pQE30-Flic、pQE30-GapC和pQE30-Flic-GapC均由本实验构建;辣根酶标记山羊抗小鼠IgG(H+L)购自北京中杉金桥生物技术有限公司;DMSO购自Amresco公司;弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、TMB、刀豆蛋白A(ConA)购自SIGMA 公司;酶标板为Corning公司产品。
1.3试剂盒 Quick SpotTM小鼠IFN-γ、小鼠IL-4 ELISPOT预包被试剂盒为达科为生物技术有限公司产品;WST-1细胞增殖及毒性检测试剂盒购自碧云天生物技术研究所。
1.4重组蛋白的制备 诱导表达FliC、GapC、FliC-GapC重组蛋白,采用镍柱亲和层析的方法对重组蛋白进行纯化,在4 ℃条件下将所得纯化蛋白用PBS透析24 h以上,期间更换3~5次透析液。然后利用内毒素除去柱Detoxi-GelTM去内毒素。
1.5动物免疫 6~8周龄雌性昆明小鼠随机分为5组,每组20只,分别为GapC蛋白弗氏佐剂组(GapC蛋白+弗氏佐剂)、Flic-GapC蛋白组、GapC蛋白组、Flic蛋白组及PBS对照组。免疫剂量为100 μg/只,采用背部皮下注射免疫方式,间隔3 w免疫一次,一共免疫2次。
1.6小鼠血清中IgG抗体的检测 在免疫前进行一次割尾采血,分离血清,用作阴性对照血清;一免后每周采血一次,每组采5只,分离血清。方阵滴定法确定最佳抗原包被浓度,间接ELISA测定小鼠血清抗体效价。具体步骤如下:用0.05 moL/L pH 9.6碳酸盐包被缓冲液将GapC蛋白稀释至适宜浓度,100 μL/孔,4 ℃包被过夜;用PBST洗涤3次后加入200 μL含5%脱脂乳的PBST溶液封闭,37 ℃ 2 h;PBST洗涤3次,将待检血清样品分别进行倍比稀释,同时设立阴性对照和空白对照,100 μL/孔,37 ℃ 1 h;PBST洗涤后,加入1∶5 000稀释的HRP标记的羊抗鼠IgG,100 μL/孔;洗涤后加入新鲜配制的TMB显色液,100 μL/孔,室温避光作用15~20 min;50 μL 2 moL/L 浓硫酸终止显色;酶标仪检测OD450的值。样品OD 值≥阴性血清样品的OD 值+3s(s为标准方差) 时对应的血清稀释度为该样品的效价。
1.7淋巴细胞增殖反应试验
1.7.1小鼠脾脏淋巴细胞的分离和计数 取二免后14 d小鼠,每组3只,颈椎脱臼处死,75%的乙醇中浸泡2~3 min;无菌取出脾脏,加4~5 mL EZ-SepTMMouse 1×淋巴细胞分离液,用两个载玻片轻轻研磨;将细胞悬液转移至10 mL离心管中,加入1 mL无血清 RPMI 1640培养基;1 500 r/min水平离心10 min,轻轻吸出中间的淋巴细胞层,转移至另一10 mL离心管中,加入4 mL含5%犊牛血清的RPMI 1640培养基,颠倒混匀,1 500 r/min离心10 min,弃去上清,收集细胞;加入1 mL 10%犊牛血清的RPMI 1640培养基,重悬细胞,用0.4%台盼蓝进行计数;调整淋巴细胞浓度为2×106个/mL。
1.7.2T淋巴细胞增殖反应试验 于96孔细胞培养板加入淋巴细胞悬液,每孔50 μL。每个样品均设非特异性刺激(ConA)、特异性刺激(S.aureusGapC蛋白)和不加刺激物(RPMI-1640)孔,设3个重复孔。分别加入50 μL ConA(孔内终浓度为5 μg/mL)、S.aureusGapC蛋白(孔内终浓度为10 μg/mL)和RPMI-1640。同时在96孔细胞培养板上设置大于3孔的空白对照(只加100 μL 10 %血 清的R P M I 1640)。37 ℃ CO2培养箱孵育48 h,每孔加入10 μL WST-1,继续孵育4 h。取出培养板以空白对照孔调零,测量OD450的值,结果以3个孔的平均值表示。
计算刺激指数(stimulation index,SI):
SI=(刺激孔OD-空白孔OD)/(未刺激孔OD-空白孔OD)。
1.8IFN-γ和IL-4的检测 采用Elispot方法检测二免后14 d小鼠脾脏IFN-γ和IL-4特异性分泌细胞,以S.aureusGapC蛋白为刺激原(10 μg/mL),整个实验设置一组正对照(PHA),每一个细胞样品再设一个负对照(不加刺激物),整块板设一个背景负对照(不含细胞,只加培养基和所有的检测试剂),试验中每个处理均设3个重复孔。具体操作步骤参考达科为Mouse INF-γ /IL-4 Precoated ELISPOT Kit试剂盒说明书。
1.9攻毒试验 在二免后21 d,对免疫组及对照组小鼠腹腔注射攻毒,每组10只,攻毒剂量为1 MLD(2×109CFU)。攻毒后在一周内每日观察小鼠死亡情况,分析各免疫组重组蛋白的保护率。
2 结 果
2.1重组蛋白的纯化结果 由于重组蛋白含有His-tag标签,所以采用镍柱亲和层析的方法进行纯化。纯化后的重组蛋白进行12% SDS-PAGE 分析,得到了比较纯净的蛋白,结果见图1。
2.2血清中GapC蛋白特异的IgG抗体检测结果 用ELISA 方法对各组小鼠血清中GapC蛋白特异的IgG抗体水平进行了检测。结果表明GapC蛋白弗氏佐剂组、Flic-GapC蛋白组在二次免疫2周后,抗体效价分别可达1∶128 000和1∶64 000。
分别对实验组和对照组的小鼠血清按1∶200稀释,进行间接ELISA试验,检测IgG抗体消长水平。试验结果表明,各免疫组从首次免疫后第3 w开始IgG抗体滴度均有不同程度的提高,且在二次免疫后两周抗体水平达至最高,然后缓慢下降,对照组无明显变化,如图2所示。

图1纯化后的重组蛋白SDS-PAGE电泳结果
M:蛋白质 Marker;1:纯化后的GapC蛋白;2:纯化后的Flic蛋白;3:纯化后的Flic-GapC蛋白.
Fig.1SDS-PAGEofpurifiedrecombinantprotein
M: Protein marker; 1: Purified GapC protein;
2: Purified Flic protein; 3: Purified Flic-GapC protein.
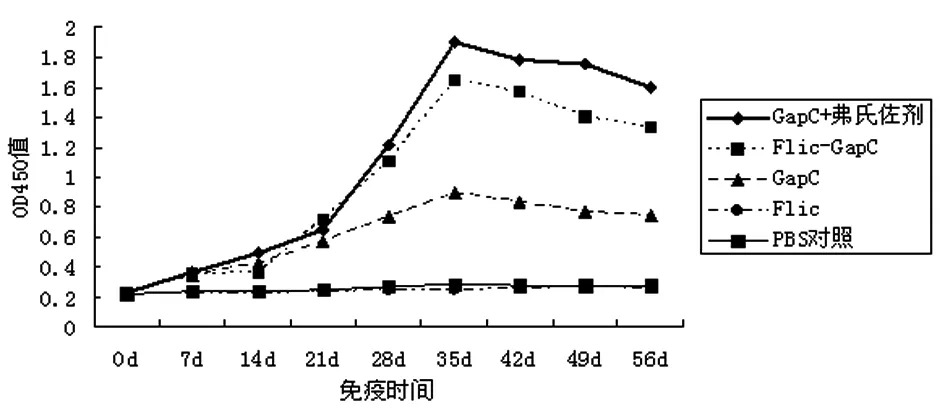
图2 小鼠免疫血清中抗GapC IgG抗体消长曲线
Fig.2Dynamiccurvesofanti-GapCIgGofimmunizedmouse
2.3T淋巴细胞增殖试验结果 以GapC蛋白和ConA为刺激原,检测小鼠二免后14 d淋巴细胞特异性增值情况,结果以刺激指数(SI)来表示,如表1和图3。其中GapC蛋白弗氏佐剂组、Flic-GapC蛋白组直接刺激指数差异无统计学意义(P>0.05),但高于对照组。说明鞭毛蛋白具有刺激T淋巴细胞增殖的能力,但不如弗氏佐剂。

表1 免疫组及对照组鼠淋巴细胞细胞刺激指数(SI)
2.4IFN-γ和IL-4的检测结果 分离二免疫后14 d小鼠的脾淋巴细胞,并制成淋巴细胞悬液。利用Elispot方法测定免疫小鼠脾脏淋巴细胞分泌IFN-γ和IL-4的能力,免疫各组斑点数如图2-4所示。结果表明,Flic-GapC融合蛋白能诱导小鼠脾淋巴细胞分泌IL-4和IFN-γ,但诱导IL-4的能力相对较弱,但与对照组相比差异有统计学意义(P<0.05)。
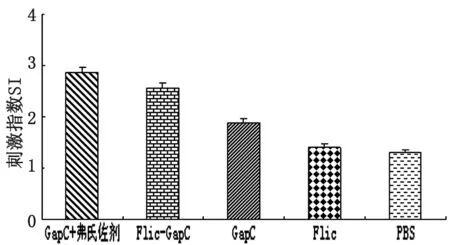
图3免疫组及对照组鼠淋巴细胞细胞刺激指数(SI)
Fig.3Lymphocytescellsstimulateindex(SI)ofvaccineimmunizedandcontrolgroups
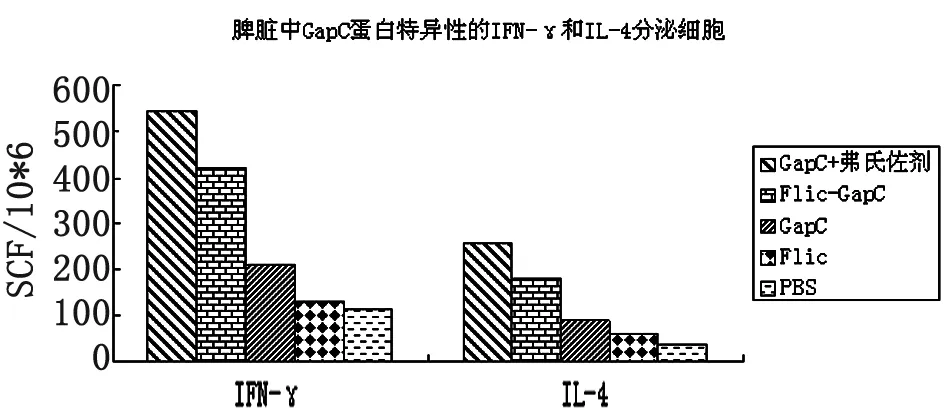
图4免疫组及对照组鼠淋巴细胞细胞因子含量对比(SFC)
Fig.4Concentrationsofcytokinessecretedfromlymphocytesofvaccineimmunizedandcontrolmouse(SFC)
2.5攻毒保护试验结果 各蛋白免疫组及对照组实验动物在二免后21 d,用S.aureusWood46株攻毒。攻毒后连续一周记录实验动物的死亡状况,并从死亡小鼠内脏中分离到相应致病菌。结果表明,GapC蛋白弗氏佐剂组、FliC-GapC蛋白组攻毒试验结果保护率分别为80%和70%,单独的GapC蛋白组保护率仅为20%,FliC蛋白组以及PBS对照组保护率为0%。
3 讨 论
研究表明,细菌的鞭毛蛋白可以被细胞的Toll样受体5(Toll-like receptor 5)识别。鞭毛蛋白与TLR5受体结合后,启动骨髓源细胞分化因子88(myeloid differentiation factor 88,MyD88)依赖的信号转导途径,最终激活核内因子κB (nuclear factor-κB, NF-κB)和有丝分裂原激活蛋白激酶(mitogen-activated protein kinases, MAPK)。NF-κB的激活可引发前炎性因子的合成和释放,如 TNF-α,IL-6,IL-8,IL-10等,从而产生针对病原微生物的天然免疫应答[10-11]。
本研究中,我们利用鞭毛蛋白的免疫佐剂特点,融合表达S.typhimurium鞭毛蛋白与S.aureusGapC蛋白,结果在二免后,小鼠抗GapC蛋白血清抗体水平显著高于单独GapC蛋白组,稍低于GapC蛋白弗氏佐剂组。Karam MR等[12-13]成功表达了Flic同尿道致病性大肠杆菌粘附素FimH的融合蛋白,融合蛋白组抗体水平显著高于单独的FimH蛋白组。Huleatt JW等[14]将鞭毛蛋白与卵清蛋白(OVA)融合表达,诱导小鼠产生针对 OVA 的特异性免疫应答。本研究中血清抗体检测结果与上述研究结果一致,说明鞭毛蛋白在小鼠体内能辅助GapC蛋白产生较高的特异性抗体,Flic-GapC融合蛋白能够刺激小鼠的体液免疫反应。
正常机体的T淋巴细胞表面具有识别有丝分裂原和抗原的受体,在体外培养时,受到有丝分裂原(PHA或ConA)或特异性抗原刺激后,细胞可以发生增殖。本实验中即利用重组蛋白对小鼠免疫后,分离二免疫后14 d小鼠的脾脏淋巴细胞,在体外用GapC抗原刺激,测定其淋巴细胞增殖水平来检测T淋巴细胞的应答功能。结果表明,各免疫组平均刺激指数显著高于Flic对照组和PBS 对照组(P<0.05),但GapC蛋白弗氏佐剂组和Flic-GapC蛋白组之间淋巴细胞刺激指数差异不显著(P>0.05)。说明鞭毛蛋白具有刺激T淋巴细胞增殖的能力。
ELISPOT方法具有较高的敏感性和特异性。本研究中以GapC蛋白为特异性刺激原,检测免疫小鼠脾脏淋巴细胞分泌IFN-γ和IL-4的能力。结果表明,用弗氏佐剂乳化GapC蛋白免疫小鼠后,脾淋巴细胞分泌IFN-γ和IL-4的能力最强,Flic-GapC融合蛋白次之,但与对照组相比差异仍然显著。说明鞭毛蛋白能够刺激TH1和TH2免疫应答,Flic-GapC融合蛋白也可以激发小鼠的细胞免疫应答和体液免疫应答。
小鼠攻毒保护试验显示,GapC蛋白弗氏佐剂组和Flic-GapC蛋白组具有具有一定的免疫保护效果,保护率分别为80%和70%,而单独的GapC蛋白组保护率仅有20%,对照组小鼠全部死亡。说明重组融合蛋白Flic-GapC具有良好的免疫原性,免疫小鼠后在一定程度上能够有效抵抗同源金黄色葡萄球菌的攻击,具有较好的免疫保护作用。但Flic-GapC蛋白与弗氏佐剂乳化后的免疫效果有待于进一步研究。
综上所述,Flic-GapC融合蛋白具有较好的免疫原性,能够诱发小鼠针对GapC蛋白的细胞和体液免疫反应,对金黄色葡萄球菌具有一定的免疫保护作用,可作为S.aureus的疫苗靶向进行深入研究。
参考文献:
[1]Lu CP. Veterinary microbiology[M]. Beijing: China Agriculture Press. 2007: 201-204. (in Chinese)
陆承平. 兽医微生物学[M]. 北京: 中国农业出版社,2007: 201-204.
[2]Goji N, Potter AA, Perez-Casal J. Characterization of two proteins ofStaphylococcusaureusisolated from bovine clinical mastitis with homology to glyceraldehyde-3-phosphate dehydrogenase[J]. Vet Microbiol, 2004, 99(3/4): 269-279. DOI: 10.1016/j.vetmic.2003.12.009
[3]Perez-Casal J, Prysliak T, Kerro-Dego O, et al. Immune responses toStaphylococcusaureusGapC/B chimera and its potential use as a component of a vaccine forS.aureusMastitis[J]. Vet Immunol Immunopathol, 2006, 109(1/2): 85-97. DOI: 10.1016/j.vetimm.2005.07.024
[4]Zhu HW, Zhu ZB, Cui YD, et al. GAPDH Activity and immunogenicity ofStaphylococcusaureusrecombinant GapC protein[J]. Chin J Biotech, 2008, 24: 754-759. (in Chinese)
朱洪伟, 朱战波, 崔玉东, 等. 金黄色葡萄球菌GapC蛋白的GAPDH活性及免疫原性分析[J]. 生物工程学报, 2008, 24(5): 754-759.
[5]Barton GM, Medzhitov R. Control of adaptive immune responses by Toll-like receptors[J]. Curr Opin Immunol, 2002, 14(3): 380-383. DOI: 10.1016/S0952-7915(02)00343-6
[6]Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat Immunol, 2010, 11(5): 373-384. DOI: 10.1038/ni.1863
[7]Nguyen CT, Kim SY, Kim MS, et al. Intranasal immunization with recombinant PspA fused with a flagellin enhances cross-protective immunity againstStreptococcuspneumoniaeinfection in mice[J]. Vaccine, 2011, 29(34): 5731-5739. DOI: 10.1016/j.vaccine.2011.05.095
[8]Wang H. Expression and immunogenicity research of fusion protein ofS.dysgalactiaeGapC andS.typhimuriumFliC[D]. Daqing: Heilongjiang Bayi Agricultural University, 2012. (in Chinese)
王鹤. 停乳链球菌GapC蛋白与鼠伤寒沙门氏菌FliC蛋白的融合表达及免疫原性研究[D]. 大庆: 黑龙江八一农垦大学, 2012.
[9]Pan ZM, Wen K, You M, et al. Adjuvant activity of the flagellin ofSalmonellatyphimuriumin the immune response of fusion protein of newcatle disease virus in mice[J]. Lett Biol, 2009, 20(6): 827-829. (in Chinese)
潘志明, 文科, 游猛, 等. 沙门菌鞭毛蛋白增强新城疫病毒融合蛋白在小鼠中的免疫原性[J]. 生物技术通讯, 2009, 20(6): 827-829.
[10]Arques JL, Hautefort I, Ivory K, et al.Salmonellainduces flagellin-and MyD88-dependent migration of bacteria-capturing dendritic cells into the gut lumen[J]. Gastroenterology, 2009, 137(2): 579-587. DOI: 10.1053/j.gastro.2009.04.010
[11]Im J, Jeon JH, Cho MK, et al. Induction of IL-8 expression by bacterial flagellin is mediated through lipid raft formation and intracellular TLR5 activation in A549 cells[J]. Mol Immunol, 2009, 47: 614-622. DOI: 10.1016/j.molimm.2009.09.004
[12]Asadi KM, Oloomi M, Habibi M, et al. Cloning of fimH and fliC and expression of the fusion protein FimH/FliC fromUropathogenicEscherichiacoli(UPEC) isolated in Iran[J]. Iran J Microbiol, 2012, 4(2): 55-62.
[13]Karam MR, Oloomi M, Mahdavi M, et al. Assessment of immune responses of the flagellin (FliC) fused to FimH adhesin of uropathogenicEscherichiacoli[J]. Mol Immunol, 2013, 54(1): 32-39. DOI: 10.1016/j.molimm.2012.11.002
[14]Huleatt JW, Jacobs AR, Tang J, et al. Vaccination with recombinant fusion proteins incorporating Toll-like receptor ligands induces rapid cellular and humoral immunity[J]. Vaccine, 2007, 25(4): 763-775. DOI: 10.1016/j.vaccine.2006.08.013

