eha基因对迟缓爱德华菌抵抗巨噬细胞内外压力的影响
李玉红,郑恩金,高大庆,李佳盈,成 静,徐泽炎,盛安康,张 坡,祝如愿,刁亦非,周佳莹,陆承平
迟缓爱德华菌(Edwardsiellatarda,简称E.tarda)属于肠杆菌科爱德华菌属,分布广泛,可感染鱼类、两栖类、爬行类、鸟类及哺乳类等。E.tarda能够引起多种鱼类感染,是水产养殖业的重要病原体[1]。该菌能够在宿主体内外和巨噬细胞环境中生存和繁殖, 是病原菌侵染宿主、引发疾病的先决条件。
高大庆等用鸟枪法在E.tarda中发现的一个溶血调控基因(E.tardahaemolysin activator gene,简称eha),前期的研究表明Eha蛋白是一个重要的转录调控因子[2-3]。我们在体外模拟了巨噬细胞内外杀菌的条件,分析eha基因在E.tarda适应巨噬细胞内胁迫中的作用,并进一步探讨其机制。
1 材料与方法
1.1材料
1.1.1菌株 强毒株E.tardaET-13由南京农业大学陆承平教授惠赠。E.tardaET-13的eha缺失株(Δeha)和Δeha互补株(ehaComp)由本室保存。弱毒株89602由江苏省临床检验中心程梅主任惠赠。
1.1.2培养基 细菌采用LB(Luria Broth)培养基来培养,抗生素浓度分别为:氯霉素(Cm)50 μg/mL,多粘菌素(Col)50 μg/mL。
1.2方法
1.2.1体外应激实验 按参考文献[4]的方法检测血清、胆汁、过氧化氢、SDS,多粘菌素B、酸等胁迫条件下细菌的存活率。对数期的菌体用PBS(pH 7.2)漂洗2次后,菌液 OD600调节为0.5。菌液分为两等份,一组作为对照,另一组经胁迫条件处理,为实验组。然后进行系列稀释,涂平板,计数菌落。菌液浓度=平板菌落数×稀释倍数,细菌存活率=实验组菌液浓度(cfu/mL)/对照组菌液浓度(cfu/mL)×100%。
1.2.2过氧化氢(H2O2)敏感性实验 按参考文献[4]的方法,对数期的菌体用PBS(pH7.2)漂洗2次后,LB调节OD600为0.5。取200 μL 菌液涂布LB平板上,将含不同浓度H2O2的纸片轻轻贴在培养基表面,要求纸片间距不小于24 mm,纸片中心距平皿边缘不小于15 mm。37℃静置培养24 h,用游标卡尺测量抑菌圈直径。
1.2.3RT-PCR 按Trizol试剂盒说明书,提取细菌RNA,取2 μg RNA逆转录成cDNA。再以cDNA为模版,用超氧化物歧化酶基因(superoxide dismutase C,sodC)、过氧化氢酶基因(catalase B,katB)和鞭毛蛋白基因(flagellin C,fliC)、Ⅲ型分泌系统的分泌蛋白基因(secretary protein C,eseC)的引物扩增各基因,以扩增16S rRNA基因作为内标参照,半定量检测各基因的转录水平。引物序列见表1。

表1 实验用引物名和引物序列
1.2.4细菌外膜蛋白的提取 方法参考文献[5],低速离心细菌培养物, 收集菌体,以Tris-Mg缓冲液重洗涤3次, 置冰浴中超声波破碎细菌,吸取上清。超速离心,去除上清。沉淀溶于2%十二烷基肌酸钠的Tris-Mg缓冲液中。再超速离心,沉淀溶于Tris-Mg缓冲液外膜蛋白。
1.2.510%SDS-PAGE外膜蛋白电泳,检测细菌外膜蛋白,方法参考文献[5]。加样量15 μL/孔,在 1×Tris一甘氨酸凝胶电泳缓冲液中电泳。样品在浓缩胶中的电泳电压为 80 伏,在分离胶的电泳电压为 120 伏。电泳后的凝胶置于考马斯亮兰 R-250 染色液中染色过夜,脱色液脱色后观察结果。
1.2.6统计学分析 细菌的存活率之间的比较采用t检验,以P<0.05为有统计学意义。
2 结 果
2.1细菌经酸处理后的存活率 模拟细菌在巨噬细胞吞噬溶酶体酸性的环境,经pH 5.0的酸处理后,eha缺失株的存活率明显低于野生株(P<0.05),互补株的存活率介于缺失株和野生株之间。表明eha基因缺失影响E.tarda菌对酸的敏感性,结果如图1(A)所示。
2.2细菌在SDS和多粘菌素B胁迫环境中的存活率 多粘菌素 B 是一种抗菌肽,它和表面活性剂SDS均干扰细菌细胞膜的合成。如图1(B)和1(C)所示,分别用0.05%(w/v)的SDS处理ET-13菌10 min后,以及用62.5 μg/mL的多粘菌素B处理1 h和2 h后,eha缺失株的存活率均明显低于野生株(P<0.05),互补株的存活率均处于野生株和缺失株之间。结果表明eha基因缺失可能影响细菌细胞壁的合成,从而使缺失株对表面活性剂和抗菌肽的敏感性增高。

图1比较ET-13野生株、缺失株和互补株经酸、SDS和多粘菌素B处理后存活率的差异
A图为野生株、缺失株及互补株经pH5.0酸处理2 h后的存活率;B图为野生株、缺失株及互补株经0.05%的SDS处理10 min后的存活率;C图为野生株、缺失株及互补株经62.5 μg/ml的多粘菌素B处理1 h和2 h后的存活率。
Fig.1Comparisonofthedifferencesofsurvivalratesofthewild,theΔehaandtheehaCompofET-13afterthetreatmentwithacid,SDSorpolymyxinB
A: Survival rates of wild type, ΔehaandehaComp after the treatment with acid pH5.0 for 2 h;
B: Survival rates of wild type, ΔehaandehaComp after the treatment with 0.05% (w/v) SDS for 10 min;
C: Survival rates of wild type, ΔehaandehaComp after the treatment of 62.5 μg/mL polymyxin B for 1 h or 2 h.
2.3细菌在血清或胆汁中的存活率 小鼠血清或鱼胆汁处理E.tarda强毒株ET-13后,eha缺失株的存活率与野生株的存活率没有明显区别(P>0.05),只是胆汁比血清杀菌效果更显著(资料未显)。这结果表明eha基因不影响E.tarda在动物体内血清和肠道胆汁中的存活率。而弱毒株89602对胆汁和血清的敏感性明显高于强毒株ET-13(P<0.05)。
2.4细菌经过氧化氢处理后的存活率 模拟细菌在巨噬细胞吞噬溶酶体氧化的环境,经不同浓度1 mmol/L、2 mmol/L、5 mmol/L、10 mmol/L的过氧化氢处理30min后,eha缺失株的存活率明显低于野生株(P<0.05),互补株的存活率介于缺失株和野生株之间,结果如图2(E)所示。
2.5细菌对过氧化氢敏感性实验 如图2(A-D)所示,通过测量过氧化氢抑菌环直径,并对结果进行统计学分析显示,纸片上50 mmol/L、100 mmol/L、200 mmol/L和500 mmol/L不同过氧化氢浓度作用下,中间的纸片为PBS对照,缺失株的抑菌环直径明显均大于野生株,有统计学意义(P<0.05),因此,eha的缺失使得细菌对过氧化氢的敏感性显著提高。
2.5RT-PCR显示eha基因对其他基因的调控作用 如图3所示,Δeha缺失株中超氧化物歧化酶基因sodC、过氧化氢酶基因katB和鞭毛蛋白基因fliC、Ⅲ型分泌系统分泌蛋白基因eseC的转录水平比野生株中基因明显降低,互补株ehaComp中这些基因的转录水平处于野生株和缺失株之间。结果提示eha基因对这些和细菌毒力相关的基因有正调控作用。
2.610%SDS-PAGE外膜蛋白电泳检测 结果见图4,比较ET-13野生株和△eha缺失株细菌浓度一致的情况下,3条差异带主要在15 kD与40 kD之间,从野生株中提取约37 kD外膜蛋白的表达明显高于缺失株的表达(资料未显)。
3 讨 论
E.tarda致病的关键是能够抵抗巨噬细胞内强氧化及酸性环境的杀伤作用,在宿主巨噬细胞内生存繁殖。巨噬细胞与病原菌接触,细菌表面的多种物质可激活巨噬细胞细胞膜上的NADPH氧化酶,从而引起呼吸爆发,产生杀伤病原菌的氧化物(如H2O2)[6]。E.tarda产生的过氧化氢酶(KatB)[7]和超氧化物歧化酶(SodB)[6]可以帮助细菌将有毒害的氧化物降解为水和氧气。本研究表明,eha基因抑制E.tarda产生过氧化氢酶和超氧化物歧化酶,有助于缺失株对H2O2敏感性增加,其结果降低细菌在巨噬细胞内的存活率。细菌的三型分泌系统(T3SS)拥有一个针状的结构,能够将细菌合成的效应蛋白通过这个结构分泌到宿主细胞的细胞基质中,改变宿主细胞的功能。沙门氏菌(如Salmonellatyphimurium)可利用分泌效应蛋白,阻止抗菌效应分子(如NADPH氧化酶)的正确转运至含有病A-C图显示野生株、缺失株Δeha及互补株对过氧化氢抑菌环直径,1、2、3、4分别代表纸片上过氧化氢浓度为500 mmol/L、200 mmol/L、100 mmol/L、50 mmol/L,中间的纸片为PBS对照;D图为过氧化氢抑菌环直径的统计图;E图野生株、缺失株及互补株经不同浓度过氧化氢作用30min后的存活率。
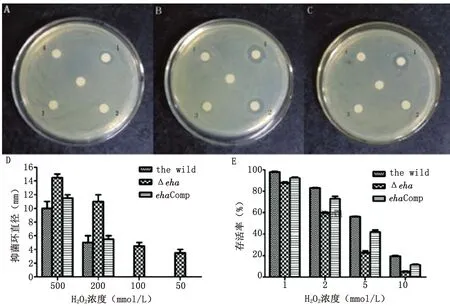
图2比较ET-13野生株、缺失株和互补株经过氧化氢处理后存活率和对过氧化氢的敏感性的差异
Fig.2ComparisononthedifferencesofsurvivalratesandH2O2sensitivityofthewild,theΔehaandtheehaCompofET-13
A-C: The bacteriostatic ring diameters of the wild, ΔehaandehaComp of ET-13 to H2O2.1, 2, 3 and 4 showed 500 mmol/L, 200 mmol/L, 100 mmol/L, and 50 mmol/L concentrations of H2O2in paper scraps, respectively.
D: The statistical chart of bacteriostatic ring diameters of H2O2.
E: Survival rates of the wild, ΔehaandehaComp after the treatment with different concentrations of H2O2for 30 min.
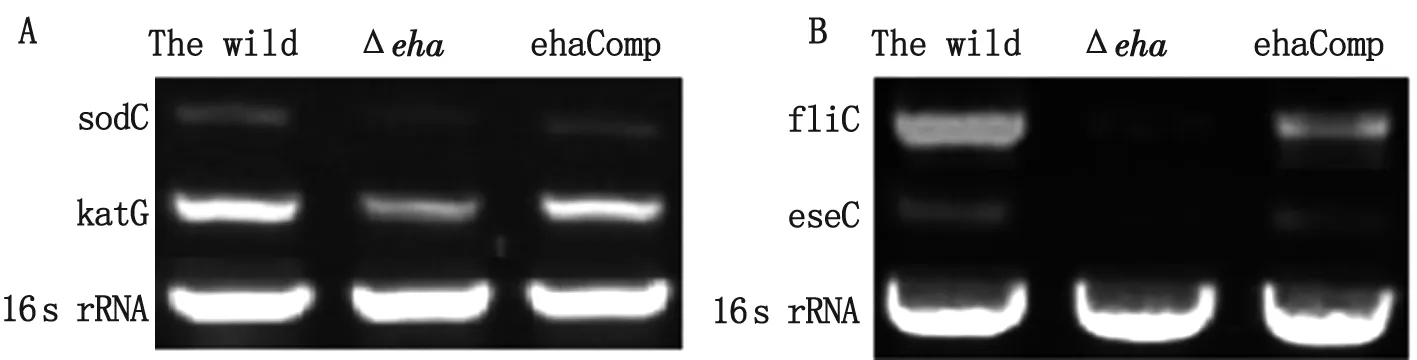
图3RT-PCR结果显示eha基因对ET-13其他毒力基因的调控作用
A图为超氧化物歧化酶(sodC)和过氧化氢酶(katB)基因在野生株、缺失株及互补株中的转录水平, 16SrRNA作为内参;B图为鞭毛蛋白(fliC)和 Ⅲ型分泌系统分泌蛋白(eseC)基因在野生株、缺失株及互补株中的转录水平,16SrRNA作为内参。
Fig.3TheehageneregulatedothervirulencegenesinET-13byRT-PCR
A: Transcription levels of superoxide dismutase (sodC) and catalase (katG) in the wild, ΔehaandehaComp of ET-13, with 16s rRNA as internal reference;
B: Transcription levels of flagellin (fliC) and secretory protein of type Ⅲ secretion system (eseC) in the wild, ΔehaandehaComp of ET-13, with 16s rRNA as internal reference.
原菌的空泡中,并可以阻止含有细菌的空泡酸化,从而达到有利于细菌存活并增殖的目的[8]。本研究表明,eha基因抑制E.tarda三型分泌系统产生分泌蛋白EseC的产生,可能与缺失株对酸敏感性增加有关。细菌的鞭毛丝是由鞭毛蛋白(Flagellin, FliC)装配而成的,本研究用RT-PCR证明eha基因的缺失可以影响flic基因的转录和表达。此外,eha缺失株在SDS和多粘菌素B胁迫环境中的存活率降低,说明eha基因缺失可能影响细菌细胞外膜蛋白的合成,SDS-PAGE外膜蛋白电泳也证明这一结果,其中37 kD外膜蛋白,注射小鼠和鱼后,可诱导良好的体液和细胞免疫保护[6]。

图410%SDS-PAGE电泳比较ET-13野生株和缺失株外膜蛋白表达的差异
1.野生株,2.缺失株,M.蛋白marker。
Fig.4ComparisonofthedifferencesoftheOMPproteinsofthewildandΔehastrainsby10%SDS-PAGEelectrophoresis
1: Wild type; 2: Δeha; M: Protein marker.
参考文献:
[1]Chen AP, Jiang YL, Qian D, et al. Edwardsiellasis[J]. China Fisheries, 2011, 7: 49-50. (in Chinese).
陈爱平,江育林,钱冬,等. 迟缓爱德华氏菌病 [J].中国水产,2011,7:49-50.
[2]Gao DQ, Kan B, Lu CP, et al. Primary analysis and sequencing the hemolytic relative gene ofEdwardsiellatarda[J]. J Genet Genom, 2001, 25(12): 1162-1167. (in Chinese)
高大庆,阚飙,陆承平,等.迟缓爱德华菌溶血相关基因的测序和初步的功能分析[J].遗传学报,2001,25(12):1162-1167.
[3]Zheng EJ, Gao DQ, Hong J, et al.eha, a regulating virulence gene ofEdwardsiellatarda[J]. Chin J Zoonoses, 2010, 26(11): 999-1003. (in Chinese)
郑恩金, 高大庆,洪捷, 等.eha,迟缓爱德华菌一个毒力调控基因[J].中国人兽共患病学报,2010,26(11): 999-1003.
[4]Pan HJ, Hao B, Li J, et al, Impact of Cpx on the virulence ofEdwardsiellatarda[J]. Marine Sci, 2013, 37 (2): 17-21. (in Chinese)
潘海建, 郝斌, 李杰, 等. Cpx 对迟缓爱德华氏菌毒力的影响[J].海洋科学,2013,37(2):17-21.
[5]Kawai K, Liu Y, Ohnishi K, et al. A conserved 37 kDa outer membrane protein ofEdwardsiellatardaA conserved 37 kDa outer membrane protein ofEdwardsiellatardais an effective vaccine candidate[J]. Vaccine, 2004, 22(25-26): 3411-3418. DOI: 10.1016/j.vaccine.2004.02.026
[6]Srinivasa Rao PS, Lim TM, Leung KY. Opsonized virulentEdwardsiellatardastrains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates[J]. Infect Immun, 2001, 69(9): 5689-5697. DOI: 10.1128/IAI.69.9.5697.2001
[7]Cheng S, Zhang M, Sun L. The iron-cofactored superoxide dismutase ofEdwardsiellatardainhibits macrophage-mediated innate immune response[J]. Fish Shellfish Immunol, 2010, 29(6): 972-978. DOI:10.1016/j.fsi.2010.08.004
[8]Figueira R, Watson KG, Holden DW, et al. Identification ofSalmonellapathogenicity island type III secretion system effectors involved in intramacrophage replication ofS.entericaserovar typhimurium: implications for rational vaccine design[J]. MBio, 2013, 4(2): eooo65. DOI: 10.1128/mBio.00065-13

