抗EV71病毒人源抗体Fab段表达基因的构建及序列分析
余艳琼,翁育伟,2,严延生,2
肠道病毒71型(Human enterovirus 71,EV71)是引起手足口病(hand foot mouth disease,HFMD)的主要病原体之一[1],其感染传播途径复杂,可通过消化道、呼吸道、密切接触等多种途径传播。人群对EV71型肠道病毒普遍易感,成人多因隐性感染获得免疫力,因此感染者主要为学龄前儿童,其中部分患儿可引起心肌炎、肺水肿、无菌性脑膜脑炎等严重并发症,甚至导致死亡。近几年,HFMD在亚太地区广泛流行,对儿童的健康成长造成严重威胁,成为政府和社会高度关注的公共卫生问题。尽管EV71疫苗研究已经取得重要进展[2],但临床上还没有针对EV71感染的特效抗病毒药物。特异性抗体是临床治疗病毒性感染的重要手段之一[3],其中人源性抗体因其可以避免患者产生人抗鼠抗体(Human anti-mouse antibody,HAMA)反应[4],成为目前研制各类治疗性抗体的主要方向。本研究从EV71成人感染者外周血淋巴细胞中分别调取IgG轻、重链可变区基因,经重叠PCR构建人IgG抗体的Fab段,为进一步构建人源化的EV71病毒单克隆抗体库奠定基础。
1 材料与方法
1.1材料
1.1.1人外周血淋巴细胞 由EV71病毒血清中和抗体阳性且免疫功能健全的成人外周血中分离。
1.1.2毒株和噬菌粒 EV71病毒分离株(LY008)由本实验室分离并保存。含人IgG抗体重链及轻链恒定区序列的pComb3XTT 和 pComb3Xλ噬菌粒由本实验室保存。
1.1.3引物 扩增使用的引物参照Andris-Widhopf等[5]的文献,其中扩增重链可变区(heavy chain variable region , VH)基因的引物12对,扩增kappa链(kappa chain variable region, Vκ)基因的引物4对,扩增lamda链(lamda chain variable region, Vλ)基因的引物9对,扩增重、轻链恒定区CH1、Cκ、Cλ基因的引物各一对,用于kappa及lamda链序列拼接的引物各一对,用于Fab链序列基因片段的引物一对,以上引物均由TaKaRa公司合成。
1.1.4主要试剂 人淋巴细胞分离液购自天津灏洋生物制品公司;TRIzol®LS Reagent、逆转录试剂盒购自Invitrogen公司;高保真PCR扩增试剂盒购自Roche公司;柱式质粒DNA小量抽提试剂盒购自TIANGEN公司;柱式胶回收试剂盒购自QIAGEN公司;DNA Marker 、T-Vector pMD20、JM109感受态细胞购自TaKaRa公司;BigDye®Terminator测序试剂盒购自ABI公司,其他试剂均为实验室常规试剂。
1.1.5主要仪器 Beckman台式高速冷冻离心机、Applied Biosystems 3500/3500 XL遗传分析仪、Bio-Rad 水平电泳仪、Biometra Tg PCR仪、NanophotometerTMPeal超微量紫外可见分光光度计、BOX化学发光荧光凝胶成像系统、恒温培养箱、恒温摇床。
1.2方法
1.2.1人EV71病毒血清中和抗体滴度的测定 从20名健康成人抽取少量外周血(3 mL),分离血清,以EV71病毒分离株为抗原,检测EV71病毒中和抗体滴度[6]。从中筛选出1名血清中和抗体滴度为1∶128的成人,抽取其外周血50 mL,置于肝素瓶中备用。
1.2.2cDNA的合成 用淋巴细胞分离液常规分离上述外周血淋巴细胞,重悬于PBS液并作细胞计数,共获得2.8×108个淋巴细胞,按TRIzol试剂说明书提取总RNA,并以其为模板,以Oligo(dT)20为引物合成cDNA第一链。
1.2.3重、轻链可变区及恒定区基因扩增 以上述制备好的 cDNA 为模板,运用温度梯度 PCR确定重链与轻链扩增的退火温度,在相对应的VH、Vκ和Vλ引物作用下,分别扩增出不同亚群的VH、Vκ和Vλ基因;以 pComb3XTT 噬菌粒为模板,用CH1和Cκ引物按上述方法 PCR 扩增重链恒定区 CH1和 Cκ基因;以 pComb3Xλ 噬菌粒为模板,以Cλ引物扩增轻链Cλ恒定区基因。PCR产物经2%琼脂糖凝胶电泳后,进行胶回收并定量,用以进行重叠PCR(Splicing by overlap extension PCR,SOE PCR)。
1.2.4重叠PCR 分别以等摩尔比混合VH 和CH1回收产物、Vκ和Cκ回收产物、Vλ和Cλ回收产物,并分别使用Lead VH和dpseq引物、RSC-F和Lead-B引物进行重叠PCR,获得Fd基因(重链)和kappa及lamda基因(轻链)。产物经2%琼脂糖凝胶电泳后进行回收纯化,将回收的kappa及lamda基因片段混合后即得到轻链基因库。取纯化的Fd及轻链基因片段各约100 ng,不加引物,经94℃预变性5 min,94℃ 15 s,56℃ 15 s,72℃ 3 min,10个循环后,4℃ 2 min,加引物RSC-F(sense) 和dp-EX(reverse),94℃预变性2 min,94℃变性15 s,56℃退火15 s,72℃延伸 3 min,72℃ 10 min,20个循环后,获得Fab基因片段,产物经2%琼脂糖凝胶电泳鉴定并回收,冻于-20℃待用。
1.2.5Fab基因片段克隆及多样性鉴定 通过TA克隆的方法,将纯化后Fab基因片段重组到T-Vector pMD20T载体中,并将该重组质粒转化至JM109感受态细胞中,在含有X-Gal、IPTG、Amp的LB-琼脂平板培养基上过夜培养。次日随机挑选白色菌落,接种含Amp的LB-液体培养基,提取质粒,分别用引物M13 primer RV(5′-CAGGAAACAGCTATGAC-3′)和引物M13 primer M4(5′-GTTTTCCCAGTCACGA-3′)进行测序。测序结果运用DNASTAR软件进行分析,确定轻、重链可变区序列后与IMGT/V-QUEST数据库(http: //imgt.org)比对,确定轻、重链序列的家系,并计算Fab段基因的多样性。
2 结 果
2.1抗体轻、重链可变区和恒定区基因的扩增及鉴定 以cDNA为模板,成功扩增出12条VH基因、4条Vκ基因和9条Vλ基因,扩增的产物分子量符合预期要求,结果分别见图1,2,3。分别以pComb3XTT、pComb3Xλ为模板,扩增得到CH1、Cκ、Cλ片段,大小约为350~400 bp,与预期相符。
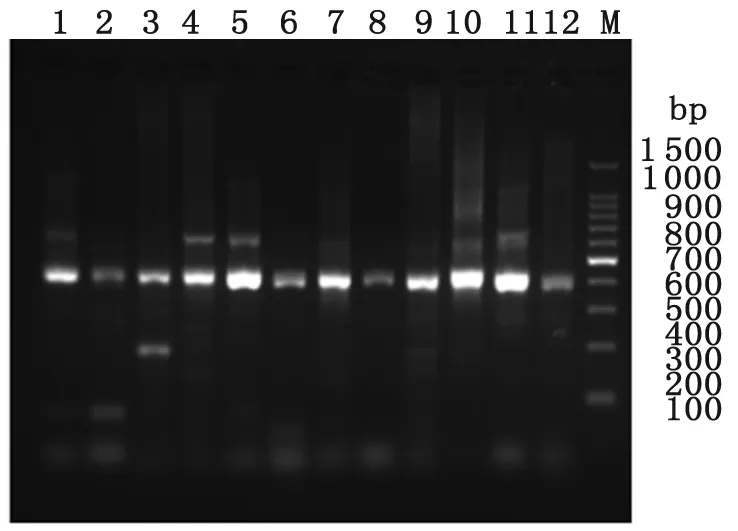
图1人源抗体VH基因PCR产物
M: 100 bp DNA marker; 1-12:VH基因12对引物PCR扩增产物
Fig.1PCRproductsofhuman-originVHgenes
M: 100 bp DNA marker; 1-12: PCR products of VH genes by 12 pairs of human IgG primers.
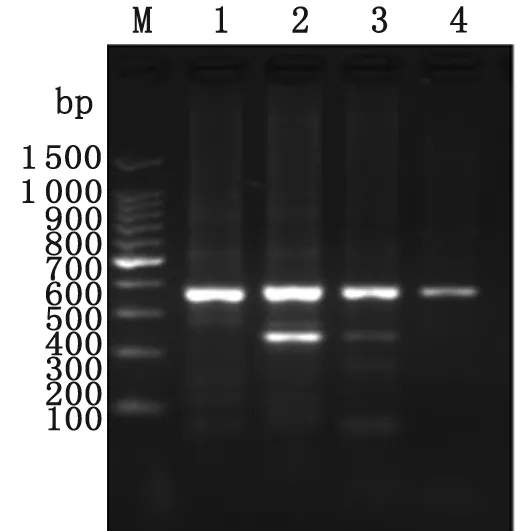
图2人源抗体Vκ基因PCR产物
M: 100 bp DNA marker; 1-4: Vκ基因4对引物PCR扩增产物
Fig.2PCRproductsofhuman-originVκgenes
M: 100 bp DNA marker; 1-4: PCR products of Vκ genes by 4 pairs of human IgG primers.
2.2重叠PCR结果及鉴定 采用重叠PCR法,分别混合VH 和CH1、Vκ和Cκ、Vλ和Cλ纯化片段,运用对应的引物,扩增后分别获得Fd基因、kappa及 lamda基因片段,大小约750~800 bp,结果见图4。等量混合纯化后的Fd及轻链基因片段(含kappa和lamda),经重叠PCR扩增后获得完整的Fab片段,大小约为1 500 bp,电泳结果见图5。上述重叠PCR所获得的片段大小均符合预期。
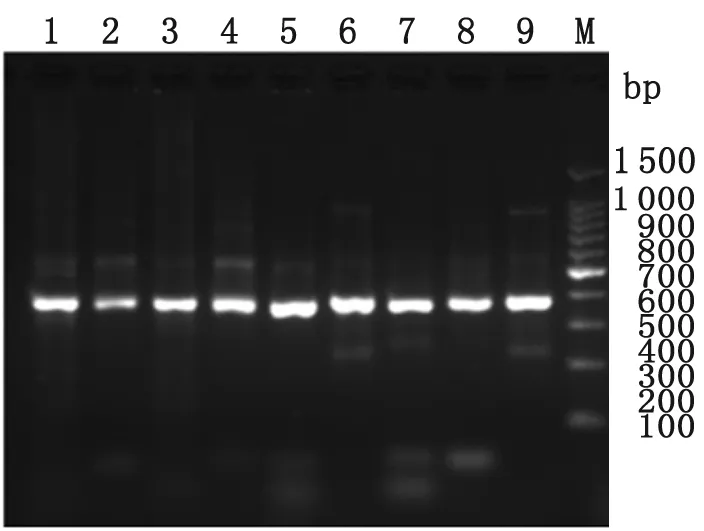
图3人源抗体Vλ基因PCR产物
M: 100 bp DNA marker; 1-9: Vλ基因9对引物PCR扩增产物
Fig.3PCRproductsofhuman-originVλgenes
M: 100 bp DNA marker; 1-9: PCR products of Vλ genes by 9 pairs of human IgG primers.
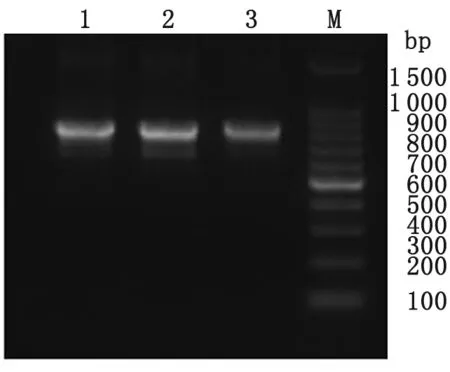
图4抗体Fd、kappa及lamda基因PCR纯化产物
M: 100 bp DNA marker; 1:lamda基因PCR纯化产物; 2:κappa基因PCR纯化产物; 3: Fd基因PCR纯化产物
Fig.4PurifiedPCRproductsofFd,kappaandlamdachaingenes
M: 100 bp DNA marker; 1: PCR products of lamda chain genes; 2: PCR products of kappa chain genes; 3: PCR products of heavy chain Fd genes.
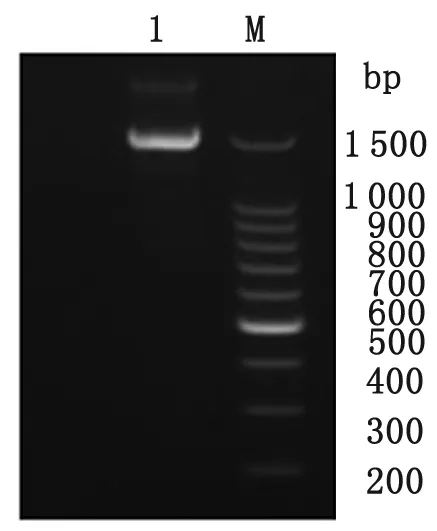
图5抗体Fab基因PCR纯化产物
M: 100 bp DNA marker; 1: Fab基因PCR纯化产物
Fig.5PurifiedPCRofproductsFabfragment
M: 100 bp DNA marker; 1: PCR products of Fab fragment.
2.3Fab片段测序及多样性分析 随机挑取25个白色菌落,接种液体LB,提取质粒。对其中成功插入目的片段的17个重组质粒进行核酸序列测定、拼接,最后获得17条完整的Fab基因序列。将对应的重、轻链可变区基因序列与IMGT/V-QUEST数据库比对,结果表明它们均为人IgG抗体的Fab基因序列,其中所获重链可变区基因包含了IGHV1-4家系、IGHD1-5家系及IGHJ4-5家系;轻链可变区基因的家族包含了IGKV1、4家系、IGKJ1、2、4家系、IGLV1~4家系及IGLJ2-3家系。分析重链和轻链的多样性分别为70.59%和76.47%,重、轻链组合后其多样性为94.12%。结果见表1。
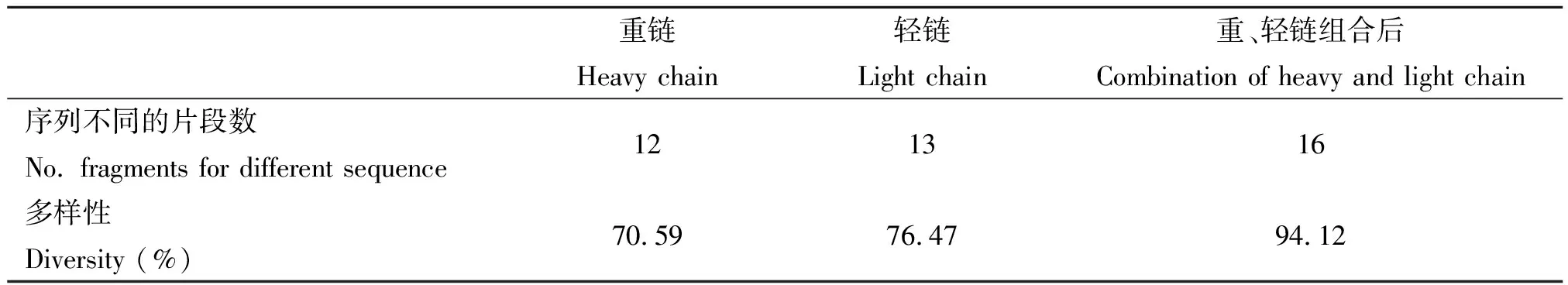
表1 Fab片段多样性
3 讨 论
自1975年Kohler和Milstein[7]发明了B淋巴细胞杂交瘤技术,并首次获得了单克隆抗体(monoclonal antibody, MAb)后,单抗药物迅速发展并广泛应用于临床治疗。该方法具有简便、易筛选、产量高等诸多优点,然而,由于应用该方法所获得的抗体多为鼠源抗体,对人免疫系统具有较强的免疫原性,可诱发人抗鼠抗体反应[4],并且此类抗体不能有效地激活人体免疫系统的生物效应功能,因此在临床应用受到极大限制。鼠源单抗人源化或完全人源性抗体制备技术获得的抗体可以减少或避免HAMA反应,此类技术制备的抗体已经在肿瘤治疗等临床中得到应用[8]。但目前国内外在制备EV71人源抗体方面的研究甚少。欲构建人源抗体文库,首先需要考虑的问题是构建单链抗体(ScFv)文库还是Fab抗体文库,这两种形式是目前人源抗体文库的主要形式。ScFv是通过连接肽把抗体重轻链的可变区连接起来,其特点是表达产量高,但易形成多聚体。而Fab是一种稳定的、性质明确的蛋白片段,一般不形成多聚体[9]。虽然在大肠杆菌中的表达产量较ScFv低[10],但它具有与抗原结合的独立功能,且Fab较ScFv更容易转化成完整的抗体分子。基于上述原因,我们选择了Fab抗体文库作为人源抗体文库的构建形式。
为了建立一个高质量、大容量、且能够筛选出特异性抗体的抗体基因库,我们在抗体库基因的来源上进行了筛选。理论上,一个B细胞含有一种抗体基因,人类天然抗体库的重链基因多样性达到107,轻链基因多样性达到105,只有当淋巴细胞的量达到该数量级,才有可能将每一种抗体基因都扩增出来[11]。本次研究从该名自愿者的外周血中,共分离得到2.8×108个淋巴细胞,其数量级已达到建库要求,这为成功构建大库容量的抗体库奠定了基础。抗体库中特异性单抗的含量,不仅取决于抗体库的容量,同时还与外周血中特异性抗体的含量密切相关。虽然EV71感染后发病患者主要为学龄前儿童,但有统计分析表明[12]婴幼儿体内EV71保护性抗体水平非常低,而EV71引起的脑膜脑炎患儿体内中和抗体水平与正常儿童并无明显差异,考虑造成这种现象的原因是婴幼儿的免疫应答机制不成熟,而且体内淋巴细胞仍处于动态变化中,功能尚不完善,合成抗体能力也较差[13]。故与以往选择恢复期患儿外周血作为人源中和性EV71抗体来源的相关研究不同,本次研究标本选自EV71中和抗体阳性且免疫功能健全的成人,其外周血更有利于获得高丰度的EV71肠道病毒抗体表达基因,从而确保了抗体基因库的高质量。
本次实验成功完成了所有引物对的扩增,且为了检验所获得的Fab片段的多样性,我们通过TA克隆,将Fab片段重组到载体中,并将该重组质粒转化至感受态细胞,随机挑选阳性克隆,提取质粒进行序列分析,共获得了17条基因序列。运用MEGA5.0软件分别找出所对应的重、轻链基因序列,将这些序列与IMGT/V-QUEST数据库比对,结果表明均为人IgG抗体的Fab基因序列,并获得它们的抗体基因家族信息,其中VH基因家族的分布频率为:VH1(11.76%)、VH2(11.76%)、VH3 (23.53%)、VH4(52.94%), VL基因家族的分布频率为:Vλ1(58.33%)、Vλ2(16.67%)、Vλ3(16.67%)、Vλ4(8.33%)和Vκ1(80%)、Vκ4(20%)。一般认为,VH可分成7个基因家族,VH1~VH7[14],其中VH3所占比例最高(约45.6%),而VH5、VH6及VH7表达频率极低[15];VL基因家族中,Vκ的功能基因可分为1~5个家族,以Vκ1最多见;Vλ的功能基因可分为11个基因家族,以Vλ3最多见[16]。而在本次研究结果中,VH4相较于VH3表达频率更高,而在λ轻链中Vλ1最多见,出现该现象的原因考虑是不同个体间抗体基因的使用频率差异造成的。正如Davidkova等[17]运用原位杂交的方法,发现各健康个体之间VH基因家族的使用频率存在很大差异的结果。最后,经过序列分析发现,扩增所得到Fab基因片段,其重链和轻链的多样性分别为70.59%和76.47%,重、轻链组合后其多样性为94.12%,提示该基因文库多样性良好,可以满足抗体库筛选的要求。
下一步我们将在构建高质量的噬菌体抗体库、筛选EV71病毒特异性抗体等方面展开进一步的研究,实现生产高亲和力、高产量的人源化中和性EV71病毒单克隆抗体的目标。
参考文献:
[1]Chatproedprai S, Theanboonlers A, Korkong S, et al. Clincal and molecular characterization of hand-foot-and-mouth disease in Thailand, 2008-2009[J]. Jpn J Infect Dis, 2010, 63(4): 229-233.
[2]Li H, Li W. Research progress of enterovirus 71 vaccine[J]. Progt Microbiol Immunol, 2012, 40(2): 89-94. (in Chinese)
李欢, 李薇.肠道病毒71型的研究进展[J].微生物学免疫学进展, 2012 , 40(2): 89-94.
[3]Song HJ. Construction and identification on the therapeutic chimeric antibodies with broad-spectrum neutralization to highly pathogenic avian influenza H5N1 virus[D]. Xiamen: Xiamen University, 2009. (in Chinese)
宋慧娟. 高致病性禽流感病毒H5N1治疗性嵌合抗体研究[D].厦门:厦门大学, 2009.
[4] Robert R, Lefranc MP, Ghochikyan A, et al. Restricted V gene usage and VH/VL pairing of mouse humoral response against the N-tenninal immunodominant epitope of the amyloidβpeptide[J]. Mol Immunol, 2010, 48(1/3): 59-72. DOI: 10.1016/j.molimm.2010.09.012
[5]Andris-Widhopf J, Steinberger P, Fuller R, et al. Generation of human Fab antibody libraries: PCR amplification and assembly of light- and heavy-chain coding sequences[J]. Cold Spring Harbor Protocols, 2011, 2011(9): 1151-1165. DOI: 10. 1101/pdb. prot065565
[6]National Polio and Measles Laboratory. Hand-foot-and-mouth Disease Laboratory Manual[R]. Beijing: Chinese Center for Disease Control and Prevention, 2010: 20-26. (in Chinese)
国家脊髓灰质炎和国家麻疹实验室.手足口病实验室手册[R].北京: 中国疾病预防控制中心,2010: 20-26.
[7]Kohler G, Milstein C. Continuous culture of fused cells secreting antibody of predefined specificity[J]. Nature, 1975, 256(5517): 495-497.
[8]Chen LH, Song HF, Liu XW, et al. Advances in humanized monoclonal antibody for therapeutic uses[J]. Chin J New Drugs, 2004, 13(7): 590-594. (in Chinese)
陈立慧, 宋海峰, 刘秀文, 等. 治疗性人源化单克隆抗体研究进展[J]. 中国新药杂志, 2004, 13(7): 590-594.
[9]Fox KM, Dias JA, Van Roey P. Three-dimensional structure of human follicle-stimulating hormone[J]. Mol Endocriol, 2001, 15(3): 378-389. DOI: 10.1210/me.15.3.378
[10]Furuse M, Hata M, Furuse K, et al. Claudin-based tightjunctions are crucial for the mammalian epidermal barrier: alesson from claudin-deficient mice[J]. J Cell Biol, 2002, 156(6): 1099-1111. DOI: 10.1083/jcb.200110122
[11]Liu XY, Zhao ZF, Xu J, et al. The construction of human phage display library of Alzheimer’s disease[J]. Chin J Gerontol, 2011, 17(31): 3294-3297. (in Chinese)
苏雪莹, 赵振富, 徐杰, 等. 人源性老年痴呆单链噬菌体抗体库的构建[J]. 中国老年学杂志, 2011, 17(31): 3294-3297.
[12]Sun LN, Zhang L, Zhang FS, et al. Generation of recombinant human antibodies for EV71 virus[J]. Chin J Exp Clin Virol, 2011, 25(3): 161-163. (in Chinese)
孙丽娜, 张黎, 张福顺, 等. 人源抗EV71病毒基因工程抗体的研究[J]. 中华实验和临床病毒学杂志, 2011, 25(3): 161-163.
[3]Flanagan KL, Burl S, Lohman-Payne BL, et al. The challenge of assessing infant vaccine responses in resource-poor settings[J]. Expert Rev Vaccines, 2010, 9(6): 665-674. DOI: 10.1586/erv.10.41
[14]Pallars N, Lefebvre S, Contet V, et al. The human immunoglobulin heavy variable genes[J]. Exp Clin Immunogenet, 1999, 16: 36-60.
[15]Gorny MK, Wang XH, Williams C, et al. Preferential use of the VH5-51gene segment by the human immune response to code for antibodies against the V3 domain of HIV-1[J]. Mol Immunol, 2009, 46: 917-926. DOI: 10.1016/j.molimm.2008.09.005
[16]Shao HX, Zhang L, Yang B, et al. Construction and diversity analysis of a naive human phage-displayed Fab library[J]. Chin J Immunol, 2010, 11(10): 1007-1015. (in Chinese)
邵红霞, 章黎, 杨彬, 等. 天然人源IgG Fab噬菌体抗体库的构建及多样性分析[J]. 中国免疫学杂志, 2010, 11(10): 1007-1015.
[17]Davidkova G, Pettersson S, Holmberg D, et al. Selective usage of VH genes in adult human B lymphocyte repertoires[J]. Scand J Immunol, 1997, 45: 62-73. DOI: 10.1046/J.1365-3083.1997.d01-376.x

