猪链球菌2型中国强毒株05ZYH33 ofs基因敲除突变株构建及其生物学特性研究
李 敏,王 晶,史沛举,郭静静,杜骁杰,李先富,王长军,潘秀珍, ,高基民
猪链球菌2型(Streptococcussuis2,S.suis2)是一种危害全球的人兽共患病病原菌。该病原菌不仅可致猪脑膜炎、败血症、关节炎、肺炎及心内膜炎等,而且还可感染人,给相关从业者和广大群众的生命安全造成严重威胁[1-2]。但目前S.suis2致病的具体机制仍不清楚。对于猪链球菌毒力因子的研究一直是一个热点,目前只有荚膜多糖(CPS)是唯一证明的主要毒力因子[3]。其它已知的与S.suis致病性相关的毒力因子有溶菌酶释放蛋白(muraminidase released protein,MRP)、胞外因子(extracellular factor,EF)、溶血素(suilysin,Sly),二肽酶Ⅳ(Dipeptidyl Peptidase IV)、烯醇化酶(Enolase)以及猪链球菌组氨酸三聚体蛋白(Histidine triad protein ofS.suis,Htps)等[4-9]。S.suis2的不同分离株致病性具有很大差异,可能与其毒力因子密切相关。猪链球菌血清浑浊因子(Opacity factor ofS.suis,OFS)是猪链球菌中新近鉴定的的一种重要的毒力因子[10]。本课题组前期通过对中国强毒株05ZYH33进行生物信息学分析,证实基因组中存在ofs编码基因(05SSU1663),该基因位于基因组1575793-1578639 bp之间(基因全长2 847 bp),并且对该基因的N-末端功能区域ofs37 - 683进行了敲除[11]。在此基础上,为了进一步研究ofs在S.suis2致病过程中的作用,我们以强致病株S.suis05ZYH33为研究对象,利用同源重组的基因敲除原理构建了ofs基因全长敲除突变株, 并通过猪链球菌2型感染BALB/c小鼠模型实验证实猪链球菌血清浑浊因子ofs基因全长缺失株对细菌毒力的影响,为进一步探究S.suis2新的致病因子及其致病机制奠定基础。
1 材料和方法
1.1材料
1.1.1菌株、质粒和引物 文中所用菌株和质粒以及引物见表1和表2。
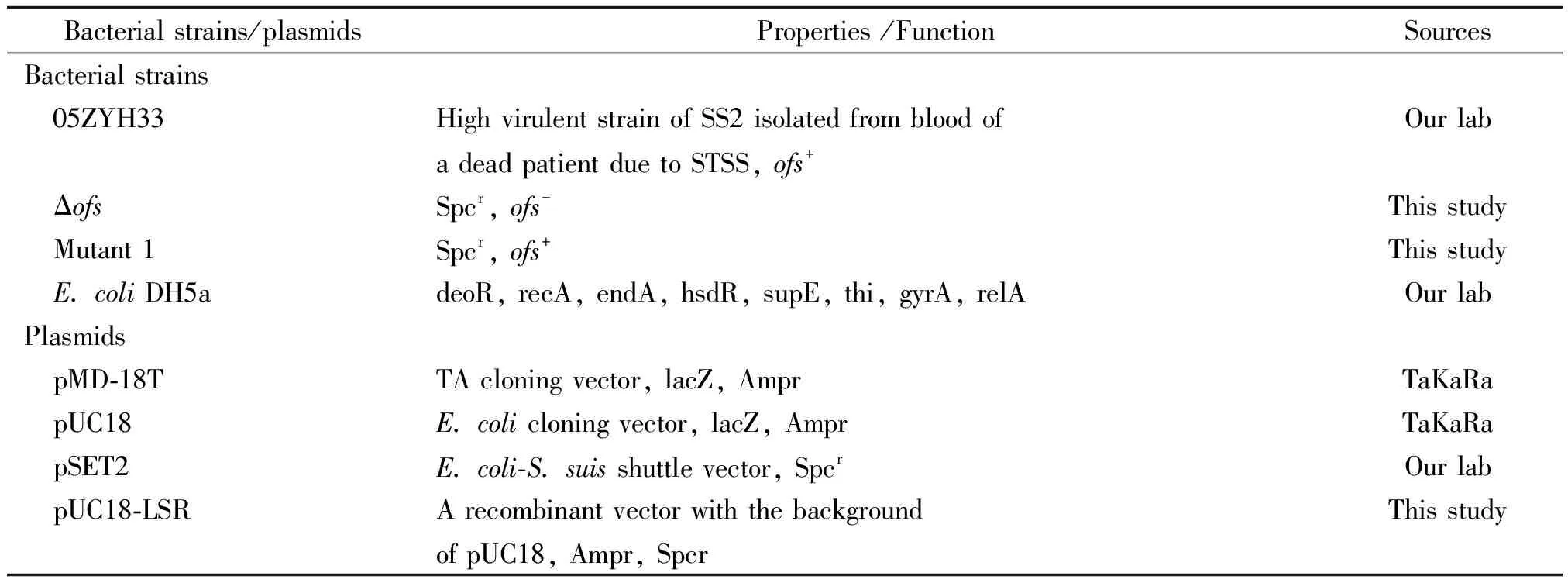
表1 实验所用的菌株、质粒

表2 实验所用引物序列
1.1.2主要试剂和仪器 ExTaq DNA聚合酶、DNA限制性内切酶、T4 DNA连接酶、质粒DNA抽提试剂盒均为Takara公司产品;胶回收试剂盒为Promega公司产品,Todd-Hewitt Broth(THB)培养基为Difco公司产品;Gene Pulser XcellTM型电穿孔仪为Bio-Rad公司产品;Biodyne®B 正电荷尼龙膜(8 cm×12 cm)、CL-XPosureTM X 光胶片(5′×7′)、North2South®DNA 随机引物生物素标记试剂盒、North2South®化学发光杂交检测试剂盒为Pierce公司产品; parafilm 膜和WB506 型杂交袋为上海西唐生物科技有限公司产品;Whatman 3MM 滤纸为Whatman公司产品;显影粉和定影粉为江苏广达摄影材料厂产品;核酸杂交仪为HYBAID公司产品;Ultrospec2000型紫外分光光度计为Pharmacia公司产品。
1.1.3实验动物 BALB/c小鼠( SPF 级) ,雌性,4周龄,购自中国人民解放军军事医学科学院实验动物中心。
1.205ZYH33ofs基因敲除突变株的构建和鉴定
1.2.1基因敲除载体的构建 以S.suis2 05ZYH33基因组DNA为模板,用引物对LA1 /2、RA1 /2分别扩增ofs基因的上下游DNA片段LA及RA; 同时以pSET2质粒为模版,用引物Spc1/2扩增壮观霉素抗性基因(spcrcassette)。分别将LA、RA片段连接到 pMD-18T上,将Spc片段到pUC18上。在限制性内切酶EcoR I和BamH I及T4DNA连接酶的作用下,将LA连接到pUC18-spc上,再利用限制性内切酶SalI和SphI及T4DNA连接酶将RA连接到pUC18-LA-spc上,形成一个spcr基因两侧具有与ofs上下游同源序列同源的基因敲除载体pUC18-LSR(图1),并通过双酶切和测序对其验证。
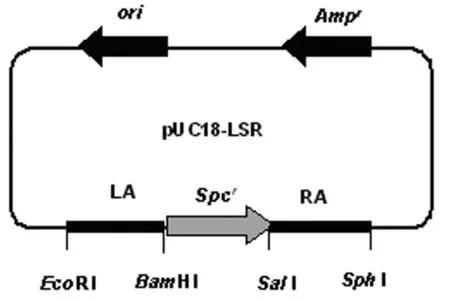
图1 ofs基因敲除载体构建示意图
1.2.2基因敲除突变株的构建和和鉴定 参照Smith等[12]的方法制备S.suis2 05ZYH33感受态细菌。在22.5 Kv/cm、500 Ω和25 μF电转参数下,将基因敲除载体pUC18-LSR电转化入感受态细菌,电转结束后将菌液涂布于THB平板(含100 mg/mL壮观霉素),37 ℃培养48 h后,挑取单菌落进行培养并取2 μL菌液作模板,用引物对IN1/IN2 (位于ofs基因的内部)进行PCR初步筛选,并对疑似阳性菌株进行组合PCR和Southern杂交验证。
1.3生物学特性分析
1.3.1革兰氏染色分析 分别将突变株和野生型接种THB 培养基(含10%胎牛血清)中于37 ℃培养至OD600≈0.6, 用接种环取样均匀涂布于载玻片上, 自然晾干后进行常规革兰氏染色,于油镜( 1000 倍)下观察菌落形态。
1.3.2菌落形态和溶血活性的比较 将突变株△ofs和野生株 05ZYH33 用三线法分别划线接种于 THB琼脂血平板(5%绵羊血), 37 ℃培养48 h后,观察突变株和野生株在菌落形态和溶血活性方面的差异。
1.3.3细菌生长速率的比较 取等量(OD600≈0. 008)的突变株和野生株菌液37 ℃振荡培养,每间隔1 h测取OD600值,直至细菌生长处于稳定期,重复实验3次并绘制生长曲线。
1.3.4小鼠致病性实验 参照本实验室常规的方法进行[13-15]。30只BALB/c小鼠随机分为3组,每组10只。将野生株05ZYH33和突变株Δofs于37 ℃过夜培养12 h,次日以1∶100的比例接种于新鲜配制THB中生长至OD600≈0.4,分别经腹腔接种野生株05ZYH33与敲除株Δofs菌液各1 mL (1×108CFU / 只),阴性对照组注射THB培养基1 mL,及时观察记录小鼠发病及死亡情况。
2 结 果
2.105ZYH33ofs基因敲除载体的验证 对构建好的重组质粒进行PCR(图2)和双酶切验证(图3), 结果与预期一致。对重组质粒的测序结果也显示3个片段LA(1 024 bp)、Spc(1 130 bp)和RA(989 bp)连接测序正确,重组质粒构建成功。
2.205ZYH33ofs基因敲除突变株的初步筛选 用引物对IN1/IN2对挑取的单菌落进行PCR。由于引物对IN1/IN2位于ofs基因内部(产物大小为915 bp),如果ofs基因被Spc抗性基因所置换,那么PCR扩增会得到阴性结果,反之则说明ofs基因未被敲掉。通过这种方法进行初步筛选。在一组菌液PCR扩增中,IN1/IN2引物扩增结果(图4)中3泳道为阴性,选择该株做进一步验证。
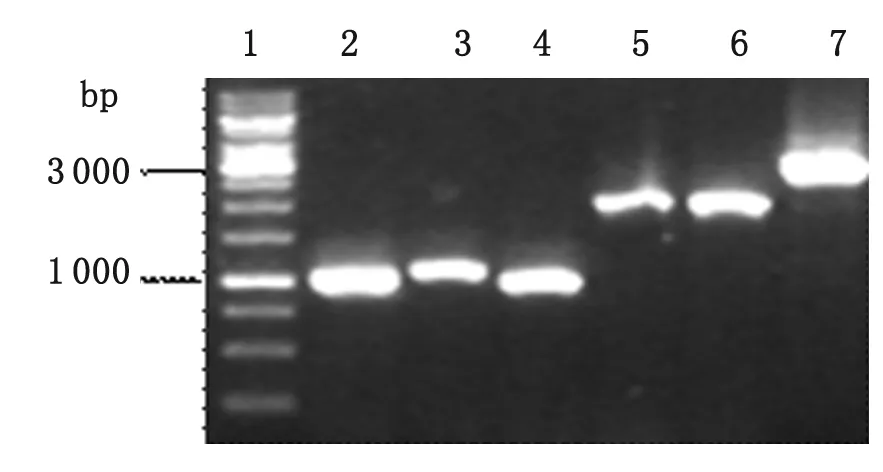
图2PCR扩增产物凝胶电泳
Fig.2GelelectrophoresisofPCRproduct
1: 1 kb DNA ladder marker; 2: PCR products with LA1/LA2; 3: PCR products with Spc1/Spc2; 4: PCR products with RA1/RA2; 5: PCR products with LA1/Spc2; 6: PCR products with Spc1/RA2; 7: PCR products with LA1/RA2.

图3pUC18-LSR双酶切鉴定
Fig.3RestrictionenzymedigestionoftherecombinantplasmidpUC18-LSR
1: 1 kb DNA ladder; 2: Digested byEcoR I andBamH I; 3: Digested byBamH I andSalI; 4: Digested bySalI andSphI; 5: Digested byEcoR I andSalI; 6: Digested byBamH I andSphI; 7: Digested byEcoR I andSphI.

图4PCR鉴定
Fig.4PCRanalysis
1: 1 kb DNA ladder marker; 2-9: Mutant strains; 10: Positive control (DNA of 05ZYH33);11: Negative control (sterile water).
2.305ZYH33ofs基因敲除突变株的组合PCR鉴定 根据05ZYH33 基因组DNA序列,分别于ofs编码基因上下游的外侧设计两条引物OUT1(位于LA上游)和OUT2(位于RA下游),引物位置如图5A所示。ofs基因敲除突变株用引物对OUT1/Spc2、Spc1/OUT2和Spc1/2经PCR扩出大小分别为2 225 bp、2 246 bp和1 130 bp的片段,而在野生菌株05ZYH33中则未见相应片段,以野生株05ZYH33基因组为模版,用引物IN1/IN2能扩出的915 bp的片段,在突变株中未能扩出相应片段。组合PCR的结果(图5B)与以上理论完全一致。同时,用引物对OUT-1 /OUT-2 扩增的PCR 产物(图5C)进行克隆和测序,测序结果亦证明所获得的菌株已经成功发生双向同源重组。
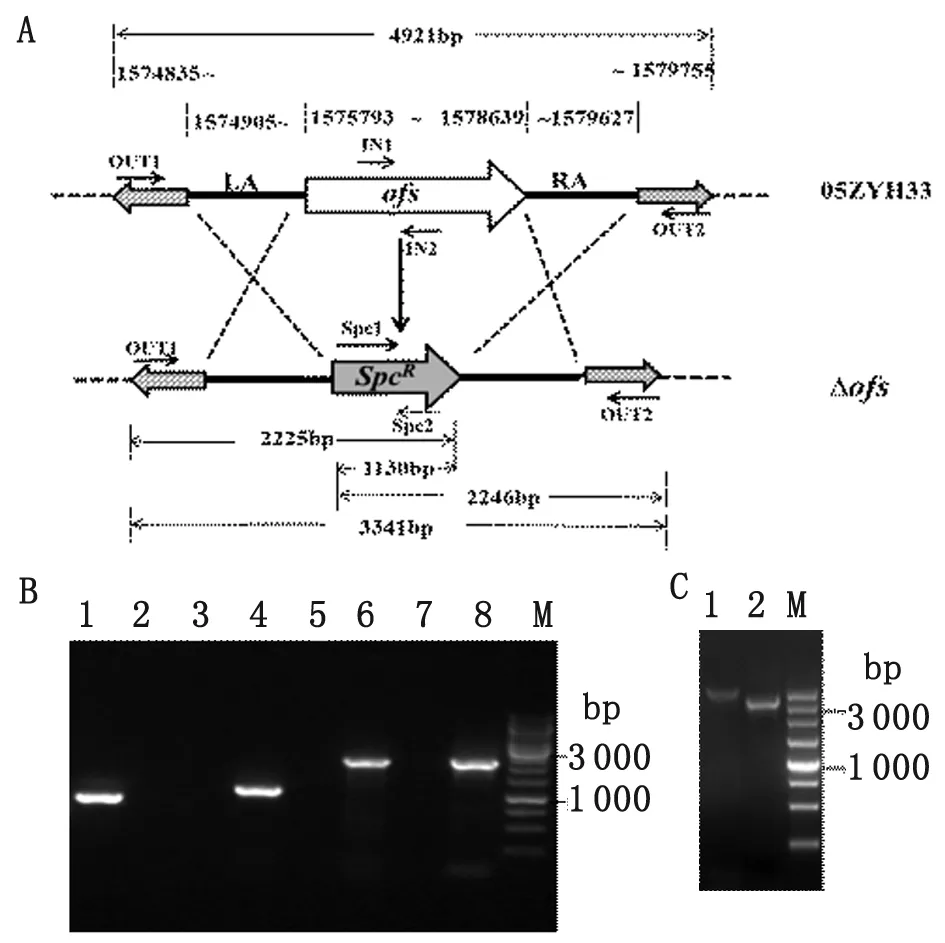
图5组合PCR鉴定
Fig.5Multiple-PCRanalysis
A: Primers design;
B: IN1/IN2: 1--05ZYH33, 2--Δofs; Spc1/Spc2:
3--05ZYH33, 4--Δofs; OUT1/Spc2: 5--05ZYH33,
6--Δofs; Spc1/OUT2: 7--05ZYH33, 8--Δofs;
C: OUT-1 /OUT-2: 1--05ZYH33, 2--Δofs.
2.405ZYH33ofs基因敲除突变株的Southern鉴定 通过Southern杂交对Δofs基因组上的突变基因进行定位分析。使用ofs基因中间片段(引物IN1/IN2的PCR产物)作为标记探针,用随机引物法进行生物素标记,参照试剂盒说明书进行操作。杂交结果如图 6B所示,基因敲除载体pUC18-LSR 与细菌的染色体重组后可能出现3种情况(如图6A所示),3种情况下杂交带的大小有所不同。在野生株05ZYH33基因组酶切产物中,出现了一条约4.5 kb的ScaI单酶切片段,与预计酶切片段4.5 kb(等位基因置换)大小相符(图6B,泳道1),而在突变株中未出现条带(图6B,泳道2),说明SpcR基因已经通过双交换同源重组置换了ofs编码基因(图6A-I)。在mutant1基因组酶切产物中,出现了一条大约7.2 kb的ofs探针杂交带,说明mutant1只是发生了5′端同源序列单交换的突变株(图 6B,泳道 3)。结果充分证实ofs基因在基因水平已被成功敲除。

Fig图6A同源重组示意图
FigFig.6AHomologousrecombinationschematicdiagram
Ⅰ: Double cross-over; Ⅱ: 5′ single cross-over; Ⅲ: 3′ single cross-over.

图6B突变株Δofs的Southern杂交分析
Fig.6BSouthernhybridizationanalysisofmutantΔofs
1: 05ZYH33 genome/ScaI; 2: Δofsgenome/ScaI; 3: Mutant1 genome/ScaI.
2.5革兰氏染色分析 取生长至OD600≈0.6的突变株△ofs和野毒株05ZYH33进行革兰染色,显微镜下观察发现(图7),二者均为典型的革兰阳性菌,菌体形态为圆形或椭圆形,呈链状排列,呈短链状排列,无明显差异。

图7 革兰氏染色分析
2.6菌落形态和溶血活性的比较 将野生株05ZYH33和突变株△ofs接种于羊血THB 平板并于37℃孵育48 h 后,可见二者均长出灰白色、圆形半透明、湿润、表面光滑的细小菌落(直径为1~2 mm),菌落周围有明显的β-溶血环 (图8)。表明与野生株相比,突变株的菌落形态和溶血活性没有发生明显的变化。

图8 溶血活性分析
2.7细菌生长特性比较 在相同的培养条件下绘制野生株与突变株的的生长曲线(图9),从图中可以看出,突变株和野生株的生长速率相近,于接种后3 h左右进入对数生长期,约在培养10 h后进入平台期,并无显著差别。
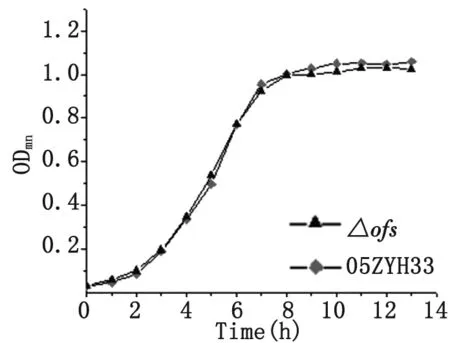
图9 生长特性比较
2.8小鼠致病性实验 观察结果显示,攻毒16 h后野生株注射组死亡9只,突变株死亡5只。24 h后野生株注射组小鼠全部死亡,突变株4只存活。36 h后突变株3只存活。阴性对照组10只状态均良好。持续观察3 d,未见发病和异常情况发生。用Kaplan-Meier生存函数分析方法比较突变株与野生组小鼠的存活率,并绘制生存曲线(图10),P<0.05,说明ofs基因敲除使得05ZYH33的毒力减弱。

图10小鼠生存曲线
Fig.10SurvivalcurvesforBABL/cmiceinfectionexperiments
3 讨 论
猪链球菌血清浑浊因子OFS是新近鉴定的猪链球菌中的一种毒力因子。Baums等[10]研究表明OFS具有革兰氏阳性细菌表面蛋白的典型特征:N-末端的信号肽,大的N-末端区域,重复序列和C-末端的LPXTG锚定位点。本研究前期通过生物信息学分析发现,S.suis2 05ZYH33 中存在ofs编码基因[11]。通过比较OFS与S.pyogenes的SOF及S.dysgalactiae的FnBA的序列,发现OFS与SOF及FnBA在序列上有同源性,推测它们在功能上也有相似性。它们属于一类称作微生物表面识别粘附基质分子的组分(microbial surface components recognizing adhesive matrix molecules,MSCRAMMs)的细菌表面配基。广泛存在于哺乳动物的组织液、基质或细胞的外表面,是化脓性链球菌、停乳链球菌黏附和定植到宿主细胞表面的主要介质,因此这些蛋白是链球菌入侵的重要毒力因子[16]。
在S.pyogenes中通过插入失活构建的sof突变株对小鼠的致病能力降低,在人全血中的存活率也降低[17]。用重组的SOF能够起到免疫保护作用,揭示SOF是一种重要的毒力因子[18]。以猪为模型的动物实验也证实ofs的缺失导致2型猪链球菌毒力的降低[10]。对于猪链球菌毒力因子的研究一直是热点,荚膜多糖CPS为S.suis2 中目前唯一明确的毒力因子。然而并不是所有有荚膜的2型猪链球菌菌株都有致病性。不同的菌株间毒力上存在着差异[19-20]。
实验室前期基于基因敲除技术,致力于探索研究新的致病相关基因的功能及其在S.suis与宿主相互作用中发挥的作用,构建了多个S.suis2毒力相关因子突变株,对它们的致病力强弱及致病机制进行了相关研究,为深入探讨猪链球菌2型致病机制积累了丰富的数据资料。本研究根据同源重组原理构建了中国强毒株05ZYH33ofs基因全长敲除突变株,并通过组合PCR、Southern杂交和DNA测序对敲除突变株进行了鉴定。通过一些生物学特性比较显示, Δofs基因突变株和野生株05ZYH33在成链形态及链长短、溶血活性、生长特性方面均无明显差异。小鼠毒力实验表明ofs基因缺失株的毒力较野生株明显降低,与前述报道的结果相似。由此可见,OFS是中国强毒株05ZYH33的一个潜在毒力因子。在此基础上我们还将进一步研究△ofs突变株与野生株在粘附和抗细胞吞噬方面的差异,以期阐明ofs基因在猪链球菌2型05ZYH33强致病过程中的作用机制。
参考文献:
[1]Staats JJ, Feder I, Okwumabua O, et al.Streptococcussuis: past and present[J]. Vet Res Commun, 1997, 21(6): 381-407. DOI: 10.1023/A:1005870317757
[2]Lun ZR, Wang QP, Chen XG, et al.Streptococcussuis: an emerging zoonotic pathogen[J]. Lancet Infect Dis, 2007, 7(3): 201-209.
[3]Smith HE, Damman M, van der Velde J, et al. Identification and characterization of the cps locus ofStreptococcussuisserotype 2: the capsule protects against phagocytosis and is an important virulence factor[J]. Infect Immun, 1999, 67(4): 1750-1756.
[4]Staats JJ, Planner BL, Stewart GC, et al. Presence of the Streptococcus suis suilysin gene and expression of MRP and EF correlates with high virulence inStreptococcussuistype 2 isolates[J]. Vet Microbiol, 1999, 70(3/4): 201-211. DOI: 10.1016/S0378-1135(99)00147-9
[5]Lun S, Perez Casal J, Connor W, et al. Role of suilysin in pathogenesis ofStreptococcussuiscapsular serotype 2[J]. Microb Pathog, 2003, 34(1): 27-37. DOI: 10.1016/S0882-4010(02)00192-4
[6]Zhao HM, Pan XZ, Wang CJ, et al. Cloning, expression and identification of gene encoding the glutamate dehydrogenase ofStreptococcussuisserotype 2[J]. Chin J Zoonoses, 2006, 22(1): 25-28. (in Chinese)
赵华梅, 潘秀珍, 王长军, 等. 猪链球菌2型谷氨酸脱氢酶基因的克隆表达及酶活性测定[J]. 中国人兽共患病学报, 2006, 22(1): 25-28.
[7]Feng Y, Pan X, Sun W, et al.Streptococcussuisenolase functions as a protective antigen displayed on bacterial cell surface[J]. Infect Dis, 2009, 200(10): 1583-1592. DOI: 10.1086/644602
[8]Ge J, Feng Y, Ji H, et al. Inactivation of dipeptidyl peptidase IV attenuates the virulence ofStreptococcussuisserotype 2 that causes streptococcal toxic shock syndrome[J]. Curr Microbiol, 2009, 59(3): 248-255. DOI: 10.1007/s00284-009-9425-8
[9]Shao Z, Pan X, Li X, et al. HtpS, a novel immunogenic cell surface-exposed protein ofStreptococcussuis, confers protection in mice[J]. FEMS Microbiol Lett, 2011, 314(2): 174-182. DOI: 10.1111/j.1574-6968
[10]Baums CG, Kaim U, Fulde M, et al. Identification of a novel virulence determinant with serum opacification activity inStreptococcussuis[J]. Infect Immun, 2006, 74 (11): 6154-6162. DOI: 10.1128/IAI.00359-06
[11]Shi PJ, Hao XN, Ge JC, et al. Deletion of the N-terminal fragment of ofs gene inStreptococcussuisserotype 2 Chinese highly virulent strain 05ZYH33[J]. J Nanjing Norm Univ:Nat Sci Ed, 2009, 32(2): 87-92. (in Chinese)
史沛举,郝喜娜,葛俊超,等. 2型猪链球菌中国强毒株05ZYH33 ofs N-片段基因敲除株的构建[J]. 南京师大学报:自然科学版), 2009,32(2):87-92.
[12]Smith HE, Wisselink HJ, Vecht U, et al. High efficiency transformation and gene inactivation and gene inactivation inStreptococcussuistype 2[J]. Microbiology, 1995, 141(Pt 1): 181-188. DOI: 10.1099/00221287-141-1-181
[13]Chen HN, Liao H, Wang CJ, et al.Construction andinvitroassay of the sortase BCD geneknock-out mutant ofStreptococcussuis2[J]. Acta Microbiol Sin, 2011, 51(3):386-392. (in Chinese)
陈红娜,廖辉,王长军,等. 猪链球菌2型分选酶srtBCD 基因敲除株的构建及其生物学特性分析[J].微生物学报,2011,51(3):386-392.
[14]Tang J, Wang C, Feng Y, et al. Streptococcal toxic shock syndrome caused bystreptococcussuisserotype 2[J]. PLoS Med, 2006, 3(5): e151. DOI: 10.1371/journal.pmed.0030151
[15]Hu D, Shi J, Zhu J, et al. A BALB/c mouse model ofStreptococcussuis2 infection[J]. J Pathog Biol, 2012, 7(8): 561-564. (in Chinese)
胡丹,石洁,朱静,等.猪链球菌2 型BALB/c 小鼠动物感染模型的建立[J].中国病原生物学杂志,2012,7(8):561-564.
[16]Courtney HS, Hasty DL, Dale JB. Molecular mechanisms of adhesion, colonization, and invasion of group A streptococci[J]. Ann Med,2002,34(2):77-87.DOI:10.1080/07853890252953464
[17]Courtney HS, Hasty DL, Li Y, et al. Serum opacity factor is a major fibronectin-binding protein and a virulence determinant of M type 2Streptococcuspyogenes[J]. Mol Microbiol, 1999, 32(1): 89-98. DOI: 10.1046/j.1365-2958.1999.01328.x
[18]Courtney HS, Hasty DL, Dale JB. Anti-phagocytic mechanisms ofStreptococcuspyogenes: Binding of fibrinogen to M-related protein[J]. Mol Microbiol, 2006, 59: 936-947. DOI: 10.1111/j.1365-2958.2005.04977.x
[19]Vecht U, Arends JP, van der Molen EJ, et al. Differences in virulence between two strains ofStreptococcussuistype II after experimentally induced infection of newborn germ-free pigs[J]. Am J Vet Res, 1989, 50(7): 1037-1043.
[20]Vecht U, Wisselink HJ, van Dijk JE, et al. Virulence ofStreptococcussuistype 2 strains in newborn germfree pigs depends on phenotype[J]. Infect Immun, 1992, 60(2): 550-556.

