肿瘤标志物ProGRP助力小细胞肺癌的临床决策
支修益
1 前言
20世纪90年代以后,随着人类基因组测序和蛋白组学快速发展,新的肿瘤标志物(tumor markers,TM)不断出现,小细胞肺癌(small cell lung cancer,SCLC)的生物标志物胃泌素释放肽前体(ProGRP)就是其中一个。1983年胃泌素释放肽(GRP)被发现存在于SCLC中,此后GRP逐渐发展成为SCLC的肿瘤标志物。SCLC患者往往存在高水平GRP的表达和分泌,通过血清或血浆样本检测其前体ProGRP,可反映GRP的水平。
国外多项研究,如Pierre-Jean Lamy等人针对标志物ProGRP、NSE、CGA在SCLC中的敏感性进行的对比研究[1],以及Refael Molina等人评估ProGRP、CEA、SCC、CYFRA21-1、NSE在SCLC患者中特异性的对比研究[2]等均证明ProGRP是SCLC的重要标志物,对SCLC具有较好的敏感性和特异性。后者的研究同时还证明了ProGRP联合NSE诊断SCLC可显著提高特异性。
作为SCLC的生物标志物,ProGRP在国外已得到广泛应用,如:日本早已将ProGRP列为常规体检项目,以实现SCLC的早诊早治。美国临床生物化学学会(NACB)在《肺癌肿瘤标志物临床应用指南与推荐》(简称《指南》)中推荐ProGRP用于SCLC的鉴别诊断、术后监测、以及晚期SCLC化疗的监测和早期复发的监测[3]。2013年,采用电化学发光法的Elecsys ProGRP检测在欧盟批准上市,预计将于2014年在中国上市。
2 ProGRP:SCLC诊断的重要标志物
就目前的检测手段而言,CT检查对SCLC并无筛查获益。影像学手段很难发现小的、散在的SCLC肿瘤病灶。活检虽然可以确诊SCLC,但由于致死性、不稳定的临床状况,以及非局限性的肿瘤、错误的活检等因素的影响,并非所有患者均可进行活检。肿瘤标志物检测作为组织病理和影像学检查的有力补充,能为肺癌患者管理提供重要的参考价值。
临床常用的肺癌肿瘤标志物包括:CEA(癌胚抗原)、CYFRA21-1(细胞角蛋白19的可溶性片段)、SCC(鳞状细胞癌抗原)、NSE(神经元特异性烯醇化酶)和ProGRP(胃泌素释放肽前体)。其中,CEA主要应用于腺癌和大细胞癌,CYERA21-1主要用于腺癌和鳞癌,SCC主要用于鳞癌,NSE和ProGRP都是用于SCLC的特异性标志物。
作为SCLC重要的肿瘤标志物之一,NSE存在着诸多局限性:对早期局限期SCLC敏感性低;在其他恶性肿瘤患者中也可出现NSE值异常升高;不能使用血浆进行检测,因为红细胞和血小板含有NSE,溶血样本容易出现假阳性等。
胃泌素释放肽(GRP)属于胃肠激素,主要刺激胃的G细胞分泌胃泌素,参与平滑肌细胞的收缩,促进细胞间的相互作用。SCLC患者往往存在高水平GRP的表达和分泌,但GRP半衰期只有2分钟[4],稳定性差,难以检测。作为GRP的前体,ProGRP的半衰期更长、更稳定,可通过血清或血浆样本检测,反映GRP的水平。ProGRP在正常上皮中不表达或表达非常低,在良性肺疾病和上皮来源的肿瘤中有低水平的表达。研究表明,如设定ProGRP的判断界值(cut off)>50 pg/ml,对包括肺癌、乳腺癌、结直肠癌、肝癌在内的多种实体瘤进行ProGRP的检测,显示ProGRP在SCLC患者中检出率为73%[2],远远高于在其他肿瘤内的表达,证明其对SCLC有较好的特异性。
在一项对比研究[5]中,评估ProGRP和SCC、NSE、CEA、CYFRA21-1、CA125对SCLC(175例)和NSCLC(472例)的鉴别诊断价值,发现单一标志物ProGRP对SCLC诊断的敏感性最高,可达76.6%。SCC、ProGRP、NSE三者联合检测对SCLC的诊断敏感性为79.5%,特异性为99.6%。
3 ProGRP帮助SCLC的治疗监测及预后评估
在临床上,ProGRP还能用于监测SCLC治疗效果、复发和预后情况。作为复发监测敏感性最高的肿瘤标志物(敏感性为74%),在SCLC治疗过程中,ProGRP下降水平与治疗疗效呈正相关。ProGRP水平明显降低,提示治疗效果好;ProGRP水平保持稳定或显著升高,提示治疗无效或预示肺癌复发,这时可考虑更换治疗方案。同时,作为肺癌预后评估的重要指标,ProGRP水平与SCLC生存预后相关,治疗前ProGRP水平升高是生存不佳的独立预后因子,建议使用ProGRP对SCLC高危患者进行密切监测[6]。
对于不同组织学类型的肺癌在治疗各个阶段对肿瘤标志物的选择,NACB(National Academy of Clinical Biochemistry)在《指南》中给出了明确的建议:对于缺少组织学结果的非手术患者,当NSE和ProGRP水平升高,提示SCLC;在治疗后和随访阶段检测NSE和(或)ProGRP,从而实现对SCLC更好的管理(见下表)。
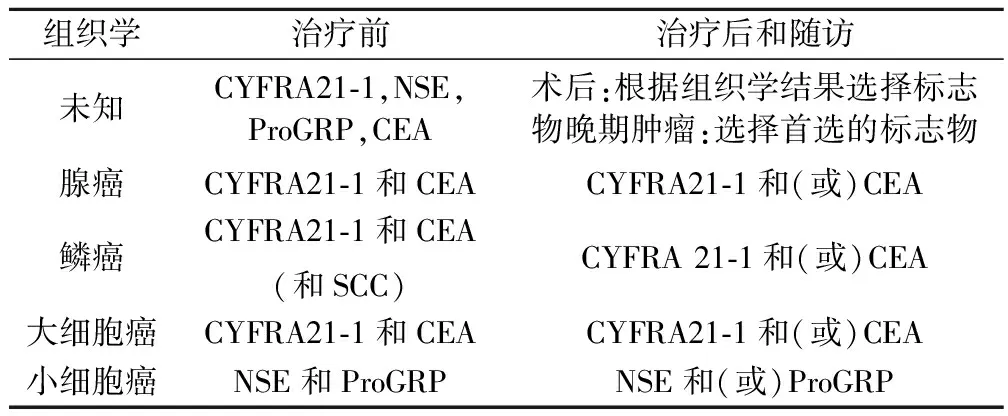
表1 NACB《指南》推荐使用的肿瘤标志物
来自法国、德国、西班牙和中国(首都医科大学宣武宣武医院及北京协和医院)的6家医学中心联合开展了一项ProGRP多中心评估研究,旨在建立欧洲人和中国人表观健康人群的参考值。该研究发现,ProGRP在良性肺部疾病与SCLC的水平分布存在显著差异,可用于SCLC的早期诊断,其鉴别诊断性能优于NSE,联合NSE可以提升SCLC的诊断价值。该研究采用了罗氏诊断Elecsys ProGRP检测,该检测的抗体设计采用针对ProGRP第48-52个氨基酸和第57-61个氨基酸的单克隆抗体,避开了凝血酶酶切位点,因此可以采用血清和血浆样本进行检测。
参考文献:
[1] Pierre L,Jean G,Andrew K,et al.Pro-gastrin-releasing peptide, neuron specific enolase and chromogranin A as serum markers of small cell lung cancer[J].Lung Cancer,2000,29:197-203.
[2] Molina R,Auge JM,Filella X,et al.Pro-gastrin-releasing peptide (ProGRP) in patients with benign and malignant diseases:comparison with CEA,SCC,CYFRA 21-1 and NSE in patients with lung cancer[J].Anticancer Research,2005,25(3A):1773-1778.
[3] Petra S,Rudolf H,Stefan H,et al.National academy of clinical biochemistry guidelines and recommendations for use of tumor markers in lung cancer.(Section 3P)[EB/OL].http://www.aacc.org/SiteCollectionDocuments/NACB/LMPG/tumor/chp3p_lung.pdf.
[4] Ischia J,Patel O,Shulkes A,et al.Gastrin-releasing peptide:Different forms,different functions[J].Biofactors,2009,35(1):69-75.
[5] Molina R,Augé JM,Bosch X,et al.Usefulness of Serum Tumor Markers, Including Progastrin-Releasing Peptide,in Patients with Lung Cancer: Correlation with Histology[J].Tumour Biology,2009,30(3):121-129.
[6] Wójcik E,Kulpa JK,Sas-Korczyńska B,et al.ProGRP and NSE in therapy monitoring in patients with small cell lung cancer[J].Anticancer Research,2008,28(5):3027-3033.

