不同剂量地佐辛对气管插管下全麻手术患者脑电图波和BIS 指数的影响
蒋维维 张 野 常 江 王家友
安徽医科大学第二附属医院,安徽合肥 230601
脑电图波是大脑皮质活动状态的动态指标,是麻醉镇静深度监测中的常见指标,客观性反映麻醉药物的镇静深度。 地佐辛是混合型新型调节阿片受体制剂,通过激动κ 阿片受体产生镇痛和不同程度的镇静作用, 但可通过抑制μ 阿片受体产生抑制呼吸等副作用。研究证实:地佐辛10 mg 具有的镇静作用较轻,脑电双频指数轻度下降[1]。 但另有学者证实当地佐辛30 mg/70 kg 具有明显的呼吸抑制副作用, 但继续增加地佐辛剂量, 呼吸抑制不会明显改变;30 mg/70 kg地佐辛用量的镇痛镇静效果达到阈值且易于受具有协同作用的镇静药物拮抗[2],继续增加地佐辛剂量其镇静镇痛效果不继续增加,但对脑电图波和脑电双频指数(bispectral index,BIS)是否产生影响尚无确切定论。 BIS 是指由脑电图经精准统计分析得出的数据组,在提示大脑活动程度和反映麻醉药物手术过程中的镇静深度中具有重要意义。 κ 阿片受体激动后产生脑电图改变是药物镇静的重要机制,但关于不同剂量地佐辛对气管插管下全麻手术患者脑电图波和BIS指数的影响研究甚少,为临床麻醉用药最佳剂量提供理论依据,现报道如下:
1 资料与方法
1.1 一般资料
选取2013 年1 月~2014 年1 月安徽医科大学第二附属医院手术室气管插管下全麻手术患者69 例,纳入标准: 全部患者符合美国麻醉医师协会(ASA)Ⅰ~Ⅱ级、年龄<65 岁,体重指数(BMI)<27 kg/m2,具有气管插管适应证患者,全部纳入病例经医院伦理学委员会批准。排除标准:长期使用镇静类药物、长期饮酒吸烟、肝肾功能不全、心血管疾病、吸毒史、气管插管禁忌证和精神性疾病史的患者。 全部患者知情同意,按住院号及地佐辛不同剂量将患者分为低剂量组(n = 21)、中剂量组(n = 25)和高剂量组(n = 23)。 低剂量组21 例,男11 例,女10 例;年龄24~59 岁,平均(37.22±11.01)岁;体重51~74 kg,平均(67.42±3.64)kg;平均BMI(24.96±3.65)kg/m2;其中呼吸系统手术7例,心血管手术6 例,消化系统手术6 例,其他手术2 例。 中剂量组25 例,男14 例,女11 例;年龄25~61岁,平均(37.33±11.07)岁;体重52~74 kg,平均(67.47±3.71)kg;平均BMI(24.62±3.21)kg/m2;其中呼吸系统手术8 例,心血管手术7 例,消化系统手术6 例,其他手术4 例。 高剂量组23 例,男11 例,女12 例;年龄25~76 岁,平均(38.01±11.09)岁;体重52~76 kg,平均(68.02±3.88)kg,平均BMI(24.86±3.41)kg/m2;其中呼吸系统手术7 例,心血管手术7 例,消化系统手术6例,其他手术3 例。三组间患者性别、年龄、体重、BMI、手术种类等一般资料比较差异无统计学意义(P >0.05),具有可比性。
1.2 麻醉方法
全部患者术前均未使用镇静类药物,进入手术室后即刻连接菲利普PM50 无创生命监测仪,持续监测手术过程中平均动脉压(mean arterial pressure,MAP),血氧饱和度(arterial oxygen saturation,SaO2),建立静脉血管通道,静脉输注林格液10 mL/(kg·h),监测并记录有创动脉压(invasive blood pressure tachycardia,IBP)、全身麻醉诱导术前基础值(base values,BV),连接BIS 监测仪(PM099628,菲利普)持续监测术中BIS的变化,采用气管插管下全身麻醉方法,麻醉诱导前5 min 给予不同剂量地佐辛, 地佐辛经生理盐水稀释至5 mL 后输注,其中低剂量组患者0.05 mg/kg,中剂量组患者0.1 mg/kg 和高剂量组患者0.2 mg/kg,全部患者诱导麻醉使用芬太尼3 μg/kg、 异丙酚2 mg/kg、罗库溴铵0.6 mg/kg, 维持患者呼吸率(respiratory rate,RR)12 次/min,潮气量8~12 mL/kg、呼气末二氧化碳分压4.65~5.98 kPa, 气管插管后5 min 无任何手术操作, 当收缩压(systolic blood pressure,SBP)<90 mm Hg (1 mm Hg=0.133 kPa),MAP<60 mm Hg 时, 根据SBP、MAP 值, 给予麻黄碱5~10 mg,MAP 降低超于术前基础值20%时,根据MAP 值,适当给予麻黄碱5~10 mg,当心率(heart rate,HR)<60次/min 时,给予阿托品,SaO2<90%时,给予调整机械性辅助呼吸参数值。
1.3 观察指标
比较两组患者气管插管即刻(T0)、气管插管后2 min(T1)、注入地佐辛后2 min(T2)的脑电图(EGoC)分级、αβ 波相对功率值(αβ%)、Narcotrend 麻醉深度指数(NT 指数)、BIS 的差异。
EGoC 分级:严密监测手术过程中的脑电图αβ波,Ⅰ级为重度异常,出现连续性脑电图异常棘波;Ⅱ级为中度异常,阵发性脑电图异常棘波;Ⅲ级为轻度异常,出现偶发性脑电图异常棘波;Ⅳ级为正常脑电图异常棘波。
1.4 统计学方法
研究数据采用SPSS 18.0 统计软件进行分析,多组间的计量资料采用F 检验,进一步组间比较采用Q检验,用均数±标准差()表示,多组间的计数资料采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 三组间患者EGoC 分级比较
高剂量组脑电图分级异常率明显高于低剂量组和中剂量组,组间比较差异有统计学意义(P <0.05),低剂量组和中剂量组比较差异无统计学意义(P >0.05)。见表1。
2.2 三组间患者各时间段αβ%、NT 指数、BIS 指数比较
用药2 min 后, 高剂量组患者αβ%明显降低,明显低于低剂量组和中剂量组,组间比较差异有统计学意义(P <0.05),且较插管前和插管后2 min 明显降低(P <0.05),差异有统计学意义(P <0.05),而低剂量组和中剂量组比较差异无统计学意义 (P >0.05),见表2;用药2 min 后,高剂量组NT 指数明显低于低剂量组和中剂量组,差异有统计学意义(P <0.05),中剂量组NT 指数明显低于低剂量组,差异有统计学意义(P <0.05),NT 指数由大至小为低剂量组>中剂量组>高剂量组, 用药2 min 后高剂量组和中剂量组患者较插管前和插管后2 min 明显降低 (P <0.05),差异有统计学意义(P <0.05),而用药2 min 后低剂量组与插管前和插管后2 min 比较差异无统计学意义(P >0.05),见表3;插管2 min 和用药2 min 后,高剂量组患者BIS 指数较插管前明显降低,不同时间段比较差异有统计学意义 (P <0.05), 且高剂量组患者BIS 指数明显低于低剂量组和中剂量组,组间比较差异有统计学意义(P <0.05),用药2 min 后,全部患者BIS 指数较插管前和插管后2 min 均明显降低 (P <0.05),见表4。
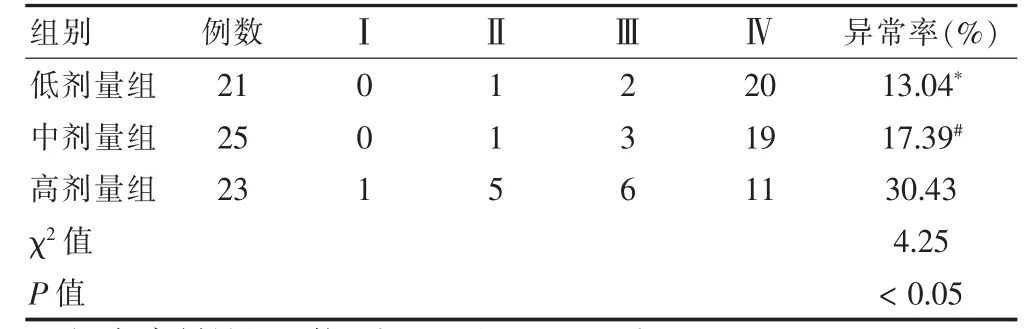
表1 三组间患者EGoC 分级比较(例)
表2 三组间患者各时间段αβ%比较()

表2 三组间患者各时间段αβ%比较()
注:与中剂量组比较,Q = 3.40,*P <0.05;与T1 比较,Q = 4.43,#P <0.05
?
表3 三组间患者各时间段NT 指数比较()
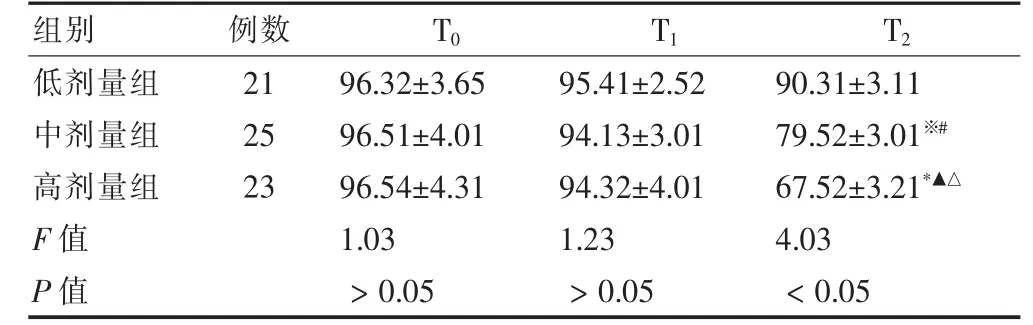
表3 三组间患者各时间段NT 指数比较()
注:与低剂量组比较,Q = 3.49,※P <0.05;Q = 3.56,*P <0.05;与中剂量组比较,Q=3.61,▲P <0.05;与T1 比较,Q=3.96,#P <0.05;Q=4.32,△P<0.05
?
3 讨论
地佐辛具有激动阿片κ 受体和抑制阿片μ 受体的双重作用,作为临床阿片类镇痛麻醉类药物,其麻醉相关性药物副作用较少[3],被广泛性应用于临床。但是, 地佐辛具有一定程度的镇静催眠的药理作用,可影响脑电波的变化。清醒患者单独给予地佐辛可明显降低该患者的BIS,影响脑电图αβ 波相对功率值。另有研究表明:麻醉药物对脑电图波和BIS 的作用大小在一定程度上与药物剂量明显相关[4]。 当剂量较小时,αβ 波的电功率均明显增加,反之,当剂量较大时,αβ波的电功率均明显降低[5]。 不同剂量地佐辛对脑电图波的改变客观反映了麻醉镇静的程度,因此,脑电图波的动态变化在麻醉镇静的监测中具有重要的临床意义。 Narcotrend 通过获取大脑皮层脑电图波形功能反映人意识状态的作用, 在临床手术麻醉过程中,通过获取和动态监测脑部生物电波形态改变在评价麻醉药物的镇静程度中具有重要意义[6]。 在药物麻醉作用下形成15 个不同级别的量化指标, 从脑电静止状态至意识清醒构成0~100 的NT 指数[7]。 但关于不同剂量地佐辛对气管插管下全麻手术患者脑电图波和BIS 的影响研究较少。
表4 三组间患者各时间段BIS 指数比较()
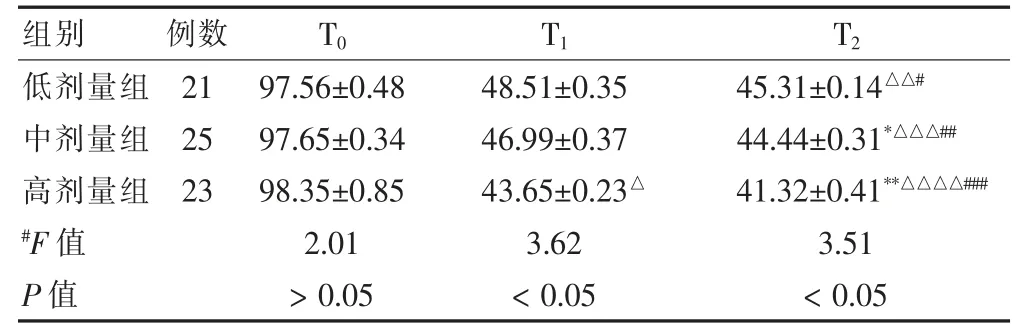
表4 三组间患者各时间段BIS 指数比较()
注: 与低剂量组比较,Q = 3.52,*P <0.05。 与中剂量组比较,Q =3.24,**P <0.05。 与T0 比较,Q = 3.18,△P <0.05;Q = 3.67,△△P <0.05;Q = 3.57,△△△P <0.05;Q = 2.94,△△△△P <0.05。与T1 比较,Q = 3.01,#P<0.05;Q = 2.85,##P <0.05;Q = 2.65,###P <0.05
?
高剂量地佐辛患者脑电图分级异常率明显高于低剂量和中剂量患者,而低剂量和中剂量患者间比较无明显差异,提示地佐辛用药剂量越大,对脑电波的影响越大;用药后2 min,高剂量患者αβ 波相对功率值明显降低,明显低于低剂量和中剂量患者,且较插管前和插管后2 min明显降低, 研究揭示了地佐辛用药剂量越大,脑电图αβ 波电功率明显降低,与文献报道相一致[8-9];NT 指数由大至小为:高剂量<中剂量<低剂量,且高剂量和中剂量患者较插管前或用药前明显降低,提示了地佐辛用药剂量越大,脑电波越趋向于脑电静止状态,其镇静程度越深,脑部意识状态越浅,插管或用药后2 min,高剂量患者BIS 指数明显降低,且明显低于低剂量组和中剂量组,且用药后2 min,全部患者BIS 指数较插管前和插管后2 min 均明显降低, 分析插管后2 min BIS 指数降低的原因可能是因为气管插管时引起血管应激性反应相关[10]。 因此,地佐辛用药剂量越大,脑电图波和BIS 指数的影响越大,镇静深度越明显,用药过程中实时监测地佐辛有助于指导麻醉剂量的临床应用。 低中剂量地佐辛对NT 指数变化产生影响, 对镇静深度程度影响意义重大,且随着剂量的继续增加,脑电图异常率明显增加,降低脑电图αβ 波电功率、NT 指数和BIS 指数, 地佐辛麻醉意外发生率明显增加[11-12]。因此,应用大剂量地佐辛和阿片类镇静镇痛药物时严密监测术中患者生命体征的改变, 尽量避免麻醉相关意外的发生风险。此外BIS 指数随着剂量增加而变化的原因主要是μ阿片受体使地佐辛镇静作用增强,BIS 值不断降低[13]。BIS 指数是麻醉深度的客观评价指标,在排除不同麻醉方式对脑电双频指数的影响作用的基础上, 监测BIS 指数在手术过程中的变化,避免导致麻醉药物用量过大导致的麻醉相关并发症发生,以免产生无可挽回的呼吸抑制现象,相关报道结果表明:地佐辛脑电图和BIS 指数的改变是κ 受体和μ 受体相结合作用的结果,κ 受体具有明显的镇静镇痛作用, 而μ 受体产生的呼吸抑制现象促进脑电波由清醒向脑电静止间的转变,表现为脑电图αβ 波电功率降低、NT 指数和BIS 指数的降低[14]。 且其麻醉剂量的增加更进一步加重了上述脑电波静止指标的加重,当剂量超于安全剂量或最大剂量时甚至出现脑电波的完全静止,严重威胁手术患者的生命健康[15]。 因此,脑电图波和BIS指数的监测在防止剂量性麻醉风险中具有重要的意义。
综上所述,0.05~0.1 mg/kg 地佐辛对气管插管下全麻手术患者脑电图波和BIS 指数影响较小,随着剂量的增加,其影响作用越明显。
[1] 周攀科,兰志勋.地佐辛用于术后镇痛的研究进展[J].实用医院临床杂志,2011,8(6):169-172.
[2] 李文成,王刚,陈解元,等.地佐辛对腰硬联合麻醉患者Narcotrend 麻醉深度指数的影响[J].实用医学杂志,2013,29(9):1503-1504.
[3] Manuel Ramirez-Ruiz,Ian Smith,White DF.Use of analgesics duringpropofolsedation:Acomparisonofketorolac,dezocine,and fentanyl[J].Journal of Clinical Anesthesia,1995,7(6):481-485.
[4] 屈军,任英,刘晖,等.不同剂量芬太尼在全身麻醉诱导中对心率变异性和脑电双频指数的影响[J].新乡医学院学报,2011,28(1):56-59.
[5] 赵艳,蒋建渝,张利萍.舒芬太尼靶控输注诱导时脑电双频指数及血流动力学的变化(前瞻性随机对照研究)[J].中国微创外科杂志,2007,7(4):323-326.
[6] 孙虎,邹田田,徐志新.不同剂量芬太尼对全麻诱导时脑电双频谱指数和异丙酚靶控输注浓度的影响[J].重庆医学,2010,39:434-437.
[7] Doi M. Monitoring of brain function [J]. Masui,2012,61(1):5-15.
[8] Jiao L,Liu RC. Effects of dezocine on PostoPerative sore throat after maxillofacial Procedures:a comparison with flurbiprofen axetil[J].Beijing Da Xue Xue Bao,2014,46(1):104-106.
[9] Liu R,Huang XP,Yeliseev A,et al.Novel molecular targets of dezocine and their clinical implications[J].Anesthesiology,2014,120(3):714-723.
[10] 杨清存,任柏林,冯艳平.不同剂量地佐辛对老年患者气管插管时应激反应的影响[J].中国医药,2013,8(5):669-671.
[11] 刘剑,宋学敏,杨卫兵,等.地佐辛对腰硬联合麻醉患者脑电双频谱指数的影响[J].武汉大学学报:医学版,2012,33(6):893-895.
[12] Negus SS,Brandt MR,Gatch MB,et al. Effects of heroin and its metabolites on schedule-controlled responding and thermal nociception in rhesus monkeys:sensitivity to anta gonism by quadazocine,naltrindole and-funaltrexamine [J].Drug and Alcohol Dependence,2003,70(1):17-27.
[13] Yaomin Zhu,Guixia Jing,Wei Yuan. Preoperative admini stration of intramuscular dezocine reduces postoperative pain for laparoscopic cholecystectomy [J]. Journal of Biomedical Research,2011,25(5):356-361.
[14] Ann Locniskar,Greenblatt DJ.Determination of cira madol and dezocine,two new analgesics,by high-perfor mance liquid chromatography using electrochemical detection[J].Journal of Chromatography B:Biomedical Sciences and Applications,1986,374(12):215-220.
[15] Liang ZH,Liang SJ,Wang YH,et al.Tracking the coupling of two electroencephalogram series in the isoflurane and remifentanil anesthesia[J].Clinical Neurophysiology,2014,63(28):178-189.

