改良XELOX 方案治疗胃肠道腺癌伴肝转移的临床研究
李 慧 江 旭 杨朝爱 王卫星 陈文会 刘敬禹 马 青 杨继金
第二军医大学附属长海医院介入科,上海 200433
胃癌肝转移是胃癌进展到晚期发生的不良事件,亦是胃癌治疗失败的重要原因之一,大多数胃癌肝转移患者失去手术根治机会,5 年生存率低于10%[1]。 而肝脏恰恰也是结直肠癌转移的最常见部位,15%~25%的结直肠癌患者在首次就诊时伴发肝转移,其中绝大多数(80%~90%)的肝转移灶(colorectal liver metastases,CLM)无法获得根治性切除,总体均预后不良[2]。对于失去手术机会肝转移患者,静脉化疗是主要的治疗方法,但总体来看,全身静脉化疗疗效欠佳,尚未有统一或标准的治疗方案。 基于肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)在治疗原发性肝细胞癌(HCC)取得了令人满意的疗效,对于胃癌、结直肠癌肝转移的治疗很自然地就采用了TACE 的方法。 但多采用团注法,疗效有限。 即使是赵明等[3]采用皮下埋泵间断灌注奥沙利铂然后较长时间灌注5-氟尿嘧啶(5-FU)的方法治疗CLM,客观有效率达到了90%以上,亦或是宗登伟等[4]采用TACE 治疗胃癌肝转移,药物采用奥沙利铂+5-FU(2 h 泵入奥沙利铂,5-FU 加入葡萄糖44 h 泵入),均因需要灌注时间长,临床应用上受到一定的限制。 基于此,本研究组对XELOX 方案进行了改良,取得了良好效果,本文即对改良XELOX 方案治疗胃癌、结直肠癌肝转移的有效性和安全性进行了探讨。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2006 年7 月31 日~2013 年1 月10日于上海市长海医院介入科收治的的胃癌、结直肠癌伴肝转移未行原发灶根治术并采用改良XELOX 方案化疗30 例患者的临床资料。 其中男20 例(67%),女10 例(33%),年龄40~79 岁。30 例患者中原发灶为胃的15 例,其中胃窦部5 例,贲门部4 例,胃体部4 例,胃角1 例,胃小弯1 例;结肠13 例,直肠2 例,病理类型均为腺癌,共行TACE 术196 次,次数最多者为9 次。TACE 术前1 例曾行基因治疗,TACE 术期间1 例出现胸1 转移、脑转移,1 例出现肺转移,TACE 术后2 例行原发灶切除术。 病例随访至2013 年11 月,观察终点为患者死亡或到截止时间的生存状态,所有病例随访时间均≥10 个月。 入选标准:①原发灶经病理活检、胃镜、结肠镜证实为胃癌或结直肠癌,肝转移灶可通过活检病理、CT 和/或MRI、实验室指标等确诊;②接受了至少2 个疗程改良XELOX 方案治疗;③体力状况评分≤2 分;④白细胞(WBC)≥3.5×109/L,血小板≥50×109/L,胆红素<正常值上限1.5 倍,丙氨酸氨基转移酶(ALT)<正常值上限3 倍,肌酐<120 μmol/L,凝白酶原时间(PT)延长<4 s;⑤无严重基础疾病;心、肝、肾等重要脏器及骨髓造血功能基本正常;⑥每2 个疗程定期随访,经CT 和(或)MRI、PET-CT 等至少有一处可测量病灶。
1.2 治疗方法
所有患者均采用改良XELOX 方案, 即将奥沙利铂50 mg 灌注至原发灶,结直肠癌的系经肠系膜下动脉或者髂内动脉,胃癌系经胃左动脉或腹腔干,然后经肝动脉向肝内灌注50 mg 奥沙利铂与适量的碘油混合进行化疗栓塞,最后留置导管于腹腔干或肝固有、肝左、肝右动脉缓慢(1 h)灌注100 mg 奥沙利铂,第1 天;1 周后(或10 d 后,具体情况根据患者血常规而定)服用卡培他滨,第8~21 天,休息2~3 周进行下一疗程,6 个疗程后治疗间隔时间可适当延长至8~12 周。每2 个月通过CT 和(或)MRI 检查肝内转移灶,胃镜、肠镜检查原发灶。 直至疾病进展或出现不可耐受的不良反应或患者拒绝再使用。每2 个疗程评价客观疗效,至少使用4 个疗程。记录无进展生存期(PFS)、总生存期(OS),随访时间截止于2013 年12 月30 日。治疗过程中评价有效者,如果情况允许,考虑采取再次手术根治或局部病灶射频等治疗。
1.3 疗效、不良反应评价
采用实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)评价疗效:完全缓解(CR)指所有靶病灶消失,无新病灶出现并且维持至少4 周以上;部分缓解(PR)指靶病灶长径总和缩小≥30%,至少维持4 周;病变进展(PD)指靶病灶长径总和增加≥20%或出现新病灶;疾病稳定(SD)指靶病灶最大径之和缩小<30%,或增大未达PD。 总有效率(RR)=CR+PR。 PFS 定义为自患者开始改良XELOX方案一线用药至进展或死亡的时间;删失数据定义为病历记录中未登记进展或死亡日期的患者。
WHO 规定, 药品不良反应是指合格药品在正常的用法和用量下出现的与治疗目的无关的有害反应。综合WHO 规定的抗癌药物常见不良反应分级标准及参考我国国家食品药品监督管理总局的不良反应标准分级,制订相关不良反应标准,具体见表1。

表1 不良反应标准
对于表1 中未涉及的临床异常情况,按照下列标准对不良反应进行强度分级评估:
Ⅰ级(轻度)短时间的不适(<48 h),无需医疗;Ⅱ级(中度)轻度到中度限制日常活动,不需要或只需要少量的医疗干预;Ⅲ级(重度)显著地限制日常活动,需要日常生活照顾,需要医疗,可能需要住院;Ⅳ级(危及生命)极度限制日常活动,显著地需要日常生活照顾,需要医疗和住院。
1.4 统计学方法
运用SPSS 19.0 统计软件进行统计分析,采用Kaplan-Meier 法(乘积极限法)进行分析,对可能影响生存时间的多种因素进行Cox 比例风险回归模型分析,以P <0.05 作为有统计学意义。
2 结果
2.1 临床疗效
30 例患者均可评价疗效,共行196 次TACE 术。OS 为12.0 个月,95%CI 9.6~14.4,CR 2 例,PR 10 例,SD 8 例,PD 10 例,RR 为40.0%,中位PFS 为4.0 个月,95%CI 2.2~5.8。 15 例胃癌伴肝转移患 者OS 为12.0 个月,95%CI 9.7~14.3,中位PFS 为4.0 个月,95%CI 2.4~5.3;15 例结直肠癌伴肝转移患者OS 为12.0 个月,95%CI 7.7~16.3,中位PFS 为6.0 个月,95%CI 2.1~9.9。 见图1~2。
典型病例:某患者,女,58 岁,2009 年9 月病理检查为升结肠腺癌伴肠系膜、腹膜后、肝门淋巴结及肝脏转移,PET-CT 显示肝内病灶呈高代谢(见图3 A)。接受5 个疗程的改良XELOX 方案后,2011 年5 月复查,肝内病灶明显缩小、无活性,其余病灶消失(见图3B),肠镜显示升结肠原病变处瘢痕,根据RECIST 评价达到CR。

图1 总生存期生存函数图
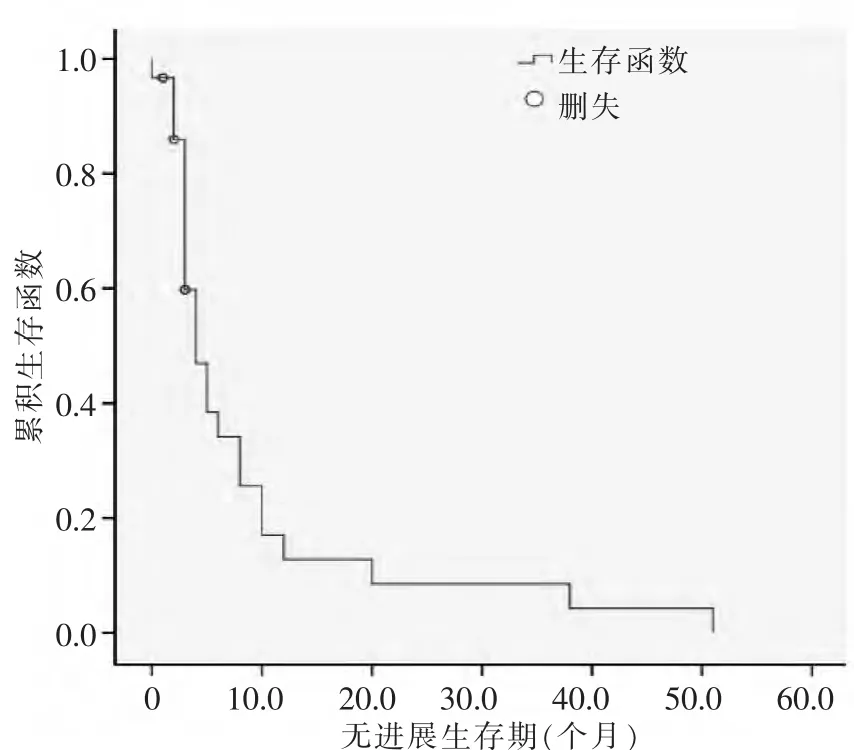
图2 无疾病进展期生存函数图

图3 升结肠腺癌PET-CT 图像
2.2 药物不良反应统计
治疗后不良反应主要为恶心、呕吐、疼痛、肝功能受损、骨髓抑制、外周感觉神经毒性等,多为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级不良反应少见,经对症处理后好转,无治疗相关性死亡。其中恶心、呕吐有23 例,仅有1 例为Ⅲ级,其次为肝功能异常,如ALT 及AST 升高,但仅局限于TACE 治疗后4~5 d;再次为骨髓抑制,主要为白细胞、血小板减少。 见表2。
2.3 生存时间的影响因素分析
通过对30 例经改良XELOX 方案治疗的胃肠道腺癌肝转移患者的OS 的Cox 回归模型进行单因素分析,患者性别(P =0.226)、年龄(P =0.425)、肿瘤原发部位(P总=0.462)3 个变量对OS 无统计学意义(P >0.05),即患者的性别、年龄、肿瘤原发部位的不同不影响改良XELOX 方案的疗效。

表2 改良XELOX 方案治疗胃癌、结直肠癌伴肝转移的不良反应(例)
3 讨论
胃癌在全球虽呈下降趋势,但其发病率仍位于常见恶性肿瘤的第4 位,病死率为第2 位[5]。无论早期或进展期胃癌均可发生肝转移,并多伴有腹膜、淋巴结转移。 肝转移灶常为多发或累及双叶,适合行肝切除者少,手术切除率仅0.4%~10%,术后5 年生存率不足10%,结果不令人满意[6]。结直肠癌肝转移的手术切除率亦不高[7-8],仅有15%~20%结直肠癌肝转移患者确诊时适合于手术切除。全身静脉化疗已成为治疗胃癌、结直肠癌肝转移的主要治疗方案。 2012 年版NCCN指南提出进展期胃癌术前推荐的化疗方案为ECF(表阿霉素、顺铂、氟尿嘧啶)及改良ECF 方案,然而REAL-2试验结果[9]证实,应用优化的奥沙利铂替代顺铂,用卡培他滨替代5-FU 持续泵入的EOX 方案(表阿霉素+奥沙利铂+卡培他滨) 替代ECF 方案可以作为晚期胃癌的标准方案。 根据张瑞雪等[10]报道,在中国人群中,临床上常见的胃癌患者多为中老年人,且不同程度存在着心血管问题。 而表阿霉素的心脏毒性、骨髓抑制、胃肠道毒性很大[11]。 对于局部晚期或转移性胃癌患者XELOX 方案较之FOLFOXs(5-氟尿嘧啶+亚叶酸钙+奥沙利铂)方案的疗效确切,并且不良反应的发生率更低,尤其对于中老年患者是一种更为优化的选择。 奥沙利铂与卡培他滨有明显的协同作用,两者联用可明显提高晚期结直肠癌的疗效。因此XELOX 已成为治疗结直肠癌肝转移的一线全身静脉化疗方案。 但总体来看,静脉化疗效果不佳,有研究认为,转移性肝癌未经治疗其中位生存期为5.5 个月左右, 全身静脉化疗的中位生存期为8.4 个月左右,介入治疗的中位生存期为12.1 个月,因此介入疗法是目前治疗转移性肝癌的有效方法[12]。
随着TACE 术在治疗原发性肝癌中发挥着越来越重要的作用,并且多项研究指出,对于不具备外科切除指征的肝转移患者,亦可行介入治疗并可以作为多学科综合治疗的重要手段[13]。 但关于胃癌肝转移行介入术的报道较少。由于胃癌肝转移的瘤体由肝动脉和门静脉双重供血,提高肝动脉和门静脉的药物浓度可最大程度地杀灭癌细胞。胃癌经胃动脉灌注化疗后药物经门静脉回流至肝脏,提高了化疗药物的利用率,经胃动脉和肝动脉化疗灌注能最大程度地发挥抗癌作用。理论上经导管肝动脉灌注药物直接到达肝脏肿瘤区域,根据药物运行第一循环的首效应原则,肿瘤区域的化疗药物浓度可高于全身400 倍以上,与静脉给药相比药物效价可提高10~30 倍[14],由于进入外周血中的药物浓度相对较低,极大地减少了不良反应。
本研究中30 例胃肠道腺癌伴肝转移患者的OS为12.0 个月,95%CI 9.6~14.4,RR 为40.0%,中位PFS为4.0 个月95%CI 2.2~5.8。 15 例胃癌伴肝转移患者OS 为12.0 个月,95%CI 9.7~14.3, 中位PFS 为4.0 个月,95%CI 2.4~5.3;15 例结直肠癌伴肝转移患者OS为12.0 个月,95%CI 7.7~16.3, 中位PFS 为6.0 个月,95%CI 2.1~9.9。 与Kunieda 等[15]曾经报道的胃癌肝转移原发灶未切除、行全身化疗的中位生存期为6 个月及Fong 等[16]、Scheele 等[17]报道的不可切除结直肠癌肝转移的中位生存期仅为4~6 个月均有提高。抗癌药物经静脉达靶器官时,有相当数量的药物与血浆蛋白结合,具有生物活性的游离药物量减少,使药效降低,这也就是全身静脉化疗治疗胃癌肝转移效果欠佳的原因。 另外传统的静脉化疗毒副反应较大,患者多难以耐受,而本研究中不良反应轻,基本都小于Ⅱ级,患者可耐受,无肠梗阻发生。 而改良XELOX 方案是经动脉将奥沙利铂注入靶病灶内,提高了局部药物浓度,药效增强。 TACE 后留置动脉导管给药1 h 的方式,兼顾了奥沙利铂的时间依赖性特点,延长了在肝脏的作用时间,使其在肿瘤组织内缓慢释放,局部保持高浓度,进一步增加了化疗效果。 与传统化疗泵常规的48 h 相比,大大缩短了时间,减少了一系列并发症的发生,如局部组织疼痛、红肿、静脉留置针折叠、堵塞、温度变化、化疗泵相对位置改变影响药液输入速度[18]。 并且动脉比静脉用药更具有靶向性,增加了病灶局部药物浓度,患者耐受性提高,极大的增强了疗效。术后口服卡陪他滨在局部治疗肝脏的同时亦可同时兼顾原发胃、结直肠病灶,使得患者的总生存期有所延长。
综上所述,改良XELOX 方案治疗胃肠道腺癌伴肝转移效果确切,不良反应可以耐受。 改良XELOX方案可作为治疗晚期不可切除胃肠道腺癌伴肝转移的一线治疗方案,值得临床推广与应用。
[1] Liu J,Chen L. Current status and progress in gastric cancer with metastases [J]. Chin Med J (Engl),2011,124(3):445-456.
[2] Aruu M,Aldrighetti L,Castoldi R,et al. Analysis of prognostic factors influencing long-term survival after hepatic resection for metastatic colorectal cancer [J]. World J Surg,2008,32(1):93-103.
[3] 赵明,潘长穿,李旺,等.肝动脉灌注氟尿苷优化结直肠癌肝转移患者的化疗方案的探索性研究[J].中山大学学报:医学科学版,2011,32(3):348-354 .
[4] 宗登伟,郭晨阳,黎海亮,等.肝动脉化疗栓塞加灌注治疗胃癌肝转移疗效评价[J].河北医药,2011,33(15):2301-2303.
[5] Van Cutsem E. The treatment of advanced gastric cancer:new findings on the activity of the taxanes [J]. The Oncologist,2004,9(12):9.
[6] Hironori T,Takashi I,Satoshi O,et al. Outcomes for patients following hepatic resection of metastatic tumors from gastric cancer [J]. Hepatic Int,2010,4(1):406-413.
[7] Dawood O,Mahadevan A,Goodman KA. Stereotaetic body radiation therapy for liver metastases [J]. Eur J Cancer,2009,45(17):2947-2959.
[8] 王旻,王爽,金洪永,等.直肠癌同时性肝转移的外科治疗[J].临床肝胆病杂志,2012,28(1):17-20.
[9] Schmoll HJ,Cartwright T,Tabernero J,et al. Phase Ⅲtrial of capecitabine plus oxaliplatin as adjuvant therapy for stage Ⅲcolon cancer:a planned safety analysis in 1864 patients [J]. J Clin Oncol,2007,25:102-109.
[10] 张瑞雪,闫涵,王民,等.XELOX 方案与FOLFOXs 方案治疗中国晚期胃癌患者的Meta 分析[J].首都医科大学学报,2013,34(3):422-427.
[11] 郑琳,黎海亮,郭晨阳,等.FOLFOX 方案肝动脉化疗栓塞并留管灌注联合替吉奥治疗胃癌术后肝转移的临床疗效评价[J].疑难病杂志,2013,12(2):117-119
[12] 熊壮,王建华,颜志平,等.胃肠道肿瘤肝转移介入治疗的临床研究[J].中国医学计算机成像杂志,2007,13(2):120-123.
[13] Schildberg CW,Croner R,Merkel S,et al. Outcome of operative therapy of hepatic metastatic stomach carcinoma:a retrospective analysis[J].World J Surg,2012,36:872-878.
[14] 关素安,杨江萍,张哲,等.消化道肿瘤肝转移瘤介入治疗的规范性研究[J].中国医药导刊,2008,10(6):832-834.
[15] Kunieda K,Saji S,Sugiyama S,et al. Evaluation of treatment for synchronous hepatic metastases from gastric cancer with special reference to long-term survivors [J].Surg Today,2002,32(7):587-593.
[16] Fong Y,Cohen AM,Fortner JG,et al.Liver resection for colorectal metastases[J].J Clin Oncol,1997,15(3):938-946.
[17] Scheele J,Altendorf-Hofmann A.Resection of colorectal liver metastases[J].Langenbecks Arch Surg,1999,384(4):313-327.
[18] 张燕,陈友燕,黄蓓. PICC 置管接化疗泵用于老年晚期肿瘤患者持续化疗的护理[J].当代医学,2012,18(4):130-131.

