GC-MS法分析有氧和充氮加热条件下吉马酮和莪术二酮的化学变化
宋 珅, 崔小兵, 陈建伟, 刘 晓
(南京中医药大学中药学一级学科,江苏 南京 210023)
温郁金CurcumawenyujinY.H. Chen et C. Ling 主产于浙江省,为姜科Zingiberaceae姜黄属Curcuma植物,是常用中药材莪术的来源之一[1]。中医认为莪术具有行气破血、消积止痛的功能,主治癥瘕痞块、瘀血经闭、食积胀痛以及早期宫颈癌。温郁金每年冬至前后采收,为了防止药材在贮藏中出现发霉、腐烂的现象,温郁金都要在产地经过蒸或煮至透心再晾干[2]。根据挥发油的性质,在这样的加工、贮藏过程中的温郁金的挥发油类成分定会受到影响,研究表明鲜品温郁金(即未经加工的药材)中的莪术二酮和吉马酮的量明显高于加工温莪术及贮藏一年的陈品温莪术[3-4]。吉马酮[5]、莪术二酮[6]均为倍半萜类物质,吉马酮熔点为56~57 ℃,莪术二酮熔点为61.5~62 ℃,均为熔点较低的化合物。已经有报道证明:吉马酮具有抗肿瘤作用[7],且在高温条件下能转变为β-榄烯酮[8]。莪术二酮具有抗血栓形成作用和抗凝血作用[9],可以抑制Caco-2细胞的CYP3A4酶[10],微生物转化方面的研究已表明利用黑曲霉素(Aspergillusniger)[11-12]及刺囊毛霉(Mucorspinosus)[13]可以使莪术二酮羟基化或环氧化,雅致小克银汉霉(Cunninghamella elegans AS3.2028)可使莪术二酮的十碳环外碳碳双键发生环氧化[14]。但在加工贮藏中吉马酮与莪术二酮的化学变化目前未见报道。由于气相色谱与质谱联用结合了色谱与质谱的优点,既发挥色谱法的高分离能力,又发挥了质谱法的高鉴别能力[15],且适合挥发性成分的鉴别。为探究这两种成分在温莪术加工、贮藏中含有量下降的原因,本实验通过人工模拟温郁金的加工过程,使用GC-MS技术检测过程中莪术二酮和吉马酮的变化。研究表明在人工模拟温莪术的加工过程中,莪术二酮表现出较好的稳定性,而吉马酮表现为易分解,易被氧化。由此证明温莪术在加工、贮藏中的化学成分变化并不完全是由于化学成分的挥发,还有可能是因为其在加工贮藏过程中性质不稳定发生化学变化而导致的,且莪术挥发油的主要成分在加工、贮藏过程中会出现相互转化的现象。该研究为探析温莪术在加工、贮藏中的化学成分变化规律提供了理论论据。
1 仪器与试药
Agilent6890/5975B型气-质联用分析仪,G1701DAD.03.00.611工作站,NIST05标准质谱检索库; BT125电子天平(赛多利斯科学仪器有限公司);EPED超纯水系统(南京易普达易科技发展有限公司);恒温水浴箱( HH-S 金坛市医疗仪器厂)。
吉马酮(批号20110924,纯度98%)、莪术二酮(批号20110611,纯度98%)均购自上海源叶生物科技有限公司。乙腈为色谱纯(美国Merck公司),甲醇为色谱纯(上海凌峰化学试剂有限公司), 超纯水(自制),其余试剂均为分析纯。
2 方法
2.1 GC-MS检测条件 HP-5MS色谱柱(0.25 mm×30 m, 0.25 μm),载气为氦气,电离方式EI,离子源温度200 ℃,电子能量70 eV,接口温度250 ℃,发射电流150 μA,质量范围35~455 aum,扫描周期0.4 s。数据处理系统Xcalibur1.2,图谱库NIST05。程序升温:启始温度140 ℃,保持3 min;然后以2 ℃/min升温至180 ℃,再以4 ℃/min升至260 ℃后,保持5 min。柱压53 kPa,体积流量1.0 mL/min;进样量0.2 μL;分流比20∶1。
2.2 对照品溶液的制备 精密称取吉马酮1.23 mg,莪术二酮1.52 mg,分别置1 mL量瓶中加甲醇溶解、定容,用0.22 μm微孔滤膜滤过,即得。
2.3 样品溶液的制备
2.3.1 充氮保护下样品溶液的制备 精密称取吉马酮1.45 mg,莪术二酮1.64 mg,分别置于安瓿瓶中,充氮后封口,吉马酮放于100 ℃水浴锅中加热2 h,再放在40 ℃水浴锅中加热30 h,取出。莪术二酮放于100 ℃水浴锅中加热10 h,再放在40 ℃水浴锅中加热40 h,取出打开安瓿瓶,加甲醇溶解分解物,将溶液移入1 mL量瓶中定容,用0.22 μm微孔滤膜滤过,即得。
2.3.2 有氧情况下样品溶液的制备 精密称取吉马酮1.23 mg,莪术二酮1.17 mg,分别置于安砵瓶中,封口,放于100 ℃水浴锅中加热10 h,再放在40 ℃水浴锅中加热18 h,取出。打开安砵瓶,加甲醇溶解分解物,将溶液移入1 mL量瓶中定容,用0.22 μm微孔滤膜滤过,即得。
3 结果
吉马酮对照品,充氮保护后的分解产物、有氧条件下的分解产物的GC-MS总离子流图(TIC)见图1,莪术二酮对照品、充氮保护后的分解产物、有氧条件下的分解产物的GC-MS总离子流图(TIC)见图2,通过GC-MS分析,检索NISTVersion 1.7图谱库,并结合有关文献的谱图解析,以质谱离子峰面积归一化法测得每个检出成分的相对百分含有量,见表1、表2。
4 讨论与小结

图1 吉马酮对照品(a)、充氮保护后的分解产物(b)、有氧条件下的分解产物(c)GC-MS图谱
经GC-MS的图谱鉴定,对照品吉马酮的峰出现在20 min左右,充氮保护下吉马酮被部分保留下来,相对含量为41.69%,还有一部分吉马酮产生了相对含量为12.38%的2,3-二氢-2,2,5,6-4甲基香豆酮及相对含量为12.04%的顺式-2,7-单二烯等物质。其中2,3-二氢-2,2,5,6-4甲基香豆酮在加工后的温莪术挥发油中可被检测出来[4]。有氧条件下吉马酮被破坏的较剧烈在GC-MS条件下完全检测不到,且被氧化:出现了相对含量为28.47% 的1,6-二甲基-9-(1-甲基亚乙基)-5,12-双氧三环[9.1.0.0(4,6)]烷-9-酮,相对含量为18.91%的3,4-二氢-4,4,5,7,8-五甲基-6-香豆素醇,相对含量为14.39%的7-环己基-2,3-二氢-2-甲基-香豆酮等物质。吉马酮经GC-MS测定的化合物在有氧和无氧条件下共有20种,在充氮保护的条件下,吉马酮产生15个成分,而在有氧条件下,吉马酮产生7个化学成分,其中共有成分仅有3种,说明吉马酮性质不稳定,容易发生化学变化。可见吉马酮在有氧和缺氧的条件下,发生化学变化产生的化学成分差异很大。根据这部分实验可以推测:在缺氧条件下,即温莪术药材内部吉马酮易被保留,而与氧气接触的药材表面吉马酮易被分解。
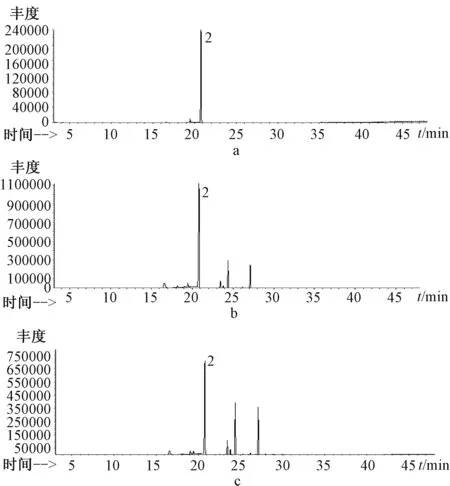
图2 莪术二酮对照品(a)、充氮保护后的分解产物(b)、有氧条件下的分解产物(c)GC-MS图谱

表1 经GC-MS检测在有氧及无氧条件下吉马酮的分解物

表2 经GC-MS检测在有氧及无氧条件下莪术二酮的分解物
莪术二酮经GC-MS测定的化合物在有氧和无氧条件下共有8种。其中莪术二酮在充氮保护下相对百分含有量为64.15%,有氧条件下相对含量为46.43%,并且莪术二酮在充氮保护下产生了新莪术二酮,在有氧条件下产生了γ-榄香烯,可见温莪术中挥发性物质在加工及贮藏条件下可互相转化。莪术二酮在充氮保护及有氧条件下均产生了:环己烷,1-乙基-2-丙基十四烯(充氮保护相对含量为13.31%及有氧条件下为22.76%),3,7-二甲基-6-辛烯醛(充氮保护相对含量为10.46%及有氧条件下为19.07%)。由此可以看出,莪术二酮在充氮保护和有氧的环境中,性质都较吉马酮稳定,不易发生化学变化,在缺氧条件下即温莪术药材内部比在有氧条件下即药材表面更稳定。
通过以上实验可以观察到:吉马酮、莪术二酮化学性质不同,吉马酮易被氧化,在有氧条件下二者都会被破坏。温莪术的传统加工方法:整个煮制,可以使药材中的吉马酮和莪术二酮在缺氧的条件下得以更好的保存。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典: 2010年版一部[S].北京:中国医药科技出版社, 2010: 388.
[2] 张小平,乐 军. 片姜黄与姜黄、温莪术的区别[J]. 实用中医药杂志,2006,22(1):56-57.
[3] 宋 珅,陈建伟,姜国非.HPLC研究加工、贮藏过程对温郁金中化学成分的影响[J].中国实验方剂学杂志,2011,24(17):61-64.
[4] 宋 珅,陈建伟,贡 磊.加工、贮藏过程对温郁金挥发油的体外抗肿瘤作用及其成分的影响初步研究[J].中成药,2012,34(2):324-328.
[5] Robert P , Rruth L, Bjorn F H. Germacrone, a sesquiterpene repellent to obscure root weevil fromRhododendronedgeworthii[J].Phytochemistry,1980,19(11) :2379-2380.
[6] Hikino H, Sakurai Y, Takahashi H,etal. Structure of curdione[J].ChemPharmBull, 1967,15(9):1390-1394.
[7] Liu Y, Wang W, Fang B,etal. Anti-tumor effect of germacrone on human hepatoma cell lines through inducing G2/M cell cycle arrest and promoting appotosis[J].EuroJPharmaco,2013,698(1):95-102.
[8] 成晓静,刘华刚,廖月英,等.三种莪术不同部位挥发油成分比较[J].中药材,2009,32(10):1551-1553.
[9] 王 秀.莪术二酮抗血栓和抗血小板聚集作用研究[D].合肥:安徽医科大学,2012:4.
[10] Hou X L, Hayashi-Nakamura E, Takatani-Nakase T,etal.Curdione plays an important role in the inhibitory effect ofCurcumaaromaticaon CYP3A4 in Caco-2 cells[J].EvidBasedComplementAlternatMed,2011,2011: ArticleID913898.
[11] Horiike T, Ohshiro M, Kuroyanagi M. Biotransformation of the germacrane type sesquiterpene curdione by suspension cultured cells ofLonicerajaponica[J].Phytochemistry,1997,44(4):627-632.
[12] Asakawa Y, Takahashi H, Toyota M. Biotransformation of monoterpenoids, (-)- and menthols, terpinolene and carvotanacetone byAspergillusspecies[J].Phytochemistry, 1991, 30(12): 3981-3987.
[13] Ma X C, Ye M, Wu L J,etal. Microbial transformation of curdione byMucorspinosus[J].EnzymeMicrobTechnol,2006,38(3/4):367-371.
[14] Zhou L N, Xu W Z, Chen Y N,etal. Stereoselective epoxidation of curcumol and curdione byCunninghamellaelegansAS3.2028[J].CatalCommun,2012,28:191-195.
[15] 刘腾飞,谢修庆,刘文婷.气相色谱及气质联用在农药残留分析中的应用[J].现代农业科技,2010(3) : 179-181.