赤眼鳟Mx基因全长cDNA克隆及其经GCRV攻毒后的组织表达分析
彭慧珍刘 敏刘巧林肖调义苏建明许宝红刘宇洁
赤眼鳟Mx基因全长cDNA克隆及其经GCRV攻毒后的组织表达分析
彭慧珍1*刘 敏1*刘巧林1肖调义1苏建明2许宝红1刘宇洁1
(1. 湖南农业大学水生生物学实验室, 长沙 410128; 2. 湖南农业大学动物医学院, 长沙 410128)
为研究赤眼鳟(Squaliobarbus curriculus)Mx蛋白(Myxovirus resistance protein)的功能, 采用简并PCR和SMART RACE方法从赤眼鳟脾脏中克隆得到Mx基因全长cDNA, 并通过生物信息学方法分析其同源性,再利用实时荧光定量PCR (RT-qPCR)检测其在脾、肝、肠、肾等9个组织中的表达, 以及感染草鱼呼肠孤病毒(Reovirus of Grass carp) GCRV-104后不同时间点赤眼鳟Mx的时空表达规律。结果表明: 赤眼鳟Mx基因cDNA序列(ScMx)全长2325 bp, 包含5′-UTR 40 bp, 3′-UTR 371 bp和ORF 1884 bp, 共编码627个氨基酸, 其编码的Mx蛋白分子量约为70.9 kD, 理论等电点 pI 为 8.25, 具有脊椎动物Mx蛋白共有的结构特征; 赤眼鳟Mx与鲫鱼Mx3同源性最高; Mx在赤眼鳟脾、肝、肠、肾等9个组织中均有表达, 其中肝脏中的相对表达量最高, 脾脏次之, 肠组织中的表达量最低; 经GCRV-104病毒感染刺激后, ScMx在肝和脾组织中的表达量显著上调, 均在48h到达峰值, 分别为对照组的10倍(肝)和5倍(脾), 且在这两个组织中的表达模式相似,均表现为先升高后下降的波动型变化趋势。研究表明ScMx参与了赤眼鳟抗GCRV-104病毒的免疫反应。
赤眼鳟; Mx基因; 全长cDNA; 组织表达
Mx蛋白(Myxovirus resistance protein)最早于1962年在近交小鼠系 A2G的研究中发现并命名。1988年, Meier等在大鼠中发现有 3个不同的分型Mx1、Mx2、Mx3[1]。随后在人、猪、马、牛、羊、鸡、鸭、鱼等其他物种中也陆续发现了Mx蛋白的存在[2]。Mx蛋白是一类由干扰素诱导产生的 GTP酶活性蛋白, 大多被认为具有广谱抗病毒功能。对多种RNA病毒和DNA病毒有抑制作用。
鱼类的Mx蛋白被认为具有部分抗病毒活性。大西洋鲑(Salmo salar) Mx1蛋白被证实对传染性胰坏死病毒(Infectious pancreatic necrosis virus genus, IPNV)有明显的抑制作用[3]。Robertsen用抑制性消减cDNA文库的方法发现出血性败血症病毒(Viral Hemorrhagic Septicemia Virus, VHSV)能诱导分离自虹鳟(Oncorhynchus mykiss)的白细胞中Mx和其他免疫球蛋白的表达[4]。但也有研究表明大西洋鲑的Mx1对贫血病毒(Infectious Salmon Anaemia Virus, ISAV) 7i 编码的蛋白没有抑制作用[5]。
近年来, 研究者已在多种鱼类上发现了Mx蛋白,如草鱼(Ctenopharyngodon idella)[6]、鳜(Siniperca chuasti)[7]、石斑鱼(Epinephelus coioides)[8]、虹鳟[9]、斑点叉尾(Ictalurus punctatus)[10]、大西洋鲑[11]、稀有鲫(Gobiocypris rarus)[12]、鲫(Carassius auratus)[13]、尖吻鲈(Lates calcarifer)[14]等。
赤眼鳟(Squaliobarbus curriculus)作为一种优质的淡水经济鱼类, 在养殖过程中表现出较强的适应性和抗病力, 但对其免疫方面的研究却鲜有报道[15],更未见赤眼鳟 Mx基因的相关报道。本研究以赤眼鳟为研究对象, 克隆其Mx基因的cDNA全长, 并对该基因在赤眼鳟中的组织表达规律及经草鱼呼肠孤病毒(Reovirus of grass carp) GCRV-104感染刺激后赤眼鳟肝脏和脾脏组织中 ScMx的表达模式进行了探讨, 为进一步研究赤眼鳟 Mx蛋白的功能和其他后续研究奠定基础。
1 材料与方法
1.1 材料
实验用赤眼鳟为湖南农业大学水产基地养殖的1+龄鱼, 体重为(90±10) g。运回实验室后, 置于室内水族箱中暂养一星期后, 挑选健康的赤眼鳟作为实验材料。
GCRV-104由中国水产科学研究院长江水产研究所提供, 草鱼肾脏组织细胞CIK培养下病毒滴度经测定为TCID50=108.710。
1.2 方法
总RNA提取 采集的组织在液氮下研磨成粉末状, 加入 RNAiso Plus试剂(TaKaRa)按操作说明提取组织的总 RNA。1%的琼脂糖凝胶电泳和核酸蛋白仪检测总RNA的质量和浓度。RNA样品置于–80℃保存备用。
cDNA模板合成 用于片段扩增的cDNA模板(普通cDNA模板)按照BioTeke superRTKit (Bio-Teke)合成备用; 5′-RACE Ready cDNA和3′-RACE Ready cDNA的制备根据 SMARTTMRACE cDNA Amplification Kit (Clontech)的操作要求合成备用;荧光定量(Real-Time PCR)用 cDNA 模板使用PrimeScriptTMRT reagent Kit with gDNA Eraser (Ta-KaRa)合成备用。
RT-PCR扩增及ScMx序列分析 所有引物均在上海生工合成(表1)。通过比对已知鱼类的Mx基因序列, 找到其相对保守序列, 并根据保守区序列设计一对Mx片段1扩增引物MxF和MxR。再以片段1及与其同源性最高的鲫鱼和稀有鲫的3′端保守区域设计两条特异性引物3S1和3S2及一条简并引物3R扩增出Mx基因片段2。最后基于两段片段的拼接结果分别设计5′端特异性引物(5W和5N)和3′端特异性引物(3W和3N)用于RACE-PCR。Mx片段1和Mx片段2均用健康赤眼鳟脾脏的cDNA模板扩增。Mx片段1 PCR反应体系如下: 10×Ex PCR buffer 2.5 μL, dNTP Mixture 2.0 μL, MxF2 (10 μmol/L) 1.0 μL, MxR2 (10 μmol/L) 1.0 μL, cDNA 2 μL, Ex Taq DNA Polymerase (5 U/μL) 0.5 μL, 加 H2O补充体积至25 μL。反应条件为: 94℃预变性5min; 94 ℃30s, 58 ℃ 40s, 72 ℃ 2min, 35个循环; 72℃延伸7min。Mx片段2采用巢式PCR反应扩增, 反应体系如下: 10×Ex PCR buffer 2.5 μL, dNTP Mixture 2.0 μL, 3S1 (10 μmol/L) 1.0 μL, 3R (10 μmol/L) 1.0 μL, cDNA 2 μL, Ex Taq DNA Polymerase (5 U/μL) 0.5 μL, 加ddH2O补充至25 μL。第一轮反应条件为: 94℃预变性5min; 94 ℃ 30s, 55 ℃ 40s, 72 ℃ 2min, 35个循环; 72℃延伸7min。第二轮PCR以第一轮PCR产物稀释100倍后取1 μL为模板, 将3S1引物替换为3S2, 其他条件同第一轮扩增。5′RACE和3′RACE扩增分别以 5′-RACE Ready cDNA和 3′-RACE Ready cDNA为模板, 实验流程参照 SMARTTMRACE试剂盒进行。此外, 我们也进行了赤眼鳟Mx ORF序列的验证, 以赤眼鳟脾脏cDNA为模板, 用引物ScMxORF3和ScMxORF4进行PCR, 扩增了包含ScMx ORF的cDNA序列, 产物测序后与拼接序列完全相同。
Real-Time PCR 表达分析 用 Real-Time PCR检测赤眼鳟 ScMx的组织表达及经 GCRV-104病毒感染刺激后赤眼鳟肝脏和脾脏组织的免疫应答。对于组织表达实验, 随机取 4条鱼, 分别提取脾、肝、肠、肾、头肾、心、脑、鳃和肌肉9个组织的总RNA并按上述步骤获得cDNA模板; 对于GCRV-104病毒刺激实验, 设置实验组和对照组, 试验时水温为 28—30℃。实验组每尾鱼注射 0.2 mL GCRV-104病毒液, 对照组每尾鱼注射等体积的PBS缓冲液。在0、6、12、24、48、72、96、120h 8个时间点分别取四条鱼的肝脏和脾脏组织, 并按上述步骤制备其cDNA模板。根据ScMx的全长序列设计Real-Time PCR引物QT-MxF和QT-MxR, 并设计β-actin引物作为内参, Real-Time PCR反应在iCycler iQTM5荧光定量 PCR 仪上进行。根据TransStartTMTop Green qPCR SuperMix (全式金)试剂盒说明书进行荧光定量PCR反应。反应体系为25 μL, 包含12.5 μL的2×TransStartTMTop Green qPCR SuperMix, 0.5 μL的Passive Reference Dye Ⅲ , 1 μL模板, 0.6 μL的引物 (10 μmol/L) 和10.4 μL的灭菌双蒸水。每个样品设置三个重复, 以蒸馏水代替模板作为阴性对照。反应程序参照试剂盒说明书,退火温度为61 ℃ , 用2–△△Ct法分析其相对表达值。用SAS9.2软件对结果进行显著性分析, P<0.05表示差异显著, P<0.01表示差异极显著。

表1 本研究中所用引物的名称及序列Tab. 1 Primers used in this study
2 结果
2.1 赤眼鳟ScMx全长cDNA序列及其分析
赤眼鳟ScMx cDNA全长为2325 bp, GenBank中的序列号为 KC249972。其中包括 40 bp的5′-UTR、1884 bp的ORF和371 bp的3′-UTR, 共编码 627个氨基酸。在 PolyA上游 19 bp有典型的mRNA加尾信号“AATTAAA”。预测的Mx蛋白相对分子量为70.9 kD, 理论等电点为8.25, 为弱碱性蛋白。序列比对分析结果表明赤眼鳟 Mx基因编码区中含有一个三联体 GTP结合区域“GDQSSGKS”、“DLPG”、“TKPD”和一个发动蛋白签名序列“LPRGTGIVTR”, 以上基序在已知物种的 Mx蛋白中普遍存在。对氨基酸序列的保守结构域分析结果显示, 赤眼鳟Mx蛋白N端包含一个发动蛋白GTP酶结合区域(Dynamin, GTPase domain, 19—265aa),发动蛋白的中央核心结构域(Dynamin central domain)位于236—523aa, C端为发动蛋白的GTP酶效应结构域(Dynamin, GTPase effector domain, 538—627aa)(图1)。PSORTⅡ程序预测表明赤眼鳟Mx蛋白存在一明显的核定位信号序列NLS(PKRR, 601— 604aa)(图2)。
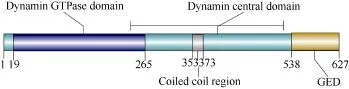
图1 Mx编码蛋白Smart功能域预测Fig. 1 The prediction of functional domains of Mx by Smart software
2.2 赤眼鳟ScMx蛋白结构预测与系统进化分析
使用SWISS-MODEL在线程序对赤眼鳟Mx的氨基酸序列进行三级结构同源建模, 参与模型构建的氨基酸范围为18—625aa, 参考模板为人MxA(基因登录号为 3szrA), 目标蛋白序列与参考模板序列比对的同源性为47.783%, 且模型评估E值为0, 说明蛋白三级模型结构可靠。用Rasmol 2.7分析软件制作其3D结构图(图3), 图A显示的是按蛋白质的N端到C端氨基酸残基依次显示为红、橙、 黄、绿、蓝; 图B中红、黄、蓝、白分别表示α螺旋、β折叠、转角和其他残基。该模型中总共包括21个α螺旋、11个 β折叠、50个转角和 420个氢键。其中ScMx的509—540位点包含3个β折叠(图3B中箭头所示)。
将推导的ScMx蛋白的氨基酸序列与其他物种的氨基酸序列在NCBI中进行BLAST同源比对, 结果表明ScMx与鲫鱼Mx3(AAP68827.1)和稀有鲫Mx(ABL61237.1)的相似性最高, 分别为 93%和90%。与其他鲤科鱼类(斑马鱼和草鱼)Mx相似率较高, 为 70%—88%。与其他物种的相似率在 50%—53%。采用Mega5.0的NJ法构建系统进化树(图4),从进化树上可看出赤眼鳟 Mx与鲫 Mx3首先聚类,再依次与鲤形目的稀有鲫、草鱼、斑马鱼的 Mx聚为一个分支 A。大西洋鲑、石斑鱼、大菱鲆、欧洲鳗鲡等鲈形目、鲱形目其他鱼类Mx聚为另外一个分支B。鸟纲的鸡、鸭Mx聚为一个分支C。哺乳类动物人和老鼠Mx聚为分支D。进化树反映的亲缘关系与物种的进化地位基本一致。
2.3 赤眼鳟ScMx组织表达特征
采用RT-qPCR分析了赤眼鳟ScMx的组织表达特征, 先对ScMx和β-actin引物的扩增效率进行了检测, 两者扩增效率基本相同, 溶解曲线为单一峰,证明所设计引物适合 2–△△Ct法分析基因相对表达量。荧光定量PCR组织表达结果(图5)显示, 赤眼鳟ScMx mRNA在脾脏、肝脏、肠、肾脏、头肾、心脏、鳃、脑和肌肉中均有表达。其中肝脏中表达量最高,脾脏中次之, 其次是心脏和鳃组织, 肠组织中最低。肝脏、脾脏、心脏和鳃组织中的相对表达量显著高于其他组织(P<0.05)。

图2 ScMx cDNA全序列及推导的氨基酸序列Fig. 2 Full-length cDNA of ScMx and its deduced amino acid sequence
2.4 GCRV病毒感染刺激后赤眼鳟ScMx的免疫应答病毒GCRV-104感染刺激后0、6h、12h、24h、48h、72h、96h、120h(同时以注射PBS后的各时间点为对照), 荧光定量 RT-PCR检测了赤眼鳟 ScMx在肝脏和脾脏中的相对表达量。结果(图6)表明: 与注射 PBS缓冲液的对照组相比, 肝脏和脾脏中的ScMx的相对表达量上调, 在两个组织中的表达模式类似, 均表现为先上升后下降的的波动型变化趋势,并在48h时达到峰值, 分别为对照组的10倍(肝)和5.5倍(脾)。肝和脾在攻毒后48h相对表达量均极显著高于其他各时间点(P<0.01)。同时, 这两个组织在攻毒后的各个时间点的相对表达量也极显著高于对照组(P<0.01)。(表2)。

图3 赤眼鳟Mx蛋白三级结构同源模型Fig. 3 The homologous model of tertiary structure of ScMx

图4 基于部分物种Mx蛋白氨基酸序列构建的NJ系统进化树Fig. 4 The NJ phylogenetic tree based on the amino acid sequences of Mx proteins of some species

图5 荧光定量PCR检测赤眼鳟ScMx mRNA组织表达Fig. 5 Expression analysis of ScMx by RT-qPCR in different tissues
3 讨论

图6 感染草鱼呼肠孤病毒后赤眼鳟Mx基因的时空表达特征Fig. 6 Expression pattern of ScMx after infected by GCRV-104

表2 肝脏和脾脏在攻毒后在不同时间点以及与对照组之间的时序表达差异Tab. 2 The expression of ScMx in the liver and spleen at each time point after GCRV-104 infection
赤眼鳟属于鲤科雅罗鱼亚科赤眼鳟属, 与同属雅罗鱼亚科的草鱼外形酷似而被称为野草鱼。近年来, 赤眼鳟作为一种优质的淡水经济鱼类, 被越来越多的研究者所关注[15]。本研究通过RACE技术克隆得到赤眼鳟Mx基因的全长cDNA序列, 荧光定量PCR分析其在人工感染草鱼呼肠孤病毒后各组织中表达量的变化规律。序列分析表明, 由赤眼鳟 Mx cDNA推导的蛋白包含N端发动蛋白GTP酶结合区域、发动蛋白的中央核心结构域和C端的发动蛋白GTP酶效应区(GTPase effector domain, GED), 是典型的发动蛋白家族成员[16]。氨基酸同源性 Blast分析表明赤眼鳟Mx与鲫鱼Mx3的相似率最高, 与其他鲤科鱼类 Mx的相似率次之, 与其他物种的相似率较低。以人、小鼠、鸡、鸭和部分鱼类 Mx构建的系统发育树与同源比对的结果相类似, 鲤科鱼类Mx聚为一支, 其他鱼类Mx聚为另一分支, 与鸡、鸭和人、鼠聚成的另外两个分支亲缘关系较远, 其结果与物种的进化地位相一致。
在人、鼠、猪、牛等哺乳动物和鸡、鸭等禽类中发现了Mx蛋白的不同亚型, 如人MxA和MxB, 大鼠Mx1、Mx2和Mx3, 小鼠Mx1和Mx2, 猪[17]对流感病毒和水泡性口炎病毒有活性的 Mx1 (76 kD)和无此活性的Mx2 (73 kD)等。鱼类Mx蛋白也有数量不等的多种亚型: 斑马鱼(Danio rerio)[18]7种; 斑点叉尾[19]5种; 虹鳟[9]、大西洋鲑[20]、金头鲷(Sparus aurata)[21]、横带石鲷(Oplegnathus fasciatus)[22]、鲫(金鱼)[13]、草鱼[23]分别有 3种; 大西洋大比目鱼(Hippoglossus hippoglossus)[24]和 大 菱 鲆 (Scophthalmus maximus)[25]中分别发现了 2种; 日本牙鲆(Paralichthys olivaceus)[26]、塞内加尔鳎(Solea senegalensis)[27]、稀有鲫[28]、鳜[7]、点带石斑鱼[8]、尖吻鲈[14]等中分别只发现1种。本研究中仅从赤眼鳟中克隆得到一种 Mx基因, 其推导的氨基酸序列与鲫Mx3和稀有鲫Mx的同源性最高。在三级结构同源建模时, Swiss-Model给出的参考序列为人MxA (3szrA), 同源性为47.783%。彭丽敏等[23]发现草鱼的Mx1、Mx2和Mx3(CiMx1、CiMx2和CiMx3)三级结构的区别仅在于氨基酸509-540位点: CiMx1为2个β折叠、CiMx2为1个α螺旋、CiMx3为2个α螺旋。本研究中的赤眼鳟Mx三级结构显示在该位点为3个β折叠(图3B中白色箭头所示), 与草鱼的三个亚型中CiMx1的结构最接近。赤眼鳟中是否和其他鱼类一样存在其他的Mx亚型有待进一步研究发现。
不同物种 Mx基因在健康个体中表达情况有所不同。肖志广等[24]发现未经干扰素诱导的ICR小鼠中, Mx1在脾、肺、肝、心、肾中均有表达, 在肌肉中不表达。Lee等[25]RT-PCR检测发现Mx主要在健康牙鲆中的肾、肠、脑、鳃、腹膜腔液等处表达, 而在血液白细胞、肝、肌肉和黏液中仅微量表达。彭丽敏等通过半定量 RT-PCR研究发现草鱼 Mx1、 Mx2、Mx3在健康草鱼的肝胰腺、脾脏、鳔、前肠、中肠、后肠、脑、血液、皮肤等15个组织中均有表达, 其中鳃和头肾中的表达量最高, 眼、肌肉和皮肤中的表达量较低。在本研究中, 荧光定量PCR结果显示 Mx基因在健康赤眼鳟的肝、脾、肠、鳃、头肾、肌肉中均有表达。其中肝和脾中表达量最高,心、鳃中次之, 肠中表达量最少。鱼类Mx能经Poly I:C、细菌和多种病毒诱导表达。南亚野鲮(Labeo rohita)经Ploy I:C诱导后, 鳃、肝、肾、肠、心、脾、皮肤和血液中 Mx基因的表达量显著提高。其中以肝组织中变化最明显(为对照组的 600倍), 其次为肾(200倍)、脾(200倍)、心(180倍)、鳃(50倍)、皮肤(50倍)和血液(40倍)。肠组织中最低, 但与对照组相比有显著地提高[26]。大黄鱼(Pseudosciaena crocea)经副溶血弧菌感染2d后头肾和血液中Mx基因表达显著高于对照组, 其他各时(4h、1d、4d、8d、12d、16d)与对照组相比无统计学差异[27]。Bravo等[28]感染诺达病毒(Nodavirus, NV)后金头鲷肝组织中 Mx基因的表达量增加。注射大菱鲆红体病虹彩病毒(Turbot Reddish Body Iridovirus, TRBIV)后, 大菱鲆Mx基因在所研究的头肾、脾脏、鳃、肌肉4个组织中均上调表达, 其组织中的最大表达量分别出现在感染后的第1、第4和第5天[29]。草鱼经GCRV感染后, 脾组织中Mx 12h时显著高于对照组, 48h时急剧下降, 72h略微上升。头肾组织中Mx 12h时显著高于对照组, 48h和72h时急剧下降。鳃组织中12h和 24h显著上调, 并且一直持续到 72h(实验结束)[23]。稀有鲫人工感染GCRV后鳃中Mx基因的表达在12h显著升高, 直到感染后140h持续保持高水平表达[12]。在本实验中, 赤眼鳟经人工感染草鱼呼肠孤病毒后, 肝和肾组织中 Mx表达量变化的趋势一致, 整体表现为先升高后下降, 在 48h出现表达量的最高峰。这一结果与尹湘艳[30]用Poly I:C感染褐牙鲆(Paralichthys olivaceus)及夏军[29]注射TRBIV至大菱鲆活体后 Mx表达量的结果相似, 不同的是出现峰值的时间不同。这可能和免疫刺激源的不同及不同物种对外界免疫应答反应速度不一有关, 具体原因有待进一步研究讨论。赤眼鳟在感染GCRV后, Mx基因是上调表达的, 说明赤眼鳟 Mx可能与赤眼鳟抗病毒途径紧密相关。这种免疫相关性与已报道研究结果是一致的[23,26—30]。而在感染后6h即迅速上调则可能预示着赤眼鳟通过Mx蛋白免疫应答病毒刺激较其他鱼类更为敏捷。以上结果表明赤眼鳟 Mx可能在赤眼鳟抗草鱼呼肠孤病毒的免疫过程中发挥了重要作用。
[1] Meier E, Fah J, Grob M S, et al. A famiIy of interferon induced MX related mRNAs encodes cytoplasmic and nuclear proteins in rat cells [J]. Journal of Virology, 1988, 62: 2386—2393
[2] Xin T T, Wang H M, He H B. Advance in the antiviral research on Mx gene [J]. China Animal Husbandry and Veterinary, 2012, 39(5): 173—175 [辛婷婷, 王洪梅, 何洪彬. Mx基因的抗病毒研究进展. 中国畜牧兽医, 2012, 39(5): 173—175]
[3] Larsen R, Rkenes T P, Robertsen B. Inhibition of infectious pancreatic necrosis virus replication by Atlantic salmon Mx1 protein [J]. Journal of Virology, 2004, 78(15): 7938—7944
[4] Robertsen B. Expression of interferon and interferon-induced genes in salmonids in response to virus infection, interferon-inducing compounds and vaccination [J]. Fish & Shellfish Immunology, 2008, 25(4): 351—357
[5] Mcbeath A J A, Collet B, Paley R, et al. Identification of an interferon antagonist protein encoded by segment 7 of infectious salmon anaemia virus [J]. Virus Research, 2006, 115(2): 176—184
[6] Liu L, Liu P, Jin J L, et al. Cloning and sequence analysis of antiviral Mx gene full-length cDNA from grass carp (Ctenopharyngodon indellus) and its eukaryotic expression vector construction [J]. Journal of Shanghai Ocean University, 2012, 21(4): 502—508 [刘莉, 刘鹏, 金佳丽,等. 草鱼抗病毒基因Mx全长cDNA的克隆、序列分析与真核表达载体构建. 上海海洋大学学报, 2012, 21(4): 502—508]
[7] Wu H F, Bai J J, Lao H H, et al. Cloning and sequencing of the full-length cDNA of Mx protein from Mandarinfish [J]. Virologica Sinica, 2004, 19(3): 271—275 [吴海峰, 白俊杰,劳海华, 等. 鳜鱼Mx蛋白全长cDNA的克隆和序列分析.中国病毒学, 2004, 19(3): 271—275]
[8] Chen Y M, Su Y L, Lin J H, et al. Cloning of an orange-spotted grouper (Epinephelus coioides) Mx cDNA and characterisation of its expression in response to nodavirus [J]. Fish & Shellfish Immunology, 2006, 20(1): 58—71
[9] Trobridge G D, Chiou P P, Leong J A. Cloning of the rainbow trout (Oncorhynchus mykiss) Mx2 and Mx3 cDNAs and characterization of trout Mx protein expression in salmon cells [J]. Journal of Virology, 1997, 71(7): 5304—5311
[10] Plant K P, Thune R L. Cloning and characterisation of a channel catfish (Ictalurus punctatus) Mx gene [J]. Fish & Shellfish Immunology, 2004, 16(3): 391—405
[11] Robertsen B, Trobridge G, Leong J A. Molecular cloning of double-stranded RNA inducible Mx genes from atlantic salmon [J]. Developmental & Comparative Immunology, 1997, 21(5): 397—412
[12] Sun J G, Zhu Z Y, Wang Y P. Up-regulating expressions of toll-like receptor 3 and Mx genes in gills by grass carp reovirus in rare minnow, Gobiocypris rarus [J]. Acta Hydrobiologica Sinica, 2008, 32(5): 728—734 [苏建国, 朱作言, 汪亚平. 草鱼呼肠孤病毒上调稀有鲫鳃中 TLR3和Mx基因的表达. 水生生物学报, 2008, 32(5): 728—734]
[13] Zhang Y, Zhang Q, Xu D, et al. Identification of antiviral-relevant genes in the cultured fish cells induced by UV-inactivated virus [J]. Chinese Science Bulletin, 2003, 48(6): 581—588
[14] Wu Y C, Chi S C. Cloning and analysis of antiviral activity of a barramundi (Lates calcarifer) Mx gene [J]. Fish & Shellfish Immunology, 2007, 23(1): 97—108
[15] Liu Q L, Xiao T Y, Liu M, et al. Research progress of Squaliobarbus curriculus biology [J]. Fisheries Science, 2012, 31(11): 687—691 [刘巧林, 肖调义, 刘敏, 等. 赤眼鳟生物学研究进展. 水产科学, 2012, 31(11): 687—691]
[16] Peng L M. Molecule cloning and expression features of Mx genes in grass carp, Ctenopharyngodon idella [D]. Thesis for Master of Science. Northwest Sci-Tech University of Agriculture and Forestry, Yangling, 2012 [彭丽敏. 草鱼Mx基因的克隆及表达特征的研究. 硕士学位论文, 西北农林科技大学, 杨陵, 2012]
[17] Yuan S K, Wang J Y, Xie H F, et al. Advance in candidate genes of porcine disease resistance [J]. Chinese Journal of Animal Science, 2007, 43(15): 50—52 [袁树楷, 王金勇, 谢和芳, 等. 猪抗病育种候选基因研究进展. 中国畜牧杂志, 2007, 43(15): 50—52]
[18] Altmann S M, Mellon M T, Distel D L, et al. Molecular and functional analysis of an interferon gene from the zebrafish, Danio rerio [J]. Journal of Virology, 2003, 77(3): 1992—2002
[19] Plant K P, Thune R L. Genomic organisation of the channel catfish Mx1 gene and characterisation of multiple channel catfish Mx gene promoters [J]. Fish & Shellfish Immunology, 2008, 24(5): 575—583
[20] Robertsen B, Trobridge G, Leong J A. Molecular cloning of double-stranded RNA inducible Mx genes from Atlantic salmon (Salmo salar L.) [J]. Developmental & Comparative Immunology, 1997, 21(5): 397—412
[21] Fernandez-Trujillo M A, Novel P, Manchado M, et al. Three Mx genes with differential response to VNNV infection have been identified in Gilthead seabream (Sparus aurata) [J]. Molecular Immunology, 2011, 48(9—10): 1216—1223
[22] Zenke K, Kim K H. Molecular cloning and expression analysis of three Mx isoforms of rock bream, Oplegnathus fasciatus [J]. Fish & Shellfish Immunology, 2009, 26(4): 599—605
[23] Peng L, Yang C, Su J. Protective roles of grass carp (Ctenopharyngodon idella) Mx isoforms against grass carp reovirus [J]. PLoS One, 2012, 7(12): e52142
[24] Xiao Z G, Liu X M, Wang L, et al. Cloning and tissue expression of Mx1 gene in ICR Mouse [J]. Progress in Veterinary Medicine, 2011, 32(4): 23—28 [肖志广, 刘晓敏,王丽, 等. ICR小鼠Mx1基因的克隆及组织表达. 动物医学进展, 2011, 32(4): 23—28]
[25] Lee J Y, Hirono I, Aoki T. Cloning and analysis of expression of Mx cDNA in Japanese flounder, Paralichthys olivaceus [J]. Developmental & Comparative Immunology, 2000, 24(4): 407—415
[26] Samanta M, Ba M, Swain B, et al. Molecular cloning and characterization of toll-like receptor 3, and inductive expression analysis of type I IFN, Mx and pro-inflammatory cytokines in the Indian carp, rohu (Labeo rohita) [J]. Molecular Biology Reports, 2013, 40(1): 225—235
[27] Xie F J. Cloning and analysis of disease-resistance genes from large yellow croaker [D]. Thesis for Master of Science. Jimei University, Xiamen, 2007 [谢芳靖. 大黄鱼抗病功能基因的克隆与分析. 硕士学位论文. 集美大学, 厦门, 2007]
[28] Bravo J, Real F, Padilla D, et al. Effect of lipopolysaccharides from Vibrio alginolyticus on the Mx gene expression and virus recovery from gilthead sea bream (Sparus aurata L.) experimentally infected with Nodavirus [J]. Fish & Shellfish Immunology, 2013, 34(1): 383—386
[29] Xia J. Molecular cloning and expression analysis of IRF-3 and IRF-7 in turbot, Scophthalmus maximus [D]. Thesis for Master of Science, China Ocean University, Qingdao, 2011 [夏军. 大菱鲆干扰素调节因子 3(IRF-3)和干扰素调节因子 7(IRF-7)基因克隆与表达分析. 硕士学位论文, 中国海洋大学, 青岛, 2011]
[30] Yin X Y. Molecular cloning and expression analysis of IRF-3 and IRF-7 in Japanese Flounder, Paralichthys olivaceus [D]. Thesis for Master of Science. China Ocean University, Qingdao, 2010 [尹湘艳. 褐牙鲆干扰素调节因子3(IRF-3)和干扰素调节因子7(IRF-7)的全长 cDNA克隆与表达分析. 硕士学位论文. 中国海洋大学, 青岛, 2010]
MOLECULAR CLONING AND TISSUE EXPRESSION ANALYSIS OF Mx GENE IN SQUALIOBARBUS CURRICULUS
PENG Hui-Zhen1, LIU Min1, LIU Qiao-Lin1, XIAO Tiao-Yi1, SUN Jian-Ming2, XU Bao-Hong1and LIU Yu-Jie1
(1. Laboratory of Hydrobiology, Hunan Agricultural University, Changsha 410128, China; 2. College of animal veterinary and medicine, Hunan Agricultural University, Changsha 410128, China)
Mx protein, a GTP-enzyme active protein induced by interferon, exhibits broad-spectrum antiviral activity. As member of economically fresh water fish with superior quality, Squaliobarbus curriculus has the highest fitness and disease resistance; however, studies on its immunity are limited. In the current study, we amplified a full-length cDNA of Mx (ScMx) from the spleen by using degenerate PCR and SMART RACE, and conducted homology analysis and tissue expression analysis of ScMx mRNA in different tissues including liver, spleen, intestine, gill, kidney, head kidney, heart, brain and muscle. Furthermore, we investigated the temporal expression levels of ScMx in the liver and spleen after GCRV-104 infection. The results indicated that the full-length of ScMx gene was 2325 bp consisted of 40 bp 5′-UTR, 371 bp 3′-UTR and 1884 bp ORF encoding 627 amino acids. The theoretical molecular weight and isoelectric point (PI) of ScMx were 70.9 kD and 8.25, respectively. ScMx shared the most homology with Carassius aruatus Mx3. ScMx was broadly expressed in all tested tissues. After infected with GCRV-104, the ScMx expression levels in the liver and spleen showed a tendency of fluctuation: the relative expression of ScMx increased reached the peak at 48h after the viral infection, and then decreased. The infection significantly induced the expression of ScMx (P<0.05). These results suggested that ScMx may play an important role in the immune response of Squaliobarbus curriculus against GCRV-104 infection.
Squaliobarbus curriculus; Mx gene; Full-length cDNA; Tissue expression analysis
Q344+.1
A
1000-3207(2014)06-0993-09
10.7541/2014.147
2013-01-14;
2014-04-12
国家科技支撑计划(2011AA011404); 国家自然科学基金面上项目(31272652)资助
彭慧珍(1981—), 女, 湖南长沙人; 博士; 主要研究方向为水生动物健康养殖。E-mail: phz2011cn@163.com刘敏(1988—), 女, 湖南常德人; 硕士; E-mail: 283141785@qq.com *共同第一作者
肖调义, 主要研究方向为水生动物遗传育种。E-mail: tyxiao1128@163.com

