克氏原螯虾源致病性豚鼠气单胞菌的分离及其生物学特性
曹海鹏温乐夫杨移斌石婷婷何 珊
(1. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海市水产养殖工程技术研究中心, 上海高校知识服务平台上海海洋大学水产动物遗传育种中心(ZF1206), 上海 201306; 2. 中国水产科学研究院长江水产研究所, 武汉 430000)
克氏原螯虾源致病性豚鼠气单胞菌的分离及其生物学特性
曹海鹏1温乐夫1杨移斌2石婷婷1何 珊1
(1. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海市水产养殖工程技术研究中心, 上海高校知识服务平台上海海洋大学水产动物遗传育种中心(ZF1206), 上海 201306; 2. 中国水产科学研究院长江水产研究所, 武汉 430000)
从患病的克氏原螯虾体内分离到一株致病菌L2M-A, 经生理生化鉴定和16S rDNA序列分析, 证实菌株L2M-A为豚鼠气单胞菌(Aeromonas caviae) (GenBank登录号: KF446251), 其16S rDNA序列与基因库中气单胞菌属菌株的16S rDNA序列有99%—100%的同源性, 而且与豚鼠气单胞菌JXZ-3株(GenBank登录号: JF496552)的亲缘关系最近。此外, 菌株L2M-A在pH5—9内均能够生长良好, 最适生长温度为30 , ℃ 最适生长转速为200 r/min, 但浓度≥6.25 μg/mL的双氟沙星对其生长具有显著的抑制作用, 可作为防治用药的依据。
豚鼠气单胞菌; 鉴定; 生物学特性; 克氏原螯虾
克氏原螯虾(Procambarus clarkii)具有较高的经济价值, 是我国重要的水产资源, 在全国各地, 尤其是长三角地区备受广大消费者青睐。据统计, 全国对克氏原螯虾的年消费量高达几万吨, 具有十分广阔的养殖前景。自20世纪90年代克氏原螯虾人工养殖在江苏等地首次获得成功后, 安徽、江苏、湖北、江西、河南、浙江、湖南、天津、山东、四川、广东、福建、贵州、重庆、广西、陕西等省市均不同程度地开展了克氏原螯虾的养殖[1]。与此同时, 病害的暴发也给克氏原螯虾的养殖造成了巨大的经济损失。其中, 嗜水气单胞菌、副溶血弧菌是克氏原螯虾的重要病原菌[2—4], 曾引起克氏原螯虾发生大规模死亡, 但从现有资料来看, 未见豚鼠气单胞菌引起克氏原螯虾发病的报道。2008年5月初,上海天亿克氏原螯虾养殖基地养殖克氏原螯虾出现暴发性死亡, 十几天克氏原螯虾的死亡量高达近2000 kg。其主要病症为: 患病克氏原螯虾全身发红,严重者头胸部充满积液, 肝胰腺腐烂。本实验从自然发病的克氏原螯虾体内分离到一株致病菌L2M-A,经生理生化鉴定和系统发育学分析, 证实菌株L2M-A为豚鼠气单胞菌(Aeromonas caviae), 并进一步对其生长特性进行了研究, 以期为克氏原螯虾源豚鼠气单胞菌的病原学研究提供理论资料。
1 材料与方法
1.1 病虾来源
患病克氏原螯虾, 体长约为(5—7) cm, 取自上海天亿克氏原螯虾养殖基地。
1.2 致病菌的分离
用 75%酒精对具有典型发病症状的濒死克氏原螯虾进行体表消毒, 然后在无菌条件下取其肝胰腺、肌肉等组织以及头胸部的积液, 分别在TCBS和普通营养琼脂平板上进行致病菌株的分离, 并将平板在30℃恒温培养18—24h后进行菌株的纯化, 在斜面琼脂培养基上进行转接培养后于4℃冰箱保存备用。
1.3 人工回归感染实验
选取健康的克氏原螯虾进行人工回归感染实验。先将培养基琼脂斜面上的各菌株的菌苔分别用无菌生理盐水洗下, 经稀释涂布平板法测定浓度后再用无菌生理盐水调节各菌悬液浓度为1.0×107cfu/mL。分别在健康克氏原螯虾第二、三腹节的基部注射各菌悬液, 每尾克氏原螯虾注射 0.1 mL, 对照克氏原螯虾注射等体积的无菌生理盐水。连续6d计算实验虾的死亡数量, 观察实验虾的发病症状, 在及时捞出死虾的同时解剖检查其病变情况, 同时对发病濒死的实验虾进行致病菌再分离。每组实验克氏原螯虾各10尾, 水温为(22—25)℃。
1.4 致病菌的鉴定
生理生化鉴定 参照王会聪等[5]采用的 API ID32GN细菌鉴定系统进行。
分子鉴定 以致病菌株的基因组 DNA为模板, 选用正向引物 27F(5′-AGAGTTTGATCCTGGC TCAG-3′)和反向引物 1492R(5′-GGTTACCTTGTTA CGACTT-3′)对其16S rDNA进行PCR扩增。PCR的扩增条件为: 94℃ 3min; 94℃ 1min, 60℃ 1min, 72℃1min, 共35个循环; 72℃延伸10min。PCR产物的纯化与测序委托生工生物工程(上海)股份有限公司完成。通过美国国立生物技术信息中心(NCBI)网站中的BLASTn软件, 将致病菌株的16S rDNA序列与GenBank基因库中已知细菌的16S rDNA序列进行同源性比较后, 进一步通过软件Mega 4.0对同源性较高的 16S rDNA序列进行多重比较, 并利用邻接法构建致病菌株的系统发育树。
1.5 致病菌生长特性的测定
致病菌株液体菌种的制备 将致病菌株接种到斜面培养基上30℃培养18h后接种到pH7的100 mL无菌营养肉汤中, 于30℃、200 r/min条件下摇床振荡培养18h后即为液体菌种。
生长因子对致病菌生长的影响 取液体菌种1 mL接种到100 mL无菌营养肉汤中, 分别于不同pH (3、5、7、9、11)、温度(20℃、25℃、30℃、35℃、40 )℃、转速(100、150、200、250、300 r/min)条件下摇床振荡培养 18h后取样, 测定各条件下致病菌株的A560值[6]。以各生长因子为横坐标、A560值为纵坐标绘制曲线。
双氟沙星对致病菌生长的影响 取液体菌种1 mL分别接种到含双氟沙星0、6.5、12.5、25、50、100 μg/mL的 100 mL pH5的无菌营养肉汤中, 于30℃、200 r/min条件下振荡培养18h后取样, 测定各双氟沙星浓度下致病菌株的 A560值[6]。以双氟沙星浓度(μg/mL)为横坐标、A560值为纵坐标绘制曲线。
致病菌生长曲线的测定 将液体菌种 1 mL接种到100 mL pH5的无菌营养肉汤中, 于30℃、200 r/min条件下摇床振荡培养, 分别在0、0.5h、1.5h、4h、8h、12h、16h、20h、24h、28h、32h、36h、40h、44h、48h分别取样测定致病菌株的A560值[6]。以培养时间为横坐标、A560值为纵坐标, 绘制致病菌株的生长曲线。
2 结果

表1 分离菌株对克氏原螯虾人工回归感染实验结果Tab. 1 Results of artificial infection test of the isolated bacteria
2.1 致病菌的分离
从自然发病克氏原螯虾的肝胰腺、肌肉、积液中分别分离纯化到2株、3株、1株优势细菌, 分别暂名为L1L-A、L3L-T、L2M-A、L3M-A、L3M-T、L2A-A。其中菌株 L1L-A、L2M-A、L3M-A、L2A-A在普通营养琼脂平板上均形成以淡黄色、圆形、中央隆起、边缘整齐、表面光滑湿润为特征的的菌落;菌株L3L-T、L3M-T在TCBS平板上均形成以黄色、圆形、中央隆起、边缘整齐、表面光滑湿润为特征的菌落。人工回归感染试验结果表明(表 1), 菌株L2M-A对克氏原螯虾有致病作用, 实验克氏原螯虾的发病与死亡症状与自然病症基本相同, 而且从人工感染的克氏原螯虾的体内又可分离到与原菌株形态特征、理化性质一致的菌株, 表明菌株L2M-A是引起该病的致病菌。
2.2 致病菌的鉴定
菌株 L2M-A的生理生化鉴定结果表明(表 2),菌株L2M-A为豚鼠气单胞菌, 鉴定率为99.9%。此外,通过PCR扩增, 获得了菌株L2M-A长度为1400 bp的16S rDNA 序列, 其在 GenBank上的登录号为: KF446251。通过BLASTn软件对菌株L2M-A的16S rDNA序列的同源性分析结果表明, 菌株L2M-A的16S rDNA序列与GenBank数据库中气单胞菌属菌株的16S rDNA序列有99%—100%的同源性, 菌株L2M-A的系统发育分析结果(图1)进一步表明, 菌株L2M-A与豚鼠气单胞菌JXZ-3株(GenBank登录号: JF496552)的亲缘关系最近。结合生理生化及系统发育分析结果, 菌株L2M-A为豚鼠气单胞菌。

表2 API ID32GN细菌鉴定系统鉴定的菌株L2M-A的生理生化特征Tab. 2 Physiological and biological characteristics of strain L2M-A by API ID32GN bacterial identification

图1 通过邻接法构建的基于菌株L2M-A及相关菌株 16S rDNA序列的系统发育树Fig. 1 The constructed phylogenetic tree based on 16S rDNA sequences of strain L2M-A and other related strains by neighborjoining method
2.3 致病菌的生长特性
pH对致病菌生长的影响 实验结果表明(图 2), 豚鼠气单胞菌 L2M-A在 pH5—9范围内均能够生长良好, 其中豚鼠气单胞菌 L2M-A的最适生长pH5。当培养基在初始pH3时, 豚鼠气单胞菌L2M-A培养液的A560值最低, 豚鼠气单胞菌L2M-A基本不生长; 随着培养基pH的升高, 豚鼠气单胞菌L2M-A培养液的A560值急剧增加, 当培养基在初始pH5时达到最大值; 当培养基在初始pH大于5时, 豚鼠气单胞菌L2M-A培养液的A560值逐渐缓慢降低, 当培养基在初始pH大于9时, 豚鼠气单胞菌L2M-A培养液的 A560值急剧下降, 当培养基在初始 pH11时,豚鼠气单胞菌L2M-A培养液的A560值仅为pH5时的40.84%。
温度对致病菌生长的影响 实验结果表明(图3), 豚鼠气单胞菌L2M-A在温度(20—40)℃范围内均能生长, 其中豚鼠气单胞菌L2M-A的最适生长温度为 30℃。在(20—30)℃范围内, 随着温度的升高, 豚鼠气单胞菌L2M-A培养液的A560值逐渐增大,当培养温度大于30℃时, 豚鼠气单胞菌L2M-A培养液的A560值逐渐降低, 豚鼠气单胞菌L2M-A在培养温度为 40℃时的培养液 A560值仅为 30℃时的65.02%。

图2 pH对菌株L2M-A生长的影响Fig. 2 Effect of pH on the growth of strain L2M-A

图3 温度对菌株L2M-A生长的影响Fig. 3 Effect of temperature on the growth of strain L2M-A
转速对致病菌生长的影响 实验结果表明(图4),豚鼠气单胞菌L2M-A的最适生长转速为200 r/min。在(100—200) r/min范围内, 随着转速的升高, 豚鼠气单胞菌 L2M-A 培养液的 A560值急剧增大, 在200 r/min时达到最大值; 当转速大于200 r/min时,豚鼠气单胞菌L2M-A培养液的A560值急剧下降, 当转速为300 r/min时, 豚鼠气单胞菌L2M-A培养液的A560值仅为200 r/min时的27.05%。
双氟沙星对致病菌生长的影响 实验结果表明(图 5), 豚鼠气单胞菌 L2M-A在双氟沙星浓度(0—100) μg/mL范围内均能够生长, 但随着双氟沙星浓度的增加, 其培养液的 A560值逐渐降低。当培养基中双氟沙星浓度范围为(0—6.25) μg/mL时, 豚鼠气单胞菌L2M-A培养液的A560值随着双氟沙星浓度的增加急剧下降; 而当培养基中双氟沙星浓度范围为(6.25—100) μg/mL时, 豚鼠气单胞菌L2M-A生长速度趋于平缓, 双氟沙星浓度为100 μg/mL时豚鼠气单胞菌L2M-A培养液的A560值相当于双氟沙星浓度为6.25 μg/mL时的32.13%。
致病菌的生长曲线 实验结果表明(图 6), 0—1.5h为生长延迟期, 1.5—24h为对数生长期, 24—36h为稳定期, 36h以后为衰亡期。
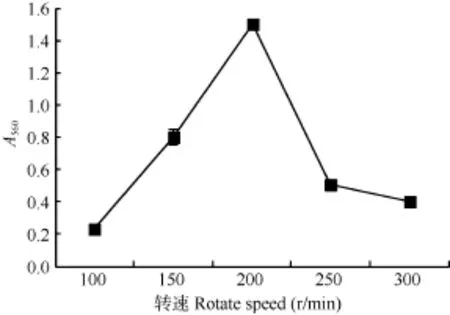
图4 转速对菌株L2M-A生长的影响Fig. 4 Effect of rotate speed on the growth of strain L2M-A

图5 双氟沙星对菌株L2M-A生长的影响Fig. 5 Effect of difloxacin on the growth of strain L2M-A

图6 菌株L2M-A的生长曲线Fig. 6 The growth curve of strain L2M-A
3 讨论
豚鼠气单胞菌是水产养殖动物常见致病菌, 可危害中华鳖(Triongx sinensis)、丰产鲫[Carassius auratus of Penze (♀) ×Cyprinus acutidorsalis (♂)]、鲤(Cyprinus carpio L.)、日本鳗鲡(Anguilla japonica)、南方鲇(Silurus meriordinalis Chen)、胡子鲶(Clarias fuscus)、杂交鲟([Huso huso (♀)× Acipenser ruthenus (♂)]、中国对虾(Penaeus chinensis)、中华绒螯蟹(Eriocheir sinensis)等多种水产养殖动物[6—14]。因此, 豚鼠气单胞菌引起的水产养殖动物疾病应予以重视。本实验证实豚鼠气单胞菌对克氏原螯虾具有致病性, 并分析了克氏原螯虾源豚鼠气单胞菌的生长特性, 不仅进一步证实了豚鼠气单胞菌危害的广泛性, 而且也丰富了豚鼠气单胞菌的病原学研究资料。
豚鼠气单胞菌的生化特性具有菌株差异性。本实验分离的豚鼠气单胞菌L2M-A与李小波等报道的鲫源豚鼠气单胞菌CSS-4-2对肌醇和麦芽糖的生化反应结果不同[8], 与徐海圣等报道的蟹源豚鼠气单胞菌816X1和816X2对水杨素的生化反应结果也不同[14]。出现这些差异, 可能与菌株在地区、气候、水质条件及实验室培养条件等方面的差异有关[8]。
豚鼠气单胞菌不同菌株的生长特性不尽相同。安利国等研究表明, 鲤源豚鼠气单胞菌RXY-1的最适生长温度为(25—30) , ℃ 最适生长 pH6—8[9]; 曹海鹏等研究表明, 鲟细菌性败血综合征致病性豚鼠气单胞菌 XL2-T的最适生长温度为(25—30) , ℃ 最适生长 pH7[6]。本实验分离的豚鼠气单胞菌 L2M-A的最适生长温度和pH分别为30℃和5, 其最适生长温度与豚鼠气单胞菌 RXY-1、XL2-T基本一致, 但最适生长pH与豚鼠气单胞菌RXY-1、XL2-T有所不同, 这可能与菌株差异有关。
近年来, 病原菌对水产养殖中允许使用的抗菌药物产生的耐药性日益增强[15], 因而迫切需要寻找更多在水产养殖中具有潜在应用价值的新型抗菌药物。双氟沙星为第三代氟喹诺酮类抗菌药物, 因其具有良好的抗菌效果且与其他抗菌药物无交叉耐药性而有望被广泛用于水产养殖动物细菌性疾病的防治[16]。目前, 我国已经开展了双氟沙星在异育银鲫(Carassius auratus gibelio)、中华绒螯蟹(Eriocheir sinensis)体内的药代动力学研究[17,18], 为双氟沙星在水产养殖中的安全应用技术开发提供了科学的理论依据。然而, 国内学者关于双氟沙星对水产养殖动物病原菌抑菌效果研究却鲜有报道, 因而本实验观察了不同浓度的双氟沙星对克氏原螯虾源豚鼠气单胞菌L2M-A的生长抑制作用, 以弥补双氟沙星应用于水产养殖动物病害防治基础理论研究的不足。目前, Cao等测定了双氟沙星对水产养殖动物病原性嗜水气单胞菌的最小抑菌浓度, 发现双氟沙星对5株嗜水气单胞菌的最小抑菌浓度范围为0.83—4.0 μg/mL[19]。本实验研究结果也表明, 浓度≥6.25 μg/mL的双氟沙星对克氏原螯虾源豚鼠气单胞菌L2M-A的生长也具有显著的抑制效果。这些研究均为双氟沙星在水产养殖动物病害防治应用中的开发奠定了科学依据。
[1] Huang Y, Dai Y G, Hu C Y, et al. Current state and development strategy of Procambarus clarkii industry [J]. Jiangsu Agricultural Sciences, 2011, 1: 274—277 [黄羽, 戴银根, 胡成钰, 等. 克氏原螯虾产业发展现状及可持续发展对策. 江苏农业科学, 2011, 1: 274—277]
[2] Ma X R, Xue H, Tang J Q. Isolation, identification and drug susceptibility of pathogenic Aeromonas hydrophila from Procambarus clarkii [J]. Journal of Aquaculture, 2012, 8: 45—47 [马小荣, 薛晖, 唐建清. 克氏原螯虾致病性嗜水气单胞菌的分离鉴定及药敏试验. 水产养殖, 2012, 8: 45—47]
[3] Zhou D R, Zhang W M, Li J Y, et al. Isolation and identification of bacterial pathogen from Procambarus clarkii [J]. Chinese Agricultural Science Bulletin, 2011, 27(26): 102—105 [周冬仁, 章文敏, 李健应, 等. 克氏原螯虾细菌性病原的分离与鉴定. 中国农学通报, 2011, 27(26): 102—105]
[4] Chen C F, Liu Y G, He G W, et al. The bacterial pathogen of outbreak disease in Procambarus clarkii [J]. Journal of Huazhong Agricultural University, 2009, 28(2): 193—198 [陈昌福, 刘远高, 何广文, 等. 克氏原螯虾暴发病细菌性病原的研究. 华中农业大学学报, 2009, 28(2): 193—198]
[5] Wang H C, Cao H P, He S, et al. Identification and removal condition of a nitrite removing bacterium from aquaculture sediment [J]. Microbiology China, 2012, 39(2): 154—161 [王会聪, 曹海鹏, 何珊, 等. 一株养殖水体中亚硝酸盐去除菌的鉴定及其去除条件. 微生物学通报, 2012, 39(2): 154—161]
[6] Cao H P, Yang X L, Wang Y J, et al. Isolation and growth characteristics of pathogenic Aeromonas punctata caviae from sturgeons [J]. Chinese Journal of Zoology, 2007, 42(6): 1—6 [曹海鹏, 杨先乐, 王玉洁, 等. 鲟源致病性豚鼠气单胞菌的分离及其生长特性. 动物学杂志, 2007, 42(6): 1—6]
[7] Yu X P, Ma Y Z. Study on the pathogen of a chronic infectious disease in cultured Triongx sinensis [J]. Chinese Journal of Veterinary Science, 1997, 17(5): 460—462 [余旭平, 马有智. 甲鱼病原性豚鼠气单胞菌的分离鉴定. 中国兽医学报, 1997, 17(5): 460—462]
[8] Li X B, Huang W F. Study on the bacterial septicemia of Carassius auratus of Penze (♀) ×Cyprinus acutidorsalis (♂)Ⅰ— Isolation and identification of the pathogen [J]. Microbiology China, 2003, 30(5): 56—60 [李小波, 黄文芳.丰产鲫细菌性败血病的研究Ⅰ—病原分离与鉴定. 微生物学通报, 2003, 30(5): 56—60]
[9] An L G, Fu R S, Xing W X, et al. Studies on pathogen and vaccine of carp dropsy [J]. Journal of Fisheries of China, 1998, 22(2): 136—142 [安立国, 傅荣恕, 邢维贤, 等. 鲤竖鳞病病原及其疫苗的研究. 水产学报, 1998, 22(2): 136—142]
[10] Fan H P, Wu B, Zeng Z Z, et al. Isolation and identification of bacteriosis pathogen from Anguilla japonica ulceration of skin and preparation of its monoclonal antibody [J]. Journal of Fishery Sciences of China, 2009, 16(2): 295—302 [樊海平, 吴斌, 曾占壮, 等. 日本鳗鲡体表溃疡病病原菌的分离、鉴定及单克隆抗体制备. 中国水产科学, 2009, 16(2): 295—302]
[11] Ji L L, Wang K Y, Xiao D, et al. Isolation and identification of pathogenic bacteria causing ulcer disease of Silurus meriordinalis Chen [J]. Freshwater Fisheries, 2008, 38(3): 68—72 [吉莉莉, 汪开毓, 肖丹, 等. 南方鲇溃疡综合症病原菌的分离与鉴定. 淡水渔业, 2008, 38(3): 68—72]
[12] Huang W J, Huang J, Qin A Z, et al. Isolation and identification of the pathogen from ascitesosis-infected wild Clarias fuscus [J]. Chinese Journal of Veterinary Science and Technology, 2000, 30(4): 30—33 [黄伟坚, 黄均, 秦爱珍, 等. 野生胡子鲶“腹水病”病原分离和鉴定. 中国兽医科技, 2000, 30(4): 30—33]
[13] Fan H P, Meng Q X, Yu K K. The pathogenicities and biologic characteristics of the pathogens (Aeromonas spp.) caused the septicemia of Penaeus chinensis [J]. Journal of Fisheries of China, 1994, 18(1): 32—38 [樊海平, 孟庆显,俞开康. 中国对虾败血病病原菌(气单胞菌)的致病性与生物学性状. 水产学报, 1994, 18(1): 32—38]
[14] Xu H S, Huang L F, Wang S X. Isolation and identification of Aeromonas caviae from Eriocheir sinensis [J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2001, 27(6): 677—681 [徐海圣, 黄立峰, 王淑霞. 中华绒螯蟹豚鼠气单胞菌的分离和鉴定. 浙江大学学报(农业与生命科学版), 2001, 27(6): 677—681]
[15] Li A H. Antibacterial drugs used in aquaculture and drug resistance of fish bacterial pathogens [J]. Journal of Fishery Sciences of China, 2002, 9(1): 87—91 [李爱华. 水产养殖中使用的抗菌药物及细菌耐药性. 中国水产科学, 2002, 9(1): 87—91]
[16] Zhang H X, Cao H P, Ruan J M, et al. Pharmacokinetics of difloxacin in the Aeromonas hydrophila-infected Carassius auratus gibelio [J]. Chinese Journal of Zoology, 2012, 47(6): 72—77 [章海鑫, 曹海鹏, 阮记明, 等. 双氟沙星在人工感染嗜水气单胞菌的异育银鲫体内的药代动力学. 动物学杂志, 2012, 47(6): 72—77]
[17] Zhang H X, Hu K, Ruan J M, et al. Researches of plasma protein binding rate of difloxacin and its pharmacokinetic in Carassius auratus gibelio [J]. Acta Hydrobiologica Sinica, 2013, 37(1): 62—69 [章海鑫, 胡鲲, 阮记明, 等. 异育银鲫体内盐酸双氟沙星血浆蛋白结合率的变化与其药代动力学研究. 水生生物学报, 2013, 37(1): 62—69]
[18] Li H D, Yang X L, Hu K, et al. Pharmacokinetics and the elimination regularity of difloxacin and its metabolite sarafloxacin in Eriocheir sinensis [J]. Chinese Journal of Zoology, 2009, 44(2): 12—20 [李海迪, 杨先乐, 胡鲲, 等.盐酸双氟沙星及其代谢产物在中华绒螯蟹体内药物代谢及残留消除规律. 动物学杂志, 2009, 44(2): 12—20]
[19] Cao H, Zhang H, He S, et al. Pharmacokinetics of difloxacin in healthy and aeromonasis-infected gibel carp Carassius auratus gibelio [J]. Israeli Journal of Aquaculture-Bamidgeh, DOI: IJA_65.2013.896
ISOLATION AND BIOLOGICAL CHARACTERISTICS OF AN AEROMONAS CAVIAE PATHOGEN FROM PROCAMBARUS CLARKII
CAO Hai-Peng1, WEN Le-Fu1, YANG Yi-Bin2, SHI Ting-Ting1and HE Shan1
(1. Key Laboratory of Freshwater Fishery Germplasm Resources, Ministry of Agriculture of China, Shanghai Engineering Research Center of Aquaculture, Shanghai University Knowledge Service Platform, Shanghai Ocean University Aquatic Animal Breeding Center (ZF1206), National Pathogen Collection Center for Aquatic Animals, Shanghai Ocean University, Shanghai 201306, China; 2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430000, China)
A pathogenic strain L2M-A was isolated from diseased Procambarus clarkii, and was identified as an Aeromonas caviae strain (GenBank accession No. KF446251) with biochemical and molecular approaches. The 16S rDNA sequence of this strain showed a homology of 99% to 100% with those of Aeromonas strains, and was closest related to that of A. caviae strain JXZ-3 (GenBank accession No: JF496552). We also found that the optimal growth conditions of strain L2M-A were pH5-9, temperature at 30℃, and spinning speed at 200 r/min. The growth of L2M-A could be significantly inhibited by difloxacin at the concentration of ≥6.25 μg/mL. This finding could provide scientific guidance for the disease control.
Aeromonas caviae; Identification; Biological characteristics; Procambarus clarkii
S945.1
A
1000-3207(2014)06-1047-07
10.7541/2014.154
2013-10-06;
2014-03-25
江苏省科技支撑计划项目(No. BE2013366); 山西省科技攻关项目(No. 20120311025-4); 上海高校实验技术队伍建设计划(个人)项目; 上海海洋大学水产类人才创新创业实训基地(泗洪)项目; 国家自然科学基金青年基金项目资助
曹海鹏(1981—), 男, 山东招远人; 博士, 工程师; 主要从事水产动物病害防治与微生态制剂的开发研究。E-mail: hpcao@shou.edu.cn
何珊(1986—), E-mail: s_he@shou.edu.cn

