新疆额尔齐斯河周丛藻类群落结构特征研究
李 君周 琼谢从新王 军韦丽丽
(1. 华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070)
LI Jun1,2, ZHOU Qiong1,2, XIE Cong-Xin1,2, WANG Jun1,2and WEI Li-Li1,2
(1. Key Laboratory of Freshwater Animal Breeding, College of Fishery, Ministry of Agriculture, Huazhong Agricultural University, Wuhan 430070, China; 2. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
新疆额尔齐斯河周丛藻类群落结构特征研究
李 君1,2周 琼1,2谢从新1,2王 军1,2韦丽丽1,2
(1. 华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070)
周丛藻类是新疆跨境河流土著及特有鱼类重要的基础饵料资源, 然而在该地区有关周丛藻类的研究目前尚属空白。有鉴于此, 2012年7、8、10月对新疆跨境河流——额尔齐斯河全流域的周丛藻类群落结构进行了系统的调查分析。结果表明, 周丛藻类隶属7门70属178种, 由硅藻门、绿藻门、蓝藻门、裸藻门、黄藻门、金藻门和甲藻门组成, 其中硅藻门有 92种并占据绝对优势(51.7%), 绿藻门 49种(30.3%), 蓝藻门20种(11.8%), 裸藻门5种(2.8%), 黄藻门3种(1.7%), 金藻门2种(0.1%), 甲藻门仅1种(0.6%), 周丛藻类在不同月份的种类数存在显著差异(P<0.01)。优势种主要为硅藻门的嗜盐舟形藻(Navicula halophila)、钝脆杆藻(Fragilaria capucina Desm)、极小桥弯藻(Cymbella perpusilla Cl)以及蓝藻门的皮状席藻(Phormidium corium Gom)等。研究期间, 额尔齐斯河周丛藻类的密度和生物量的均值分别为1105.5×106ind./m2和2692.0 mg/m2, 不同月份间密度和生物量的分布差异不显著, 但在空间分布上整体趋势为中下游地区高于上游地区。水温和营养盐成为影响其分布的主要环境因子。Simpson多样性指数、Shannon-Wiener多样性指数、Pielou均匀度指数和Margalef丰富度指数的平均值分别是0.38、3.04、0.66和2.55。运用多样性指数和藻类丰度对额尔齐斯河水质评价为轻度污染。
周丛藻类; 种群结构; 丰度; 多样性指数; 水质评价; 额尔齐斯河
额尔齐斯河, 是我国唯一流入北冰洋的河流,源出中国阿尔泰山西南坡, 自东南向西北奔流出国,经俄罗斯的鄂毕河注入北冰洋。全长2969 km, 在中国境内546 km, 流域面积5.7万km2, 年径流量多达119亿 m3, 水量仅次于伊犁河居新疆第二位, 号称新疆第二大河[1]。额尔齐斯河上游主要靠融雪、融冰和降水补给, 下游主要来源于融雪、降水和土壤中的水[2]。额尔齐斯河不仅水资源丰富, 也是新疆水生生态环境保持较为原始的区域。上游坡降较大,水温较低, 水流湍急, 是高山冷水性水生生物良好的栖息场所, 该流域栖息有哲罗鲑(Hucho taimen Pallas, 俗称大红鱼)、细鳞鲑(Brachymystax lenok Pallas, 俗称小红鱼)、北极茴鱼(Thymallus arcticus arcticus Pallas)等珍稀、濒危鱼类[3]。
周丛藻类即着生藻类, 是指浸没在水中各种基质表面的有机体集合[4], 它不仅是湖泊重要的初级生产力, 而且为鱼类、底栖动物等提供丰富的食物来源[5], 同时由于其方便采集、对外来干扰敏感性强及固着生长等特性, 着生藻类已经广泛应用于河流生态系统的环境评价[6]。额尔齐斯河流域常年栖息着多种珍稀特有的名贵鱼类, 随着人类经济活动的加剧, 如: 水利工程建设、农业灌溉和工业引排水等,对土著与特有鱼类及其饵料资源产生严重的影响。周丛藻类作为土著和特有鱼类的重要饵料资源, 其生态功能非常关键。对额尔齐斯河流域的周丛藻类种类组成、优势种属、时空分布及群落多样性指数进行了调查分析, 并首次报道新疆地区跨境河流周丛藻类群落结构特征。比较全面了解和掌握该水域水生生物物种资源状况, 从而更加有效地利用水生生物监测水质并保护新疆跨境河流土著、特有鱼类种质资源。
1 材料与方法
1.1 采样位置与采样时间
额尔齐斯河流域具有较长的冰封期(11月初至翌年 4月中旬)[2], 根据额尔齐斯河的气候条件, 本研究选择7月、8月和10月作为采样时间。根据额尔齐斯河的生态特点, 上游为山区, 中游为半山区, 下游为荒漠平原区[7], 在额尔齐斯河的干流、主要支流及重要附属水体设置了10个采样点(表1), 从下游到上游的顺序依次为: 185团(北湾)、别列则克、哈巴河大桥、托洪台水库、布尔津河口、充乎尔大桥、小635、克兰河上游、富蕴县、可可托海。各采样点的设置主要依据河道情势、交通条件、采样条件等因素。
1.2 样品的采集和处理
用 MAGELLAN 全球定位系统( eXplorist-200)记录采样点的经纬度和海拔高度(表1)。在采样点河流上下游 100 m 范围内, 依据河流生境的不同(流速、水深和透明度), 对周丛藻类进行定性和定量样品的采集。周丛藻类定性样品是采用天然基质采样法, 采集附有藻类的石头用硬毛刷将附着其上的藻类刷入装有蒸馏水的磁盘中, 定量至 1000 mL, 回到实验室浓缩至50 mL样品瓶中, 采用甲醛溶液固定[8]。定量样品是选择附有藻类的形状规整、易于测量表面积的石块, 用毛刷刮取藻类并用蒸馏水冲刷至不锈钢托盘中后装入 1 L塑料瓶中, 用鲁哥氏液 15 mL固定, 带回室内沉淀 24h后至样品瓶中,定容至50 mL。水质指标采用alalis MP3500便携式pH/电导率/溶氧仪现场测定。
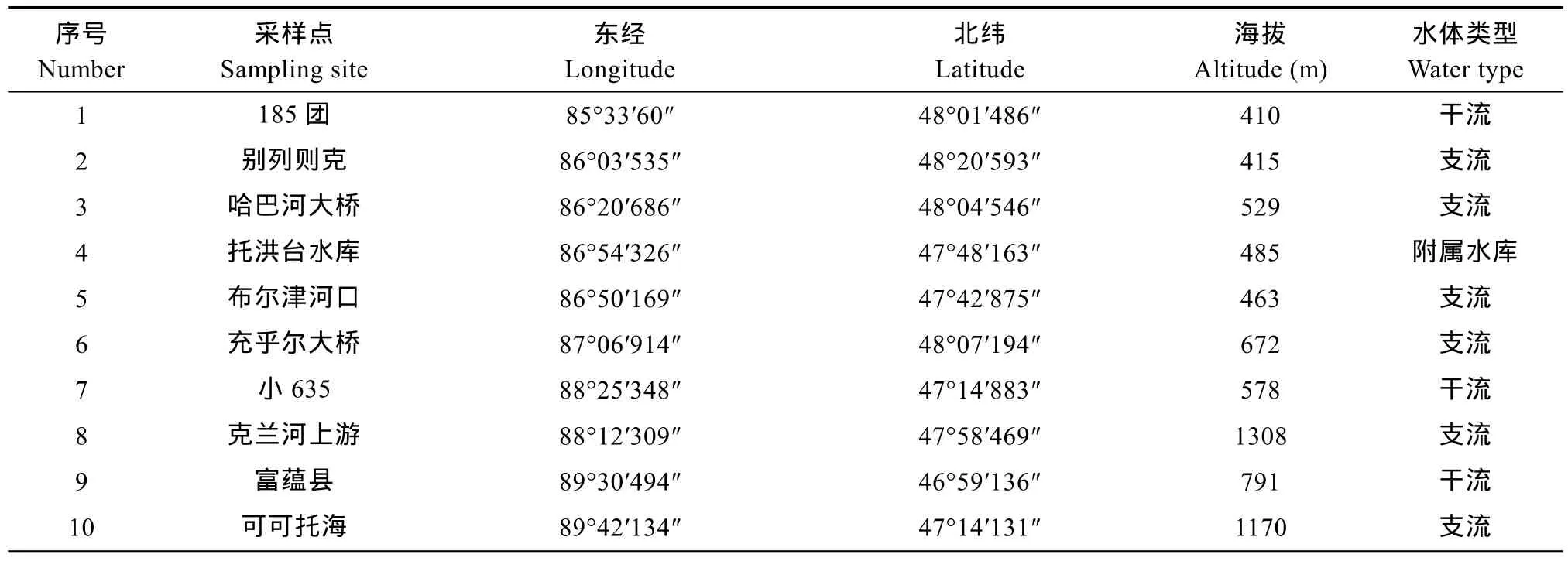
表1 额尔齐斯河采样点分布Tab.1 Sampling sites in the Irtysh River
1.3 周丛藻种类的鉴定与计数
将处理好的样品在×40倍光学显微镜下观察, 用面积为20 mm×20 mm, 容量为0.1 mL计数板对周丛藻类进行计数, 每片计数不得少于300个, 每瓶样品计数2次, 2次计数结果之差应在15%之内, 否则增加计数次数, 有效统计数值取平均后即为该片的周丛藻类数量。每一样品的周丛藻类密度由单位面积上的细胞个体数表示(ind./m2)。藻类的鉴定主要参照《中国淡水藻类》[9]。最后计算出人工基质上每种着生藻类的相对丰度(用百分含量表示) 和每个采样点的藻密度。生物量的测算采用体积换算法[10]。根据周丛藻类的体形, 按最近似的几何形测量其体积,形状特殊的种类分解为几个部分测量, 然后结果相加。由于藻类的密度接近1, 故可以直接由藻类的体积换算成生物量。生物量为各种藻类的数量乘以各自的平均体积, 单位为mg/m2。
1.4 数据处理与统计分析
多样性的分析

式中 Ni为i种的个体数, N为所有种类总个体数, S为物种数。H′ 值0—1为重污, 1—3为中污 (其中1—2为α-中污, 2—3为β-中污), > 3为轻污或无污[14]。
优势种的确定 全年调查周丛藻类的优势种根据每个种的优势度值(Y)来确定:
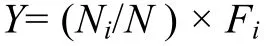
式中, Ni为i种的个体数, N为所有种类总个体数, Fi为第i种出现的频率。Y值大于0.02的种类为全年调查的优势种[15]。
统计分析 多样性指数、优势度的计算均在Excel 2003中完成, 周丛藻类的种类数量、密度、生物量及多样性指数在不同采样季节和采样点之间的差异通过单因子方差分析(One-way ANOVA)进行处理, 密度和与环境因子(水温、水深、透明度、流速、pH、盐度)的相关性分析用偏相关分析(Pearson-Correlation)处理。差异水平设置为P=0.05和P=0.01。统计分析软件为SPSS 19.0, 图表的绘制均在Origin 8.0中进行。
2 结果
2.1 种类组成与优势种
光程倍增光纤陀螺的偏振误差,可分为振幅型和强度型.本文主要考虑偏振环行器的插入带来的偏振误差.由于偏振合束器由晶体、转置器和尾纤组成,所以可将晶体与转置器以及转置器与尾纤之间的耦合点视为一个耦合点,在图1中用点A、B、C、D、E、F来表示;a、b、c、d、e、f分别为对应转置器的耦合尾纤中的串扰点.设经Y波导后输入偏振环行器的顺(CW)、逆(CCW)时针光束与分别沿平行偏振轴与垂直偏振轴方向传输,考虑到实验所用的Y波导消光比ε达50 dB以上,所以本文仅考虑波列.光路中耦合点的功率串扰系数统一表示为ρ,偏振环行器损耗幅值系数与线圈损耗功率系数分别为α、γ.
当前研究的采样点涵盖了额尔齐斯河干流、支流及其附属水体(表1)。在10个样点所采得的周丛藻,共检查到硅藻门(Bacillariophyta)、蓝藻门(Cyanophyta)、绿藻门(Chlorophyta)、黄藻门(Cryptophyta)、裸藻门(Euglenophyta) 、甲藻门(Pyrrophyta)和金藻门(Chrysophyta)等7个门类, 共计70属178种。其中硅藻、绿藻和蓝藻的数量占到了93.8%, 以硅藻的种类数最多, 为92种占51.7%; 其次是绿藻有49种占30.3%; 蓝藻的种类数位居第3, 20种占11.8%; 黄藻3种占1.7%, 裸藻5种占2.8%; 金藻2种占1.1%, 甲藻仅1种占0.6%。
从周丛藻种类的时间分布来看, 8月份最多为95种, 其次为10月份和7月份, 分别为65种和50种, 三个季节间的种类数差异极其显著(P= 0.006)。从周丛藻在各水域的分布来看, 7月以富蕴、克兰河、布尔津、小635最多, 分别为26种、18种、17种、17种; 8月份以185团、充乎尔和克兰河最多, 分别为35种、35种、30种; 10月份185团、富蕴、别列则克最多, 分别为29种、26种和22种, 相比于8月份有所下降。
调查期间, 7月份的优势种为硅藻门的嗜盐舟形藻、椭圆舟形藻、短小舟形藻、极小舟形藻、弧形峨眉藻、双头菱形藻以及蓝藻门的两栖颤藻。8月份的优势种为硅藻门的嗜盐舟形藻、近缘桥弯藻、胡斯特桥弯藻、扁圆卵形藻、钝脆杆藻和蓝藻门的皮状席藻。10月份优势种为硅藻门的弧形峨眉藻、钝脆杆藻、嗜盐舟形藻、极小桥弯藻和蓝藻门的阿式颤藻, 3个月份均出现的优势种为嗜盐舟形藻。7月份的优势种中硅藻占 85.7%, 硅藻中的椭圆舟形藻出现频率为86%, 8月份和10月份优势种中蓝藻门的比例虽有所增加, 但硅藻仍占绝对优势。
2.2 周丛藻类的密度与生物量
2012年 7、8、10月份新疆额尔齐斯河流域周丛藻密度各门平均总计 1105.5 ind./mm2, 其中硅藻门最多(858.5×106ind./m2)占 77.7%; 绿藻门次之(123.3×106ind./m2)占11.2%; 蓝藻门114.5×106ind./m2,占10.4%; 黄藻门5.4×106ind./m2, 占0.5%; 裸藻门3.2×106ind./m2占 0.3%, 金藻门和甲藻门均为 0.3× 106ind./m2, 各占0.03% 。
由于各支流水域环境不同, 因而周丛藻的密度在各水域分布也不同。由图 1可知哈巴河最多(3204.9×106ind./m2), 其次是充乎尔、托洪台水库、小 635, 分别为 1934.2×106、1532.1×106和 1274.9× 106ind./m2, 富蕴最低为 106.6×106ind./m2。各支流7、8和10月的密度分布差异不显著(P>0.05), 总的趋势是7月密度最大, 10月最小。7月以托洪台水库、小635、别列则克、哈巴河为高, 分别为2790.3×106、2535.8×106、2012.7×106和1181.0×106ind./m2, 富蕴最低为 159.0×106ind./m2; 8月份哈巴河最高为8106.8×106ind./m2, 小635最低位14.1×106ind./m2; 10月份布尔津最高为3083.3×106ind./m2, 富蕴最低为102.0×106ind./m2。
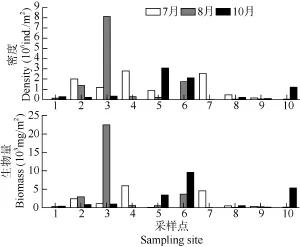
图1 额尔齐斯河周丛藻密度和生物量分布Fig. 1 The distribution of periphyton density and biomass in Irtysh River
调查期间, 额尔齐斯河周丛藻生物量各门平均总计 2692.0 mg/m2。其中硅藻门最多(2383.2 mg/m2)占 88.5%, 绿藻门次之(228.9 mg/m2)占 8.5%, 蓝藻门(64.4 mg/m2)占2.4%, 裸藻门(6.3 mg/m2)占0.2%,黄藻门(5.4 mg/m2)占0.2%, 金藻门和甲藻门分别为3.1 mg/m2、0.7 mg/m2, 共占0.1%。
从图 3可知, 7月份托洪台水库的生物量最高(5909.9 mg/m2), 布尔津河最低(45.4 mg/m2); 8月哈巴河最高(22475 mg/m2), 小635最低(26.2 mg/m2); 10月份可可托海最高(5332.1 mg/m2), 富蕴最低(134.2 mg/m2),三个月份间的生物量差异不显著(P>0.05)。
2.3 多样性指数
额尔齐斯河周丛藻 7、8、10月份 Shannon-Wiener多样性指数(H′)、Simpson多样性指数(D)、Pielou均匀度指数(J)和 Margalef丰富度指数(d)的数值见图2。其中Shannon-Wiener多样性指数(H′)、Simpson多样性指数(D)和 Pielou均匀度指数(J)的变化范围分别为 0.42—4.34、0.06—0.96 和0.10—0.97, 多样性指数、丰富度和均匀度在3个月份间均存在显著性差异, P值均小于0.05。
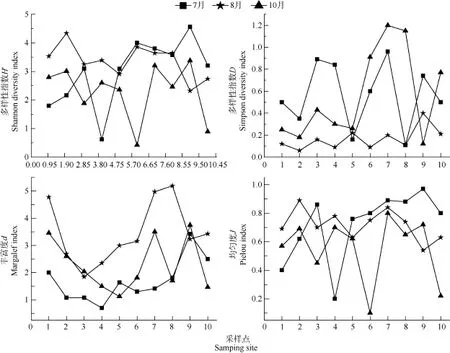
图2 额尔齐斯河周丛藻多样性指数(D, H′)、丰富度(d)和均匀度(J)Fig. 2 Diversity indices (D, H′), abundance (d) and evenness (J) of Periphyton in Irtysh River
3 讨论
3.1 不同月份的周丛藻类群落结构比较
2012年7、8、10月在新疆额尔齐斯河流域的10个样点中共采集到了周丛藻类7门178属, 其中硅藻的种类数最多。硅藻在优势种中也占据绝对的优势, 7月份的优势种中硅藻占85.7%, 硅藻中的椭圆舟形藻出现频率为86.0%, 8月份和10月份优势种中蓝藻门的比例虽有所增加, 但硅藻仍占绝对优势,这是由于额尔齐斯河属于高纬度、高寒温地区, 水体水温存在典型的季节变化, 因此周丛藻出现了以硅藻为优势的类群。
周丛藻类的平均密度为 1105.5×106ind./m2, 各个支流在 7、8和 10月的密度分布差异不显著(P>0.05), 总的趋势是7月密度最大, 10月最小, 这是由于 7月份刚进入夏至, 昼长夜短, 新疆白天长达 20h[2], 而光照可以影响周丛藻生物量和周丛群落的初级生产力[16], 同时 7月份的温度升高, 有利于周丛藻类的生长繁殖, 因此 7月份的周丛藻密度最大。
大量研究已证明, 周丛藻类群落特征, 如生物量[17]和种类组成[18]等能对水质变化作出响应, 从而可作为评价河流受污染程度和受人类活动干扰程度的重要生物监测指标。周丛藻的生物量在7、8、10月由于环境及水文条件的不同而发生波动。7月份托洪台水库的生物量最高(5909.9 mg/m2), 远远高于其他支流的生物量, 这主要是由于托洪台水库受人类活动产生的污染输入的影响, 导致水库水体N、P含量高, 蓝绿藻大量繁殖所致。8月份由于是丰水期, 水位上涨, 水体浑浊不利于周丛藻类的繁殖[7], 因此8月份的周丛藻生物量低于7月份。值得注意的是, 在所有采样点中哈巴河大桥在8月份的密度和生物量均最高, 而且远高于7月份和10月份, 这是由于哈巴河大桥地处下游的高海拔地区, 未被 8月份上涨的洪水淹没因此有大量的营养物质滞留, 同时随着水温的升高和光照时间增长, 促进了大量的富营养型指示物种(鱼腥藻和微囊藻)的生长, 藻类的大量繁殖推高周丛藻类的丰富度(密度和生物量)。
3.2 周丛藻类群落结构的空间变化
额尔齐斯河流域的周丛藻类种类数的分布虽随季节变化而有显著性差异(P<0.01), 但在空间分布上, 不同采样点间的差异并不显著(P>0.05), 而硅藻始终作为藻类群落的主要种类, 上游区域藻类的优势度和群落多样性均较高。整个水体除硅藻、绿藻和蓝藻的比例基本保持一致外, 金藻和裸藻的群落数量仅在河流中上游地区表现出增长趋势。
已有研究报导表明, 水温、溶解氧、营养盐及其他水文因子是影响河流中周丛藻类群落长期季节变化的主要因子[19,20]。调查期间额尔齐斯河周丛藻类密度和生物量的空间分布差异均不显著, 但其总的分布趋势是中下游地区高于上游地区, 这与采样点处水温的变化趋势相一致(表2)。由额尔齐斯河各采样点的理化因子与丰度的相关性分析得出, 以P=0.05为标准时, 丰度与水温、盐度均成显著性相关(P<0.05, 表 3)。同时密度也与营养盐成正相关,这表明, 水温和营养盐是影响额尔齐斯河周丛藻类空间分布的主要因素。

表2 额尔齐斯河各采样点的理化因子Tab. 2 The environment metrics of different sampling sites in Irtysh River
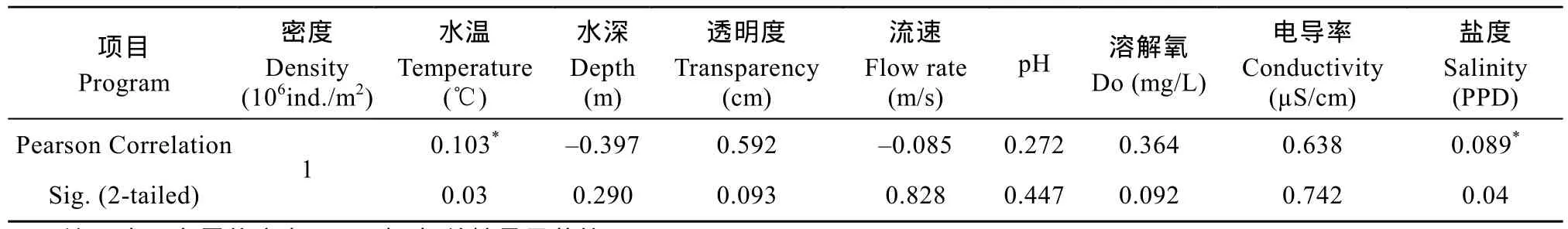
表3 周丛藻类密度与环境因子的相关性Tab. 3 The correlation between periphyton density and environment factors
3.3 周丛藻类的群落结构与水质的关系
物种多样性是衡量群落规模和重要性的基础,也是反映水体营养状况信息的重要参数[21,22]。因而,周丛藻类的多样性指数也就成为判断湖泊水库等水体营养状况最常用的检测指标。藻类多样性指数值越小, 说明水质污染程度越严重[23]。在水质较好的上游, 周丛藻类群落结构较复杂, 多样性指数高;而在人为活动较频繁的别列克则铜矿桥和托洪台水库, 周丛藻类群落表现出种类组成相对单一, 藻类多样化性出现下降的趋势。
多样性指数(D、H′)表现出相似的变化趋势(图2): 相比于7和10月, 8月的多样性指数值最低。一般而言, 种类越多或各个种类的个体数量分布越均匀,物种群落的Shannon-Wiener多样性指数(H′)的值越大[16,24], 而8月份的种类数最多, 由于均匀度反映的是群落内各物种分布的均匀程度[17], 那么夏季较低的均匀度可能是引起多样性指数低的主要原因之一。同时Shannon-Wiener多样性指数(H′)越大表明水质越好, 这与额尔齐斯河的8月份丰水期, 水质浑浊的自然条件相一致[2]。
额尔齐斯河周丛藻 Margalef丰富度指数(d)的变化范围为0.7—5.19。就总体而言, 各流域在8和10月的物种丰富度变化趋势基本相似, 仅在个别采样点略有差异。同一采样点8月的物种丰富度高于7和10月。8月温度适宜, 阳光照射充足, 适宜周丛藻的生长, 这可能是周丛藻丰富度在8月份增多的主要原因。
对调查期间额尔齐斯河各样点周丛藻的多样性进行分析, 结果显示除了人为活动频繁的可可托海和托洪台水库外, H′的平均值为3.04, 故判断额尔齐斯河整体上属于轻污染类型河流。比较各采样点处的H′值发现, 虽然各H′值之间略有差异, 但差值并不显著。由此说明, 除了个别受人为影响的流域之外, 额尔齐斯河各样点的水质营养状况整体水平相当。
[1] Xinjiang Geographic Society. Xinjiang Geography Manual [M]. Urumqi: Xinjiang People Press. 1983, 90—98 [新疆地理学会. 新疆地理手册. 乌鲁木齐: 新疆人民出社. 1983, 90—98]
[2] Li D Z. Watershed hydrological characteristics of Irtysh River [J]. Hydrologic, 1999, (3): 54—56 [李定枝. 额尔齐斯河流域水文特性. 水文, 1999, (3): 54—56]
[3] Ren M L. Fishes and fish fauna composition in Ergis River, China [J]. Arid Zone Research, 2002, 19(2): 62—66 [任慕莲.我国额尔齐斯河的鱼类及鱼类区系组成. 干旱区研究, 2002, 19(2): 62—66]
[4] Liu J K. Advanced Hydrobiology [M]. Beijing: Science Press. 1999, 260—261 [刘建康. 高级水生生物学. 北京:科学出版社. 1999, 260—261]
[5] Yin X W, Zhang Y, Qu X D, et al. Community structure and biological integrity of periphyton in Hunhe River water system of Liaoning Province, Northeast China [J]. Chinese Journal of Applied Ecology, 2011, 22(10): 2732—2740 [殷旭旺, 张远, 渠晓东, 等. 浑河水系着生藻类的群落结构与生物完整性. 应用生态学报, 2011, 22(10): 2732—2740]
[6] Hong S, Chen J S. Structure characteristics of aquatic community from the main rivers in China [J]. Acta Hydrobiologica Sinica, 2002, 26(3): 295—305 [洪松, 陈静生. 中国河流水生生物群落结构特征探讨. 水生生物学报, 2002, 26(3): 295—305]
[7] Jiang Z F, Zhang L R, Zhao W, et al. Community structure of phytoplankton in the branches of Xinjiang Ertix River [J]. Chinese Journal Fisheries, 2009, 22(4): 36—41 [姜作发, 张丽荣, 赵文, 等. 新疆额尔齐斯河支流浮游植物种群结构特征. 水产学杂志, 2009, 22(4): 36—41]
[8] National Environmental Protection Agency《 Aquatic Monitoring Handbook》 Editorial Committee. Aquatic Monitoring Handbook [M]. Nanjing: Northeastern University Press. 1993, 19—23 [国家环保局《水生生物监测手册》编委会. 水生生物监测手册. 南京: 东南大学出版社. 1993, 19—23]
[9] Hu H J, Wei Y X. The Freshwater Algae of China. Systematics, Taxonomy and Ecology [M]. Beijing: Science Press. 2006, 27—915 [胡鸿钧, 魏印心. 中国淡水藻类一系统、分类及生态. 北京: 科学出版社. 2006, 27—915]
[10] Zhang Z S, Huang X F. Study Methods of Freshewater Plankton [M]. Beijing: Science Press. 1991, 340–344 [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社. 1991, 340—344]
[11] Shannon C E, Weaver W.The Mathematical Theory of Communication [M]. Berkeley: University of California Press. 1949, 1—144
[12] Margal EF R. Information theory in ecology [J]. International Journal of General Systems, 1958, 3: 36—71
[13] Pielou E C. Ecological Diversity [M]. New York: Wiley. 1975, 1—165
[14] Guan Y Q, Guo Y X, Li B, et al. Phytoplankton community character and water quality assessment of Juma River [J]. Journal of Hebei University (Natural Science Edition), 2007, 27(4): 401—406 [管越强, 郭云学, 李博, 等. 拒马河浮游植物群落特征及水质评价. 河北大学学报(自然科学版), 2007, 27(4): 401—406]
[15] Wang Y L, Yuan J, Shen X Q. Ecological character of phytoplankton in spring in the Yangtze River estuary andadjacent waters [J]. Journal of Fishery Sciences of China, 2005,12(3): 300—306 [王云龙, 袁骥, 沈新强. 长江口及邻近水域春季浮游植物的生态特征. 中国水产科学, 2005, 12(3): 300—306]
[16] Guo P Y, Shen H T, Liu A C, et al. The species composition, community structure and diversity of zooplankton in Changjiang estuary [J]. Acta Ecologica Sinica, 2003, 23(5): 892—900 [郭沛涌, 沈焕庭, 刘阿成, 等. 长江河口浮游动物的种类组成、群落结构及多样性. 生态学报, 2003, 23(5): 892—900]
[17] Biggs B J F. Biomonitoring of organic Pollution using Periphyton, South Branch, Canterbury; New Zealand [J]. Journal of Marine and Freshwater Research, 1989, 23: 263—274
[18] Lowe R L. Periphyton Patterns in Lakes. In: Stevenson R J, Bothwell M L, Lowe R L (Eds.), Algal Ecology: Freshwater Benthic Ecosystems [M]. New York: Academic Press. 1996, 57—76
[19] Reilly J F, Horne A J, Miller C D. Nitrate removal from a drinking water supply with large free-surface constructed wetlands prior to groundwater [J]. Ecological Engineering, 2000, 14: 33—47
[20] Dai G Y, Li J, Li L, et al. The spatio-temporal pattern of phytoplankton in the north basin of lake Dianchi and related environmental factors [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 946—956 [代龚圆, 李杰, 李林, 等. 滇池北部湖区浮游植物时空格局及相关环境因子. 水生生物学报, 2012, 36(5): 946—956]
[21] Zhang H F, Chen Y N, Chen Y P, et al. Species quantity change and ecosystem dynamics in the lower reaches of Tarim River [J]. Chinese Journal of Ecology, 2004, 23(4): 21—24 [张宏峰, 陈亚宁, 陈亚鹏, 等. 塔里木河下游植物群落的物种数量变化与生态系统动态研究.生态学杂志, 2004, 23(4): 21—24]
[22] Sun Z Q, Shi X L, Xu L L, et al. The protozoan community structure and its response to the change of water quality in a typical wetland landscape in summer [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 290—299 [孙志强, 施心路, 徐琳琳, 等. 景观湿地夏季原生动物群落结构与水质关系. 水生生物学报, 2013, 37(2): 290—299]
[23] Wang X H, Ji B C, Li M D, et al. Phytoplankton and bio-assessment of water quality in upper waters of Yinluan Project [J]. Research of Environmental Sciences, 2004, 17(4): 18—24 [王新华, 纪炳纯, 李明德, 等. 引滦工程上游浮游植物及其水质评价. 环境科学研究, 2004, 17(4): 18—24]
[24] Li K Z, Yin J Q, Huang L M, et al. Dynamic variations of community structure and quantity of zooplankton in Zhujiang River estuary [J]. Journal of Tropical Oceanography, 2005, 24(5): 60—68 [李开枝, 尹健强,黄良民, 等. 珠江口浮游动物的群落动态及数量变化.热带海洋学报, 2005, 24(5): 60—68]
STUDIES ON THE COMMUNITY STRUCTURE OF PERIPHYTON IN THE IRTYSH RIVER OF XINJIANG UYGUR AUTONOMOUS REGION
Periphyton acts as the primary basal food resource of indigenous and unique fishes in the cross-border rivers of Xinjiang Uygur Autonomous Region. Research of the periphyton in this region is still limited. To investigate the community structure of periphyton, samples were collected in July, August and October 2012 from Irtysh River located in Xinjiang Uygur Autonomous Region. Our study indicated that the periphyton assemblage was composed of 178 species in total, belonging to seven taxonomic groups. Bacillariophyta showed the highest number of taxa (92), followed by Chlorophyta (49), Cyanophyta (20), Euglenophyta (5), Cryptophyta (3), Chrysophyta (2) and Pyrrophyta (1). Species number of periphyton showed significantly differences in different seasons (P<0.01). Bacillariophyta was predominant in species composition, especially N. halophila, Fragilaria capucina, C. perpusilla and Phormidium corium Gom. The average cell density and biomass of periphyton were 1105.5 ind./m2and 2692.0 mg/m2, respectively. Although seasonal and spatial distribution of density and biomass were not significant difference, the overall trend of spatial distribution showed that the density and biomass in lower-middle region were higher than those in upper region. Average values of diversity indices (D, H′), evenness (J) and abundance (Dm) of periphyton were 0.38, 3.04, 0.66 and 2.55, respectively. The water quality of Irtysh River has mild contamination based on the diversity index and phytoplankton abundance.
Periphyton; Community structure; Abundance; Diversity indices; Water quality evaluation; Irtysh River
LI Jun1,2, ZHOU Qiong1,2, XIE Cong-Xin1,2, WANG Jun1,2and WEI Li-Li1,2
(1. Key Laboratory of Freshwater Animal Breeding, College of Fishery, Ministry of Agriculture, Huazhong Agricultural University, Wuhan 430070, China; 2. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
S932.7
A
1000-3207(2014)06-1033-07
10.7541/2014.152
2013-10-11;
2014-02-12
国家科技基础性工作专项“新疆跨境河流水生生态和鱼类资源调查(2012FY112700)”; 中央高校基本科研业务费专项资金(2010QC024)资助
李君(1989—), 女, 湖北黄冈人; 硕士; 主要从事重金属污染及藻类生态学研究。E-mail: kele8happy@webmail.hzau.edu.cn
周琼(1978—), 男, 湖北浠水人; 博士、副教授; 主要从事渔业资源与淡水生态学研究。E-mail: hainan@mail.hzau.edu.cn

