利用种群增长研究镜湖夏季萼花臂尾轮虫对水温的适应
王 敏 席贻龙 周 彬 张 烨
(安徽师范大学生命科学学院, 安徽省高校生物环境与生态安全省级重点实验室, 芜湖 241000)
利用种群增长研究镜湖夏季萼花臂尾轮虫对水温的适应
王 敏 席贻龙 周 彬 张 烨
(安徽师范大学生命科学学院, 安徽省高校生物环境与生态安全省级重点实验室, 芜湖 241000)
运用种群增长实验方法, 在4个温度(20℃、24℃、28℃和32 )℃和3个斜生栅藻[Scenedesmus obliquus (Turpin) Kuetzing]密度(1.0×106、2.0×106和4.0×106cells/mL)共12个条件组合下研究了镜湖夏季出现的萼花臂尾轮虫(Brachionus calyciflorus Pallas)的种群增长率、平均混交率、平均受精率和休眠卵产量等生殖参数。结果表明, 在各食物密度下, 轮虫种群增长率均在 28℃和 32℃下最高。平均混交率、平均受精率和休眠卵产量等与温度间的关系因食物密度的不同而异。温度对种群增长率、平均混交率、平均受精率和休眠卵产量均有极显著性影响(P<0.01), 食物密度对种群增长率和休眠卵产量均有极显著性影响(P<0.01), 温度和食物密度的交互作用对平均混交率、平均受精率和休眠卵产量均有极显著性影响(P<0.01)。在1.0×106、2.0×106和4.0×106cells/mL的斜生栅藻密度以及28℃和32℃下, 轮虫具有较高的种群增长率(1.50—1.95/d)表明该种群能够适应较高的水温, 水温不是导致其在夏季水体中具有极低的种群密度(远低于1个/L)的直接因素。在种群存在于镜湖水体期间(7月初至12月初), 特别是当水温降至20℃左右时, 其较高的休眠卵产量为该种群在次年的同一时段在水体中重新出现提供了保证。
萼花臂尾轮虫; 斜生栅藻密度; 温度; 生殖参数
轮虫是各类水体中广泛分布的一类浮游动物,在水生态系统的结构组成、物质循环和能量流动过程中具有重要的作用。由于水环境中的物理 、化学和生物因子等普遍具有随着时间的流逝或季节的更替而发生变化的特点, 栖息于其中的轮虫种群密度也随之发生变化。为探明自然水体中轮虫种群数量的时空变动及其调节机制, 众多学者作出了不懈地努力。温新利[1]曾以芜湖市汀棠湖中的萼花臂尾轮虫等为对象, 研究了其种群数量的周年变动, 探讨了水温、Chl.a浓度、捕食者密度等外源性因素对种群数量周年变动的影响; 但尚未涉及轮虫种群对特定环境的适应性等内源性因素。王爱民等[2]利用生命表统计学方法研究了汀棠湖冬季出现的萼花臂尾轮虫对水温的适应, 发现其种群在16℃下的净生殖率和种群内禀增长率均最高, 推测这或许是该水体中萼花臂尾轮虫种群密度在3月中旬(此时水温为17 )℃达到春季最高峰的重要原因之一。种群增长率通常被认为是种群的短期适合度指标, 它代表种群在特定环境下的增殖能力[3]; 休眠卵产量是种群的长期适合度指标, 因为休眠卵是种群度过不利环境条件的唯一途径[4,5], 因此, 通过研究种群增长率和休眠卵产量等可以揭示种群对特定环境条件的适应,帮助我们理解种群变动的内源性机制。
镜湖为一亚热带小型浅水湖泊, 平均水深为1.3 m, 水域面积约0.079 km2, 处于富营养化初期阶段。镜湖主要为公园景观水域, 水体中有鱼类的分布; 但常年缺乏枝角类和桡足类, 且大型浮游植物也偏少[6]。该湖位于芜湖市中心, 市区年平均温度约16 , ℃ 最高温度为41 , ℃ 最低温度为–15℃。在湖泊内, 萼花臂尾轮虫主要出现于冬春季, 而夏秋季几近消失(种群密度远低于1个/L)[1]。夏季, 水温的波动范围在28—33℃。为了解镜湖夏季出现的萼花臂尾轮虫对水温的适应性, 探讨温度对其种群在夏季几近消失的可能作用, 本文研究了温度和食物密度对镜湖夏季水体中出现的萼花臂尾轮虫生殖参数的影响。
1 材料与方法
1.1 轮虫的采集与培养
实验用萼花臂尾轮虫于2011年7月3日—8月13日用25号浮游生物网自芜湖市镜湖水体中大范围拖捞获得。在此期间, 水温的变动范围为28—33℃。采样后, 实验室内解剖镜下随机挑取萼花臂尾轮虫非混交雌体, 于(25±1)℃、自然光照[光照强度约1300 µmol/(m2·s)]条件下进行克隆培养。培养液为新鲜配制的轮虫培养液[7], 食物为HB-4培养基[8]培养的、处于指数增长期的斜生栅藻, 投喂密度为2.0×106cells/mL。藻培养期间, 每天添加20%的HB-4培养液以保持其处于指数增长期; 使用前, 经4500 r/min离心7min浓缩, 并采用浮游植物计数框于显微镜下计数。从最终建立的轮虫克隆中随机选取4个克隆用于本实验研究。
1.2 轮虫的生殖参数研究
实验参照夏季自然水温的波动范围, 将温度设计为20℃、24℃、28℃和32℃等4个温度。同时, 考虑到与水温变化密切相关的藻类等食物所产生的上行效应也可能是影响轮虫种群密度季节变动的重要因素, 而处于轻度富营养状态的镜湖水体中藻类和有机碎屑等轮虫食物较为丰富[1], 将食物密度设计为1.0×106、2.0×106和4.0×106cells/mL等3个斜生栅藻密度。在实验前, 将每个轮虫克隆分别置于20℃、24℃、28℃和32℃等4个温度以及1.0×106、2.0×106和4.0×106cells/mL等3个斜生栅藻密度下进行为期一周的预培养。在预培养时, 以直径为1 cm、长度为12 cm的玻璃试管为容器, 培养体积为5 mL。在预培养过程中, 每天更换轮虫培养液并投喂藻类食物一次, 同时通过去除一部分个体使得轮虫种群始终处于指数增长期。
在实验开始时, 从每个克隆中挑取 100个以上携卵的非混交雌体置于试管中继续培养。4h后, 从各试管中挑取龄长在 4h以内的幼体于玻璃杯中继续培养, 待其产出第一枚非混交卵时接种至玻璃试管内开始实验, 接种密度为 2 ind./mL, 培养液体积为5 mL。在实验过程中, 每12h轻轻吹浮沉积于试管底部的藻类食物; 每 24h对培养液中轮虫各类型雌体计数1次, 并投喂饵料。待种群密度较大时, 采用抽样计数, 用玻璃微吸管将培养液轻轻搅匀后,从试管的3个不同部位于水体中部吸取(0.5—2) mL的培养物进行计数。雌体类型的划分和鉴定与席贻龙和黄祥飞[9]相同。
1.3 相关参数的定义和计算方法
种群增长率: r=(lnNt–lnN0)/t, N0为起始轮虫密度, 为2 ind./mL; Nt为试验进行到t天时的轮虫种群密度; t为试验进行的天数。根据Dumont等[10]的方法, 从轮虫种群的指数增长期选取4—6个数据计算种群增长率并最终获得每个实验重复的平均值。
混交雌体百分率: 种群中的混交雌体数占总雌体数的百分比, 本文使用的是试验期间每日混交雌体百分率的平均值; 混交雌体受精率: 种群中产休眠卵的混交雌体数占总混交雌体数的百分比, 本文使用的是试验期间每日混交雌体受精率的平均值;休眠卵产量: 5 mL培养液中的轮虫在4d内所产的休眠卵数量。
1.4 数据的统计分析
采用SPSS 16.0统计分析软件对上述数据进行统计分析。对所得的各生殖参数进行正态分布检验后, 对符合正态分布的数据进行单因素和双因素方差分析以揭示温度和食物密度对轮虫各生殖参数的影响, 应用 LSD检验法对同一温度下各食物密度间、同一食物密度下各温度间有统计学意义(P<0.05)的轮虫各生殖参数的均值间作多重比较。
2 结果
由图1可见, 在各温度下, 轮虫总雌体密度的最大值随着培养温度的升高而增大; 产雄卵的混交雌体密度的最大值也随着培养温度的升高而呈现增大的趋势, 24℃除外; 在20℃和28℃下, 产休眠卵的混交雌体密度的最大值也随着培养温度的升高而呈现增大的趋势。在各食物密度下, 轮虫总雌体密度的最大值出现在 28℃; 产雄卵的混交雌体密度的最大值出现在 32℃; 产休眠卵的混交雌体密度的最大值出现在20℃, 1.0×106cells/mL食物密度下除外。
单因素方差分析表明, 在1.0×106cells/mL食物密度下, 温度对轮虫种群增长率、平均混交率和平均受精率均有极显著的影响(P<0.01), 但对休眠卵产量无显著影响(P>0.05); 在 2.0×106和 4.0×106cells/mL食物密度下, 温度对轮虫种群增长率、平均混交率、平均受精率和休眠卵产量均有极显著的影响(P<0.01)。多重比较显示, 在各食物密度下, 轮虫种群增长率随着温度的升高而增大, 但28℃和32℃间无显著的差异。在1.0×106cells/mL食物密度下, 平均混交率在20℃和24℃显著低于32 , ℃ 但28℃的平均混交率与其他三温度间无显著的差异; 平均受精率在24℃和28℃最高, 32℃最低。在2.0×106cells/mL食物密度下, 平均混交率在20℃最高, 24℃显著低于32 , ℃ 而28℃的平均混交率与24℃和32℃间均无显著的差异; 平均受精率在 20℃、24℃和 28℃较高, 32℃较低; 休眠卵产量在 20℃较高, 其他三个温度下较低。在 4.0×106cells/mL食物密度下, 平均混交率在 20℃最高, 其他三个温度间均无显著的差异;平均受精率在20℃和24℃最高, 32℃最低; 休眠卵产量在20℃较高, 其他三个温度下较低(表1)。
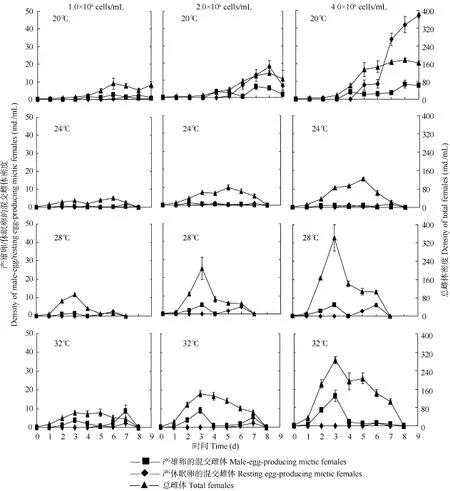
图1 温度和食物密度对镜湖夏季萼花臂尾轮虫种群中产雄卵的混交雌体密度、产休眠卵的混交雌体密度和总雌体密度的影响Fig. 1 The effects of four temperatures and three food concentrations on the density of male-egg-producing mictic females, resting egg-producing mictic females and total females in B. calyciflorus populations from Lake Jinghu
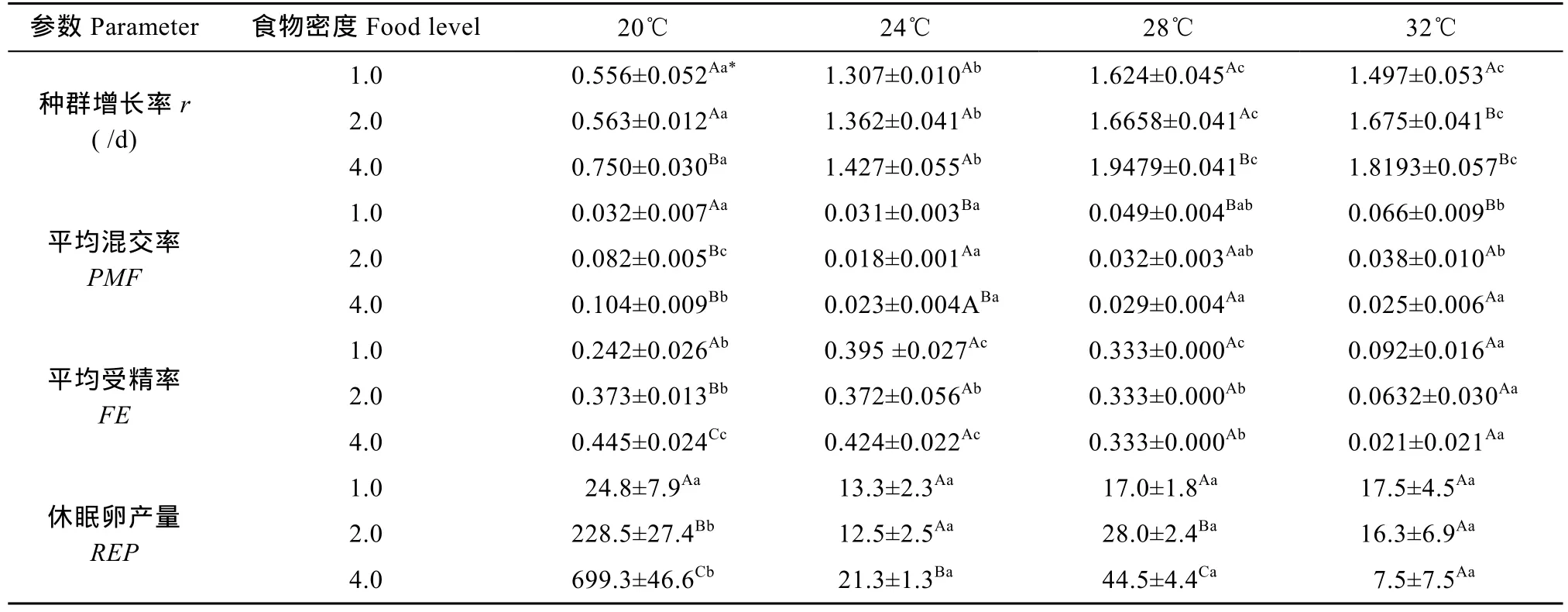
表1 四个温度和三个食物密度(×106cells/mL)下萼花臂尾轮虫的种群增长率、平均混交率、平均受精率和休眠卵产量(均数±标准误)Tab. 1 Population growth rate (r), average proportion of mictic females (PMF), average fertilization rate of mictic females (FR), and resting egg production (REP) of B. calyciflorus at four temperatures and three food levels (Mean±SE)
在 20℃下, 食物密度对种群增长率、平均混交率、平均受精率和休眠卵产量有极显著影响(P<0.01);在 24℃下, 食物密度对种群增长率和平均受精率无显著影响(P>0.05), 而对平均混交率和休眠卵产量有显著影响(P<0.05); 在 28℃下, 食物密度对种群增长率、平均混交率和休眠卵产量有极显著影响(P<0.01), 而对平均受精率无显著的影响(P>0.05);在 32℃下, 食物密度对种群增长率和平均混交率均有显著影响(P<0.05), 但对平均受精率和休眠卵产量无显著影响(P>0.05)。多重比较显示, 在 20℃下,轮虫种群增长率在1.0×106和2.0×106cells/mL食物密度下较低, 4.0×106cells/mL食物密度下较高; 平均混交率在 1.0×106cells/mL 食物密度下较低, 2.0×106和4.0×106cells/mL食物密度下较高; 平均受精率和休眠卵产量均随着食物密度的升高而升高。在24℃下, 平均混交率在1.0×106cells/mL食物密度下显著高于 2.0×106cells/mL食物密度下, 而 4.0× 106cells/mL食物密度下的平均混交率与 1.0×106和2.0×106cells/mL食物密度间均无显著的差异; 休眠卵产量在1.0×106和2.0×106cells/mL食物密度下较低, 4.0×106cells/mL食物密度下较高。在28℃下, 轮虫种群增长率在1.0×106和2.0×106cells/mL食物密度下较低, 4.0×106cells/mL食物密度下较高; 平均混交率在1.0×106cells/mL食物密度下较高, 2.0×106和 4.0×106cells/mL食物密度下较低; 休眠卵产量随着食物密度的升高而升高。在 32℃下, 轮虫种群增长率在1.0×106cells/mL较低, 2.0×106和4.0×106cells/mL食物密度下较高; 平均混交率在1.0×106cells/mL食物密度下较高, 2.0×106和4.0×106cells/mL食物密度下较低(表1)。
双因素方差分析表明, 温度对种群增长率、平均混交率、平均受精率均和休眠卵产量均有极显著性影响(P<0.01), 食物密度对群增长率和休眠卵产量均有极显著性影响(P<0.01), 温度和食物密度的交互作用对平均混交率、平均受精率和休眠卵产量均有极显著性影响(P<0.01)(表2)。
3 讨 论
3.1 轮虫种群对水温的适应
已有研究结果表明, 轮虫种群增长率对升高的温度的反应因轮虫种类的不同而异。哈瓦那臂尾轮虫(B. havanaensis Ehrenberg)、壶状臂尾轮虫(B. urceolaris Müller)、红臂尾轮虫(B. rubens Ehrenberg)、剪形臂尾轮虫(B. forcatus Wierzejski)和尾突臂尾轮虫(B. caudatus Barrois et Daday)的种群内禀增长率均随着温度的升高而显著升高[11—13]; 但萼花臂尾轮虫种复合体内姐妹种LE9的种群内禀增长率在28℃下最高, 姐妹种HE1的种群内禀增长率在23℃下趋于最高, 姐妹种HE3的种群内禀增长率在23℃和 28℃下最高[14]; 热带龟甲轮虫(Keratella tropica Apstein)的种群内禀增长率在 30℃下最高,曲腿龟甲轮虫(Keratella valga Ehrenberg)的种群内禀增长率在25℃下最高[15]。在1.0×106、3.0×106和5.0×106cells/mL斜生栅藻密度下, 温度对裂足臂尾轮虫的种群内禀增长率均无显著性影响[16]; 在本研究中, 在1.0×106、2.0×106和4.0×106cells/mL斜生栅藻密度下, 镜湖夏季出现的萼花臂尾轮虫种群增长率均在28℃和32℃下最高, 表明该种群适应于较高的水温; 食物密度的升高并不明显地改变其对较高的水温的适应性。
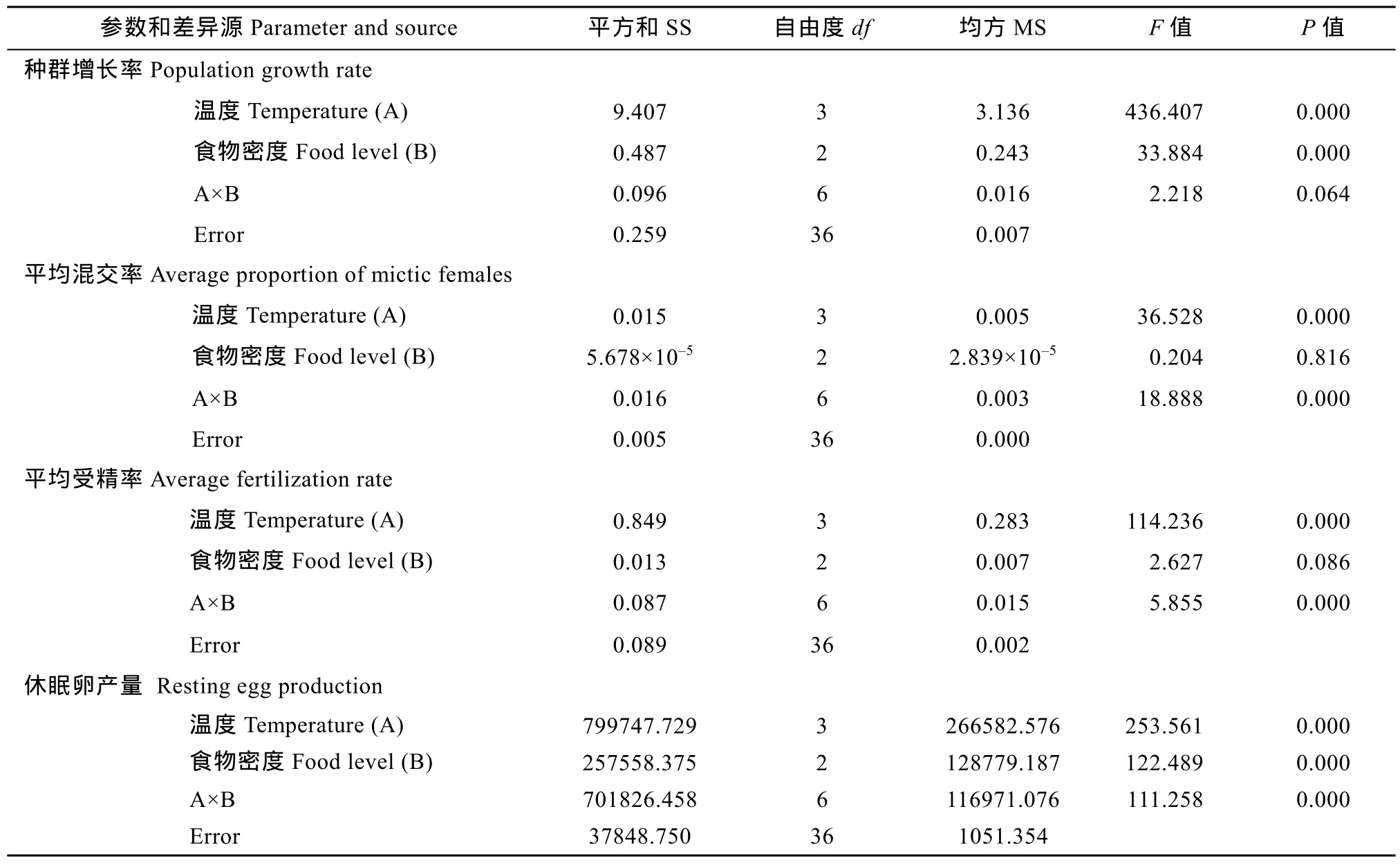
表2 温度和食物密度对萼花臂尾轮虫种群增长率、平均混交率、平均受精率和休眠卵产量的影响(双因素方差分析)Tab. 2 Results of two-way Analysis of variance (ANOVA) performed for population growth rate, average proportion of mictic females and average fertilization rate of mictic females, and resting egg production of B. calyciflorus at four temperatures and three food levels
3.2 轮虫有性生殖对水温变化的响应
混交雌体的产生是轮虫有性生殖的开始, 休眠卵的形成是有性生殖的终结。已有研究结果表明,褶皱臂尾轮虫(B. plicatilis Müller)和萼花臂尾轮虫种群中的混交雌体百分率随着温度的升高而降低[17—20]; 但青岛、芜湖和广州品系的萼花臂尾轮虫种群中的混交雌体百分率不受温度的显著性影响[21];在1.0×106、3.0×106和5.0×106cells/mL斜生栅藻密度下, 裂足臂尾轮虫的后代混交率也均不受温度的显著性影响[16]。本研究结果表明, 萼花臂尾轮虫种群中的混交雌体百分率受温度和食物密度的交互作用。
已有研究结果表明, 温度是影响轮虫休眠卵产量的重要外源性因素, 而遗传因素则是重要的内源性因素。温度对休眠卵产量的影响常因轮虫种类、品系或克隆的不同而异[17,21—24]。本研究结果表明,镜湖夏季出现的萼花臂尾轮虫休眠卵产量不仅受温度的显著性影响, 还受食物密度的显著性影响以及温度和食物密度的显著性交互作用; 轮虫在低温(20 )℃ 和高食物密度(4.0×106cells/mL)下具有较高的休眠卵产量, 对种群度过不利的环境条件具有重要的意义。温新利[1]研究发现, 该种群在镜湖水体中的存在时间为7月初至12月初; 在此阶段, 水温的变动范围为 32—12 ; ℃ 如此长的时间范围内, 特别是当水温降至 20℃左右时, 其较高的休眠卵产量是该种群在次年的同一时段在水体中重新出现的唯一途径。
3.3 影响轮虫种群密度季节变化的因素
种群数量动态及其调节机制始终是轮虫种群生态学研究的核心问题之一。Liu等[25]对2006年3月镜湖水体中出现的萼花臂尾轮虫种群密度及其生殖参数进行研究时发现, 3月28日采自镜湖的萼花臂尾轮虫在接近当时的湖水温度(19 )℃下进行培养时,其种群中的混交雌体百分率高达 55.8%; 当培养温度升高至 25℃时, 种群中的混交雌体百分率达77.2%; 作者推测, 这或许是3月末镜湖萼花臂尾轮虫种群密度急剧下降、4月初种群几乎从湖泊中消失的重要原因。Wen等[6]对镜湖角突臂尾轮虫(B. angularis Gosse)野外种群动态及其影响因素的研究发现, 水温是控制夏-秋季节间该种轮虫种群动态的关键因素, 10月初其种群逐渐消失的主要原因在于温度诱导的较高的混交雌体百分率。王爱民等[2]利用生命表统计学方法研究了汀棠湖冬季出现的萼花臂尾轮虫对水温的适应, 发现其种群在 16℃下的净生殖率和种群内禀增长率均最高, 推测这或许是该湖泊中萼花臂尾轮虫种群密度在3月中旬(此时水温为 17 )℃达到春季最高峰的重要原因之一。至于 4月初(此时水温为 18 )℃该种轮虫的种群密度降至较低水平的原因, 则与在此之前水温等环境因子的剧烈波动导致此时轮虫种群中的混交雌体百分率较高(37%)有关[1]。在本研究中, 在 1.0×106、2.0×106和4.0×106cells/mL斜生栅藻密度以及28℃和32℃下,轮虫具有较高的种群增长率(1.50—1.95/d)表明该种群能够适应较高的水温, 水温不是导致其在夏季水体中极低的种群密度(远低于1个/L)的直接因素。
[1] Wen X L. Population dynamics and regulation mechanisms of Brachionus calyciflorus and Brachionus angularis (Rotifera) in two shallow eutrophic lakes [D]. Ph.D dissertation, Anhui Normal University, Wuhu, 2011 [温新利.浅水富营养湖泊中两种臂尾轮虫的种群变动和机制研究.博士学位论文, 安徽师范大学. 芜湖, 2011]
[2] Wang A M, Xi Y L, Niu X X, et al. Adaptation of Brachionus calyciflorus (Rotifera) collected in winter from Lake Tingtang to increasing water temperature in spring: a life table demography study [J]. Acta Ecologica Sinica, 2014, (16). http://dx.doi.org/10.5846/ stxb201212221842 [王爱民,席贻龙, 牛翔翔, 等. 汀棠湖冬季出现的萼花臂尾轮虫对水温的适应. 生态学报, 2014, (16). http://dx.doi.org/ 10.5846/stxb201212221842]
[3] Stelzer C P. Evolution of rotifer life histories [J]. Hydrobiologia, 2005, 546: 335—346
[4] Campillo S, García-Roger E M, Carmona M J, et al. Local adaptation in rotifer populations [J]. Evolutionary Ecology, 2010, 25: 933—947
[5] Xi Y L, Huang X F. Advances in studies on the ecological mechanism of the formation and hatching of resting eggs of rotifers [J]. Acta Hydrobiologica Sinica, 1999, 23(1): 73—82 [席贻龙, 黄祥飞. 轮虫休眠卵形成和萌发的生态机理研究进展. 水生生物学报, 1999, 23(1): 73—82]
[6] Wen X L, Xi Y L, Yang Y F, et al. Temperature is the key factor controlling population dynamics of Brachionus angularis in Lake Jinghu during summer and autumn [J]. Journal of Freshwater Ecology, 2011, 26: 277—286
[7] Gilbert J J. Mictic female production in rotifer Brachionus calyciflorus [J]. Journal of Experimental Zoology, 1963, 153 (2): 113—124
[8] Zhang Z S, Huang X F. Method for Study on Freshwater Plankton [M]. Beijing: Science Press. 1991, 410—411 [章宗涉, 黄祥飞. 淡水浮游动物研究方法. 北京: 科学出版社. 1991, 410—411]
[9] Xi Y L, Huang X F. Effect of pH on population dynamics and resting egg of Brachionus calyciflorus [J]. Journal of Fishery Sciences of China, 1999, 6(3): 19—22 [席贻龙, 黄祥飞. pH对萼花臂尾轮虫休眠卵形成的影响. 中国水产科学, 1999, 6(3): 19—22]
[10] Dumont H J, Sarma S S S, Ali A J. Laboratory studies on the population dynamics of Anuraeopsis fissa (Rotifera) in relation to food density [J]. Freshwater Biology, 1995, 33: 39—46
[11] Pavón-Meza E L, Sarma S S S, Nandini S. Combined effects of algal (Chlorella vulgaris) food level and temperature on the demography of Brachionus havanaensis (Rotifera): a life table study [J]. Hydrobiologia, 2005, 546: 353—360
[12] Hu C B, Xi Y L, Tao L X. Comparative study on the life history characteristics of Brachionus rubens and B. urceolaris [J]. Acta Ecologica Sinica, 2008, 28(12): 5957—5963 [胡存兵, 席贻龙, 陶李祥. 红臂尾轮虫和壶状臂尾轮虫生活史特征比较. 生态学报, 2008, 28(12): 5957—5963]
[13] Tao L X, Xi Y L, Hu C B. Comparative study on the life history characteristics of rotifer Brachionus forcatus and B. caudatus [J]. Chinese Journal of Applied Ecology, 2008, 19(5): 1104—1109 [陶李祥, 席贻龙, 胡存兵. 镰形臂尾轮虫和尾突臂尾轮虫生活史特征的比较研究. 应用生态学报, 2008, 19(5): 1104—1109]
[14] Li H B, Xi Y L, Cheng X F. Comparative studies on life history characteristics of three sibling species in Brachionus calyciflorus species complex [J]. Acta Ecologica Sinica, 2009, 29(2): 581—588 [李化炳, 席贻龙, 程新峰. 萼花臂尾轮虫种复合体内三个姐妹种生活史特征比较. 生态学报, 2009, 29(2): 581—588]
[15] Xi Y L, Xu D D, Ma J, et al. Differences in life table parameters between Keratella tropica and Keratella valga (Rotatoria) from subtropical shallow lakes [J]. Journal of Freshwater Ecology, 2013, 28(4): 539—545
[16] Ning L F, Xi Y L, Sun Q, et al. Combined effects of temperature and algal food density on life table demography of Brachionus diversicornis (Rotifera) [J]. Journal of Lake Sciences, 2013, 25(2): 295—301 [宁乐锋, 席贻龙, 孙强,等. 温度和食物密度对裂足臂尾轮虫生命表统计学参数的影响. 湖泊科学, 2013, 25(2): 295—301]
[17] Hagiwara A, Hino A, Hirano R. Effect of temperature andchlorinity on resting egg formation in the rotifer Brachionus plicatilis [J]. Nippon Suisan Gakubu, 1988a, 54: 569—575
[18] Hagiwara A, Hino A, Hirano R. Comparison of resting egg formation among five Japanese stocks of the rotifer Brachionus plicatilis [J]. Nippon Suisan Gakubu, 1988b, 54: 577—580
[19] Hagiwara A, Lee C S. Resting egg formation of the L- and S-type rotifre Brachionus plicatilis under the different water temperature [J]. Nippon Suisan Gakubu, 1991, 57(9): 1645—1650
[20] Xi Y L, Huang X F. Effect of temperature and food concentration on resting egg fromation of freshwater rotifer Brachionus calyciflorus [J]. Acta Hydrobiologica Sinica, 2000, 24(2): 107—113 [席贻龙, 黄祥飞. 温度和食物浓度对萼花臂尾轮虫休眠卵形成的影响. 水生生物学报, 2000, 24(2): 107—113]
[21] Xi Y L, Dong L L, Ge Y L, et al. Resting egg production of Brachionus calyciflorus (Rotifera) at the different water temperatures [J]. Journal of Freshwater Ecology, 2004, 19: 567—573
[22] Snell T W, Hoff F H. The effect of environmental factors on resting egg production in rotifer Brachionus plicatilis [J]. Journal of World Mariculture Society, 1985, 16: 484—497
[23] Jiang D H, Xi Y L, Liu S G, et al. Seasonal variation of genetic structure and reproductive parameter of Brachionus calyciflorus (Rotifera) population in Lake Jinghu [J]. Acta Hydrobiologica Sinica, 2008, 32(6): 908—915 [江东海, 席贻龙, 刘胜国, 等. 镜湖萼花臂尾轮虫种群等位酶分析和生殖参数的季节变化. 水生生物学报, 2008, 32(6): 908—915]
[24] Ma Q, Xi Y L, Zhang J Y, et al. Differences in asexual and sexual reproduction among eight geographic populatons of Brachionus calyciflorus (Rotifera) from China [J]. Journal of Freshwater Ecology, 2009, 24: 273—278
[25] Liu S G, Xi Y L, Jiang D H. Temporal differences in reproductive characteristics of Brachionus calyciflrorus (Rotifera) from Lake Jinghu, China [J]. Journal of Freshwater Ecology, 2007, 22: 13—15
ADAPTATION OF BRACHIONUS CALYCIFLORUS (ROTIFERA) FROM LAKE JINGHU IN SUMMER TO WATER TEMPERATURE: POPULATION GROWTH EXPERIMENT STUDY
WANG Min, XI Yi-Long, ZHOU Bin and ZHANG Ye
(Provincial Key Laboratory of Biotic Environment and Ecological Safety, College of Life Sciences, Anhui Normal University, Wuhu 241000, China)
To study the population growth rate, average proportion of mictic females, average fertilization rate of mictic females, and resting egg production, Brachionus calyciflorus collected from Lake Jinghu were investigated at four temperatures (20℃, 24℃, 28℃and 32℃ ) and three Scenedesmus obliquus densities (1.0×106, 2.0×106 and 4.0×106 cells/mL) by population growth experiments. The results showed that the population growth rate of B. calyciflorus at 28℃ and 32℃ was the highest at all three food levels. At 1.0×106 cells/mL of S. obliquus, the average proportion of mictic females at both 20℃ and 24℃was significantly lower than that at 32℃, but it was not markedly different compared to that at 28℃. The average fertilization rate of mictic females at both 24℃ and 28℃ was the highest, and it was the lo west at 32℃. At 2.0×106 cells/mL of S. obliquus, the average proportion of mictic females at 20℃ was the highest. The average proportion of mictic females at 24℃ was lower than that at 32℃, but it was not significantly different compared to that at 28℃. The averagefertilization rate of mictic females at 20℃ , 24℃ and 28℃ was all higher than that at 32℃. The resting egg production at 20℃ was the biggest.At 4.0×106 cells/mL of S. obliquus, both the average proportion of mictic females and the resting egg production at 20℃ were higher than those at any other temperatures. The average fertilization rate of mictic females at both 20℃ and 24℃ was the highest, and it was the lowest at 32℃ . Two-way ANOVA analysis indicated that temperature significantly affected population growth rate, average proportion of mictic females, average fertilization rate of mictic females, and resting egg production (P<0.01), food level affected population growth rate and resting egg production (P<0.01), and temperature and food level cooperatively affected average proportion of mictic females and average fertilization rate of mictic females, and resting egg production (P<0.01). These results indicated that the rotifer population adapts high water temperature and water temperature does not directly account for the very low population density of B. calyciflorus in Lake Jinghu in summer, and that the high resting egg production of B. calyciflorus at low temperature may contribute to its reoccurrence in Lake Jinghu during the same period of next year.
Brachionus calyciflorus; Scenedesmus obliquus density; Temperature; Reproductive parameter
Q958
A
1000-3207(2014)06-1017-07
10.7541/2014.150
2013-09-04;
2014-03-12
国家自然科学基金(31170395); 教育部博士点基金(20093424110002); 安徽省高校生物环境与生态安全省级重点实验室专项基金; 重要生物资源保护和利用研究安徽省重点实验室专项基金资助
王敏(1989—), 男, 安徽省太和人; 硕士; 主要从事水生动物生态学研究。E-mail: wm321.happy@163.com
席贻龙, E-mail: ylxi1965@126.com

