老年人多发性骨髓瘤的治疗
多发性骨髓瘤(multiple myeloma, MM)是一种常见的血液系统恶性肿瘤,据报道,在美国每年有22 350例新发病例,死亡10 710例[1]。MM多在老年发病,诊断时中位年龄约70岁,65%病人≥65岁。目前把≥65岁的MM患者定义为老年患者。老年MM患者的疾病生物学特性和年轻患者无明显差异,但老年病人体能差,不少病人同时患心、脑、肾和代谢性疾病,不仅限制了现有治疗手段的实施,治疗相关的毒性作用也比较明显,总体疗效远不如年轻患者。因此老年MM的治疗需要更仔细的斟酌。
1 老年MM的治疗时期
浆细胞异常克隆性增生是MM的特征,目前认为几乎所有MM病例都由一种称为意义未明的单克隆免疫球蛋白病(monoclonal gammo-pathy of undetermined significance, MGUS)演变而来[2],大部分MGUS能保持无症状的情况>10年[3],每年仅1%发展为MM或相关恶性肿瘤[4]。在临床上可以识别到某些病例为MGUS向有症状骨髓瘤过渡的中间状态,相当于Durie-Salmon分期Ⅰ期的MM,称为冒烟型骨髓瘤(smoldering MM, SMM)。具备下列1项或多项骨髓瘤相关靶器官损害(myeloma-related organ and tissue impairment, ROTI)者称为有症状(或称活动型)MM:(1)校正血清钙>2.65 mmol/L;(2)肾功能损害(血清肌酐>177 μmol/L);(3)贫血(血红蛋白<正常下限20 g/L或<100 g/L);(4)溶骨性破坏或严重的骨质疏松或病理性骨折;(5)其他,比如有症状的高黏血症、淀粉样变、反复细菌感染(≥2次/年)。
有证据显示,对无症状MM实施干预并无益处[5],因此目前认为有症状MM才是治疗的合适时期。对于SMM患者,建议密切随访(开始每3月1次),及时发现ROTI症状并启动治疗[6]。新近有研究发现,无症状MM患者如骨髓浆细胞≥60或血清游离轻链(FLC)比例≥100,向有症状MM发展的危险很高,是独立的预测因素,因此对有上述2项特征的SMM,也要考虑治疗[7]。对复发MM的再治疗也遵从上述标准,即出现ROTI症状是治疗指征。另外,无ROTI症状的病人如M蛋白在2月内成倍增加,也需要治疗[6]。
2 老年MM的治疗目标
MM对多种细胞毒性药物敏感,但治疗反应时间不长,用现有的方法还无法治愈。近年随着造血干细胞移植和硼替佐米、来那度胺、沙利度胺等新药的应用,治疗的缓解率明显提高,缓解期也明显延长。完全缓解(complete response, CR)代表MM的残留疾病低于某种可检测到的水平,目前定义为血清和尿免疫固定电泳未检出M蛋白、任何软组织浆细胞瘤消失和骨髓浆细胞≤5%。文献报道,未使用干细胞移植和新药的传统治疗只能使5%的MM病人获得CR,采用新药诱导,并给予干细胞移植后CR率提高到≥40%[8]。
治疗缓解的程度是重要的预后因素,获得CR的病人在无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)方面均有明显的优势,因此不少研究已经将CR作为OS的替代列为临床相关的终点结局指标[9-11]。CR应作为各阶段MM患者重要的治疗目标,未能达到CR者,也要力求获得较深程度的缓解,例如非常好的部分缓解(very good partial remission, VGPR)。
虽然获得CR对于MM患者长期生存非常重要,但病人情况不同,结果也不尽然相同。在老年MM,试图增加CR的治疗往往带来更大的毒性,PFS和OS并未获益[9-10]。比较惰性的MM低危患者如果未获得CR,可以通过后续的巩固和维持治疗加深缓解的程度,即便复发也可以进行补救治疗而获得较长的OS。因此对老年MM病人,不能过度强调CR的重要性,避免过大不良反应,才能最大限度延长生存期,提高生命质量。
3 治疗前评估
初始治疗前全面评估是拟定治疗方案的重要环节,需要考虑所有预后因素。有3个方面:(1)肿瘤生物学因素,包括细胞遗传学改变、血清乳酸脱氢酶(LDH)、浆细胞增殖率、浆细胞白血病表现以及基因表达谱(GEP)分类;(2)肿瘤负荷因素,包括Durie-Salmon分期、国际分期系统、髓外病变等;(3)病人相关因素,包括体能状态、年龄、肾功能等[11]。其中在肿瘤负荷因素,虽然Durie-Salmon分期和国际分期系统提供了重要的预后信息,但对选择治疗没有帮助[12]。
已经发现不少细胞遗传学异常和GEP标记与MM的侵袭性有关联,初始治疗前可以据此将MM患者分为侵袭性较高的高危组和病情比较惰性的标危组(表1)[11]。高危患者需要获得CR才能有长的生存期,因此需要比较强烈的治疗。而对于标危患者,是否获得CR对OS影响不大,可以根据病人相关因素选择比较强烈的治疗或选择序贯治疗。

表1 有症状MM的危险分层
注:FISH:原位荧光杂交;GEP:基因表达谱;PCLI:浆细胞标记指数
病人相关因素是决定MM治疗方案的重要因素,尤其对老年MM患者更应仔细评估。可以根据患者年龄、共患病和脏器功能、日常生活能力等将患者分为体格状态良好(fit)、体格状态不良(unfit)和脆弱(frail)3类。对于fit患者,可以考虑较强的初始治疗,足够剂量,如果年龄<70岁、身体状况非常好的还可以考虑减低剂量的马法兰加ASCT;对于unfit患者应使用比较温和的初始治疗,剂量相应减少;对于frail患者剂量应进一步减少(表2)[13]。
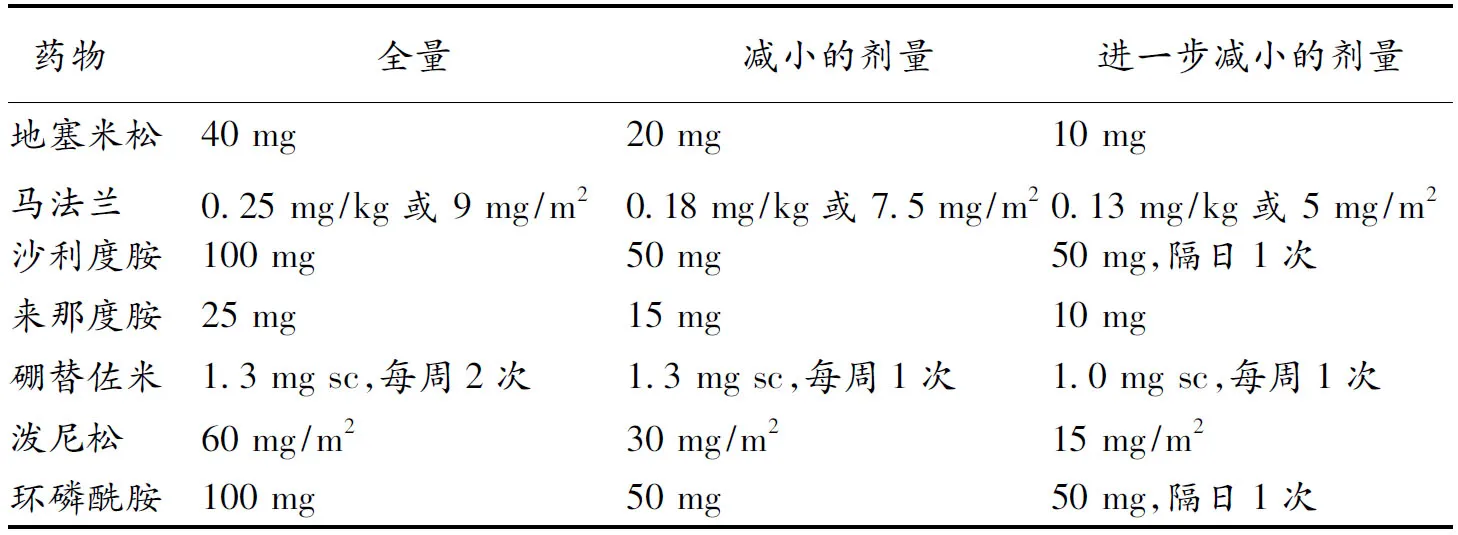
表2 不同身体状况的剂量调整
选择治疗方案还要考虑病人特征和治疗药物主要毒性作用。对于有多发性神经炎的病人,要避免或减量使用硼替佐米,肾功能不全的病人如果要使用来那度胺应减少剂量,有血栓栓塞性疾病或血栓栓塞风险高的病人要避免沙利度胺和大剂量的地塞米松,合并糖尿病的病人要减少皮质激素的用量。
4 老年MM的治疗方案
老年MM一般不适合ASCT。对于标危MM,联合来那度胺和低剂量地塞米松(40 mg,每周1次)的Rd方案备受推崇[11,14],其具有较好的疗效,耐受性好,也比较方便。用于>70岁、未接受ASCT的MM患者,3年OS为70%[15],与VMP(硼替佐米+马法兰+泼尼松)和MPT相似。
VMP和MPT都是以马法兰为基础的方案,虽然使用马法兰会有损伤造血干细胞和可能继发骨髓增生异常综合征和急性白血病的顾虑,但费用比较低廉,因此仍然被广泛应用。VMP[16-17]和MPT[18-19]与传统的MP比较,OS均有显著优势,但不良反应增加。VMP主要的不良反应为神经病变,MPT主要为血栓事件。在MP的基础上加来那度胺(MPR)与MP比较,用于老年MM的初始治疗,PFS和OS没有改善[20]。有随机对照研究(RCT)尝试用沙利度胺代替马法兰的VTP(硼替佐米+沙利度胺+泼尼松)方案与VMP比较,结果显示缓解率相似,但不良反应增加,更多的病人终止试验[21]。另有一篇RCT研究采用VMPT(硼替佐米+马法兰+泼尼松+沙利度胺)四药方案与VMP比较,显示VMPT的PFS和OS更长,不过该研究中VMPT组有用硼替佐米和沙利度胺维持,而VMP组不维持,很难说VMPT的诱导治疗优于VMP[22]。
对于因经济支付能力不足无法用上Rd以及考虑不良反应而不用VMP和MPT的病人,MP仍然是安全和可行的选择[23]。有研究用沙利度胺(200 mg/d)加地塞米松(40 mg 第1~4天和第15~18天/双数治疗周期,40 mg 第1~4天/单数治疗周期)的TD方案与MP比较,结果显示CR率增加,但毒性增加,PFS相似,OS更短[10]。
联合硼替佐米、来那度胺和地塞米松的VRD方案用于初治MM,安全性好,疗效高,被认为是高危MM的首选方案[11,14]。多中心的前瞻性Ⅰ期和Ⅱ期研究治疗66例初治MM(中位数年龄为58岁,范围22~86岁),中位数随访21月,总缓解(PR及以上的缓解)率为100%,无治疗相关的死亡,18月PFS和OS分别达75%和97%[24]。最近一篇称为EVOLUTION的RCT研究显示,联合硼替佐米、环磷酰胺和地塞米松的VCD与VRD方案相似,总缓解率和1年PFS都很高,耐受性也比较好。采用硼替佐米、环磷酰胺、来那度胺和地塞米松四药联合与三药方案比较没有优势[25]。VCD与VRD方案比较有明显的费用优势,可以考虑作为VRD方案的替代选择。
总之,对于老年标危MM患者,可以选用Rd,也可以采用VMP和MPT。对于中危和高危患者,可以选择VRD或VCD。
5 减低剂量的ASC
老年MM一般不适合用ASCT治疗,但ASCT治疗MM没有严格的年龄限定。有研究将194例年龄在50~70岁的MM随机分为2组,一组用MP方案,另一组用DAV(地塞米松+阿霉素+长春新碱)2个周期后,用环磷酰胺动员并采集外周血干细胞,之后2次减低剂量的马法兰(100 mg/m2)加ASCT,结果显示减低剂量马法兰+ASCT在CR率、PFS和OS均有明显优势,在65~70岁病例组CR率、PFS和OS的改善更明显[26]。另一项RCT IMF99-06研究将447例65~75岁的初治MM随机分为MP组、MPT组和减低剂量马法兰(100 mg/m2)加ASCT组。结果显示减低剂量ASCT的OS与MP相似但比MPT短[10]。上述研究说明,对于年龄不是很大(比如65~70岁)的老年MM,如果身体状况很好,可以考虑减低剂量的ASCT,如果年龄更大,或者身体状况不佳,采用诸如MPT的治疗可能优于减低剂量的ASCT。
6 是否给予维持治疗
ASCT后是否需要维持治疗,目前存在争议。有研究显示用沙利度胺作为ASCT后的维持治疗能延长PFS和OS[27]。新近有2项RCT研究用来那度胺作为ASCT后的维持治疗,显示能明显延长PFS[28-29],不过有学者提出质疑,认为研究中的对照组不能得到及时补救治疗可能是PFS延长的因素之一[30]。另外来那度胺可能造成第二肿瘤发生增加,值得重视。
对于未接受ASCT的患者的维持治疗,一项RCT研究将经过沙利度胺、地塞米松和脂质体阿霉素联合诱导后的患者随机分成沙利度胺(100 mg/d)加地塞米松(20 mg/第1~4天,每28天)维持和干扰素每周3次维持,结果显示沙利度胺+地塞米松的维持在2年PFS和OS均有显著优势[31]。不过另一项研究显示,经过MPT诱导治疗的患者用沙利度胺维持,OS比采用MP诱导治疗的患者短[32],而用MPT诱导治疗的患者不用沙利度胺维持,OS没有缩短[9],使人产生沙利度胺维持是否诱发耐药的揣测。因此现阶段对于是否需要维持治疗,以及用来那度胺或沙利度胺维持治疗,还需要与患者和家属深入讨论。
7 老年MM复发的治疗
几乎所有MM患者最终要复发,复发的患者经治疗虽可能再次获得缓解,但缓解期越来越短。对复发MM患者如何选择治疗方案要根据疾病发展的快慢和以往治疗的情况而定。对于老年MM,共患疾病可能使患者无法耐受治疗,也是重要的考虑因素。有多种补救治疗方案,采用一种或几种新药(硼替佐米、来那度胺、沙利度胺)+化疗药物+皮质激素,对复发MM是有效的,但由于复发病例的情况复杂,很难对这些方案获得的OS进行比较。不过第一次复发时就采用新药比以后的补救治疗中再用,可获得更长OS[33]。
如果复发MM表现为快速进展,在身体状况和器官功能比较好的患者可以考虑联合新药和化疗的强有力的治疗。假如复发表现为缓慢的发展,采用一种新药加皮质激素就行,尤其对无法耐受强烈治疗的患者。对于停药6月后复发的MM可以尝试初始用的诱导方案。如果对来那度胺和硼替佐米都耐药,预后很差,中位PFS仅5月,中位OS仅9月[34]。对这样的患者要考虑更新的药物如carfilzomib。
8 不良反应的处理
8.1 血液学毒性 骨髓抑制是MM的常见并发症,导致贫血、粒细胞减少和血小板减少。粒细胞减少还可能是来那度胺和烷化剂的常见不良反应,而血小板减少在硼替佐米治疗的患者相当常见。出现骨髓抑制时要减低上述药物的剂量,必要时暂停使用,同时给予克隆刺激因子等支持治疗。
8.2 肾功能衰竭 肾损害在MM患者很常见。沙利度胺和硼替佐米在肾功能不全的病人无需调整剂量。来那度胺虽可以使用,但必须根据肌酐清除率调整剂量,而且要密切观察血液学毒性的发生。
8.3 周围神经病变 周围神经病变是硼替佐米常见不良反应,由于没有有效方法缓解硼替佐米引发的神经损害症状,一旦出现应及时减量。如出现1级病变伴疼痛或2级病变,建议减低剂量为1.0 mg/m2,2级病变伴疼痛或3级病变的建议停药,症状缓解后以更小剂量0.7 mg/m2重新开始治疗,出现4级神经病变的建议改用其他治疗方案[35]。对于使用沙利度胺的患者如出现1级神经病变可维持原剂量观察,出现2级病变应减低剂量50%,出现3级病变要停药观察,待症状改善至1级时以减低剂量重新开始治疗。
8.4 深静脉血栓 沙利度胺、来那度胺、大剂量地塞米松等可能增加深静脉血栓的危险,选择MM治疗方案要考虑血栓危险因素,包括患者年龄、既往深静脉血栓病史、中心静脉插管、制动、共患病(如心脏病、肾脏病、糖尿病等)、骨髓瘤相关的高黏滞血症等。
[参考文献]
[1] Siegel R, Naishadham D, Jemal A. Cancer Statistics[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study[J]. Blood, 2009, 113(22):5412-5417.
[3] Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis of monoclonal gammopathy of undetermined significance[J]. N Engl J Med, 2002, 346(8):564-569.
[4] Therneau TM, Kyle RA, Melton Ⅲ LJ, et al. Incidence of monoclonal gammopathy of undetermined significance and estimation of duration before first clinical recognition[J]. Mayo Clin Proc, 2012, 87(11):1071-1079.
[5] Riccardi A, Mora O, Tinelli C, et al. Long-term survival of stage I multiple myeloma given chemotherapy just after diagnosis or at progression of disease: a multicentre randomized study[J]. Br J Cancer, 2000,82(7):1254-1260.
[6] Bird JM, Owen RG, D’sa S, et al. Guidelines for the diagnosis and management of multiple myeloma 2011[J].Br J Haematol, 2011, 154(1):32-75.
[7] Kastritis E, Terpos E, Moulopoulos L, et al. Extensive bone marrow infiltration and abnormal free light chain ratio identifies patients with asymptomatic myeloma at high risk for progression to symptomatic disease [J]. Leukemia, 2013, 27(4):947-953.
[8] Giralt S, Chanan-Khan AA. Importance of achieving a complete response in multiple myeloma, and the impact of novel agents[J]. J Clin Oncol, 2010, 28(15):2612-2624.
[9] Facon T, Mary JY, Hulin C, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06):a randomized trial[J]. Lancet, 2007, 370(9594):1209-1218.
[10] Ludwig H, Hajek R, Tothova E, et al. Thalidomide-dexamethasone compared to melphalan-prednisone in elderly patients with multiple myeloma[J]. Blood, 2009, 113(15):3435-3442.
[11] Mikhael JR, Dingli D, Roy V, et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo stratification of myeloma and risk-adapted therapy (mSMART) consensus Guidelines 2013[J]. Mayo Clin Proc, 2013, 88(4):360-376.
[12] Hari PN, Zhang MJ, Roy V, et al. Is the international staging system superior to the Durie-Salmon staging system? A comparison in multiple myeloma patients undergoing auto-logous transplant[J]. Leukemia, 2009,23(8):1528-1534.
[13] Palumbo A, Bringhen S, Ludwig H, et al. Personalized therapy in multiple myeloma according to patient age and vulnerability: a report of the European Myeloma Network (EMN) [J]. Blood,2011,118(17):4519-4529.
[14] Rajkumar SV. Multiple myeloma: 2013 update on diagnosis, risk-stratification, and management[J]. Am J Hematol, 2013, 88(3):226-235.
[15] Jacobus S, Callander N, Siegel D, et al. Outcome of elderly patients 70 years and older with newly diagnosed myeloma in the ECOG randomized trial of lenalidomide/high-dose dexamethasone (RD) versus lenalidomide/low-dose dexamethasone (Rd) [J]. Haematologica,2010,95(Suppl 2):149.
[16] San Miguel JF, Schlag R, Khuageva NK, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma[J]. N Engl J Med, 2008, 359(9):906-917.
[17] Mateos MV, Richardson PG, Schlag R, et al. Bortezomib plus melphalan and prednisone compared with melphalan and prednisone in previously untreated multiple myeloma: Updated follow-up and impact of subsequent therapy in the phase III VISTA trial[J]. J Clin Oncol, 2010, 28(13):2259-2266.
[18] Kapoor P, Rajkumar SV, Dispenzieri A, et al. Melphalan and prednisone versus melphalan, prednisone and thalidomide for elderly and/or transplant ineligible patients with multiple myeloma: A meta-analysis[J]. Leukemia, 2011, 25(4):689-696.
[19] Fayers PM, Palumbo A, Hulin C, et al. Thalidomide for previously untreated elderly patients with multiple myeloma: Meta-analysis of 1685 individual patient data from 6 randomized clinical trials[J]. Blood, 2011, 118(5):1239-1247.
[20] Palumbo A, Dimopoulos MA, Delforge M, et al. A phase Ⅲ study to determine the efficacy and safety of lenalidomide in combination with melphalan and prednisone (MPR) in elderly patients with newly diagnosed multiple myeloma[C]. ASH, 2009, 114:613.
[21] Mateos MV, Oriol A, Martinez-Lopez J. Bortezomib/melphalan/prednisone (VMP) versus bortezomib/thalidomide/prednisone (VTP) as induction therapy followed by maintenance treatment with bortezomib/thalidomide (VT) versus bortezomib/prednisone (VP):A randomised trial in elderly untreated patients with multiple myeloma older than 65 years[J]. Lancet Oncol, 2010, 11(10):934-941.
[22] Palumbo A, Bringhen S, Rossi D, et al. Overall survival benefit for bortezomibmelphalan-prednisone-thalidomide followed by maintenance with bortezomibthalidomide (VMPT-VT) versus bortezomib-melphalan-prednisone (VMP) in newly diagnosed multiple myeloma patients[C]. ASH, 2012, 120:200.
[23] Kyle RA, Rajkumar SV. Multiple myeloma[J]. Blood, 2008, 111(6):2962-2672.
[24] Richardson PG, Weller E, Lonial S, et al. Lenalidomide, bortezomib, and dexamethasone combination therapy in patients with newly diagnosed multiple myeloma[J]. Blood, 2010, 116(5):679-686.
[25] Kumar S, Flinn I, Richardson PG, et al. Randomized, multicenter, phase 2 study (EVOLUTION) of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma[J]. Blood, 2012, 119(19):4375-4382.
[26] Palumbo A, Bringhen S, Petrucci MT, et al. Intermediate-dose melphalan improves survival of myeloma patients aged 50 to 70: results of a randomized controlled trial[J]. Blood, 2004, 104(10):3052-3057.
[27] Spencer A, Prince HM, Roberts AW, et al. Consolidation therapy with low-dose thalidomide and prednisolone prolongs the survival of multiple myeloma patients undergoing a single autologous stem-cell transplantation procedure[J]. J Clin Oncol, 2009, 27(11):1788-1793.
[28] Attal M, Lauwers-Cances V, Marit G, et al. Lenalidomide maintenance after stemcell transplantation for multiple myeloma[J]. N Engl J Med, 2012, 366(19):1782-1791.
[29] McCarthy PL, Owzar K, Hofmeister CC, et al. Lenalidomide after stem-cell transplantation for multiple myeloma[J]. N Engl J Med, 2012,366(19):1770-1781.
[30] Rajkumar SV, Gahrton G, Bergsagel PL. Approach to the treatment of multiple myeloma: A clash of philosophies[J]. Blood, 2011, 118(12):3205-3211.
[31] Palumbo A, Dimopoulos M, Delforge M, et al. A Phase III study to determine the efficacy and safety of lenalidomide in combination with melphalan and prednisolone (mpr) in elderly patients with newly diagnosed multiple myeloma[C]. Blood, 2009:114.
[32] Palumbo A, Bringhen S, Liberati AM, et al. Oral melphalan, prednisone, and thalidomide in elderly patients with multiple myeloma: updated results of a randomized controlled trial[J]. Blood, 2008, 112(8):3107-3114.
[33] Vogl DT, Stadtmauer EA, Richardson PG, et al. Impact of prior therapies on the relative efficacy of bortezomib compared with dexamethasone in patients with relapsed/refractory multiple myeloma[J]. Br J Hematol, 2009, 147(4):531-534.
[34] Kumar SK, Lee JH, Lahuerta JJ, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: A multi-center international myeloma working group study[J]. Leukemia, 2012, 26(1):149-157.
[35] Argyriou AA, Iconomou G, Kalofonos HP. Bortezomibinduced peripheral neuropathy in multiple myeloma: a comprehensive review of the literature[J]. Blood, 2008, 112(5):1593-1599.

