糖代谢异常对原发性高血压患者左心室功能的影响
心血管疾病(cardiovascular disease, CVD)诸多危险因素经常并存、协同致病。如高血压患者的糖耐量异常或糖尿病(diabetes mellitus, DM)等糖代谢异常(impaired glucose metabolism, IGM)发生率显著高于血压正常的人群,而DM患者相对于糖代谢正常的人群,其合并高血压的概率较高,且更易出现心脏功能异常[1]。本文通过对比分析伴或不伴2型糖尿病(T2DM)的原发性高血压(essential hypertension, EH)患者的血糖、血脂、尿酸(UA)、纤维蛋白原(Fib)等代谢参数以及左心室收缩与舒张功能参数的差异,并对左心室舒张功能障碍的EH患者血糖代谢状态进行分析,探讨IGM对EH患者早期左心室功能不全的影响。
1 研究对象与方法
1.1 研究对象 82例EH男性患者,排除各种继发性高血压(如肾性高血压、原发性醛固酮增多症、嗜铬细胞瘤等)及合并冠心病、甲状腺疾病及慢性肾脏疾病、风湿性心脏病、原发性心肌病及充血性心力衰竭。所有研究对象在研究期间均未出现房性心动过速、心房扑动及心房纤颤等影响心脏功能超声检测的心律失常。其中单纯EH患者46例(单纯EH组),年龄56~94岁,平均(77.1±5.6)岁,EH合并T2DM(合并T2DM组)患者36例,年龄62~93岁,平均(79.3±5.9)岁。2组患者的年龄、降压用药及吸烟史无显著性差异,合并T2DM组的患者同时行降糖药物治疗。
1.2 研究方法
1.2.1 一般资料的获取:通过病史询问及体格检查,获取患者的年龄、体质量、身高,计算体质量指数(BMI)=体质量(kg)/身高2(m2),以及吸烟史,降压、降糖用药情况。
1.2.2 血糖、血脂、UA及Fib检测:清晨采集空腹静脉血,以全自动生化分析仪检测空腹血糖(FBG)、餐后2 h血糖(PBG)及糖化血红蛋白(HbA1c)等血糖代谢参数,并检测血三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)及血清载脂蛋白AⅠ(Apo-AⅠ)、载脂蛋白B(Apo-B)等血脂参数,以及血UA、Fib浓度。
1.2.3 左心室功能参数测定:使用GE公司的Vivid-7型彩色超声仪进行心脏超声多普勒检查,通过M型超声得出左心室射血分数(left ventricular ejection fraction, LVEF),以LVEF<40%为左心室收缩功能不全。并在心尖四腔切面观中,测定二尖瓣口舒张早期峰值流速(E)、二尖瓣口舒张晚期峰值流速(A)、二尖瓣环舒张早期峰值流速(Ea)、二尖瓣环舒张晚期峰值流速(Aa)。计算E/A值及Ea/Aa值,以E/A值<1,或E/A值>1但Ea/Aa值<1作为心脏舒张功能障碍的超声诊断标准。
2 结果
2.1 2组患者BMI、血糖、血脂、UA、Fib等代谢参数的差异 合并T2DM 组的BMI、FBG、PBG、HbA1c、TG、TC、LDL-C、Apo-B、UA及Fib均显著高于单纯EH组(P<0.05或P<0.01),而2者HDL-C、Apo-AⅠ的差异无显著性意义(P>0.05),见表1。
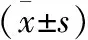
表1 2组各代谢参数的比较
注:与单纯EH组比较,*P<0.05,**P<0.01
2.2 EH患者心脏功能检测结果 所有对象LVEF值均>40%,且2组患者之间LVEF值的差异无统计学意义[(0.534 ± 0.064)% 及 (0.512 ± 0.059)%,P>0.05]。合并T2DM组患者的左心室舒张功能障碍发生率显著高于单纯EH患者的左心室舒张功能障碍发生率(72.2% 及45.7%, χ2=5.828,P<0.05);而出现左心室舒张功能障碍的EH患者合并T2DM的发生率则显著高于无左心室舒张功能障碍的EH患者(55.3% 及 28.6%,P<0.05)。进一步对这些EH患者的血糖代谢参数进行分析发现,出现左心室舒张功能障碍的EH患者FBG为(6.19 ± 1.06) mmol/L,显著高于无左心室舒张功能障碍的EH患者的 (5.44 ± 0.81) mmol/L(P<0.01);HbA1c水平2者分别为(6.54 ± 0.95)% 及 (5.87 ± 0.89)%,差异有统计学意义(P<0.01),出现左心室舒张功能障碍的EH患者显著高于无左心室舒张功能障碍的EH患者,但二者之间PBG的差异则无统计学意义[PBG分别为(8.41 ± 1.44) mmol/L及 (7.85±1.31) mmol/L,P>0.05]。
3 讨论
研究表明, IGM与高血压关系密切,二者经常并存,并与其他 CVD的危险因素相互作用,共同构成了一组与CVD发病密切相关的代谢紊乱症状群——代谢综合征(metabolic sysdromes, MS)[2]。本文研究结果显示,与单纯EH患者相比,合并T2DM的EH患者不仅存在血脂代谢紊乱,表现为促进动脉粥样硬化(atherosclerosis, AS)的血脂成分TG、LDL-C及Apo-B均显著增高,而对血管起护作用的HDL-C及Apo-AⅠ则无相应升高,同时其BMI、UA及Fib等其他代谢参数亦显著增高。提示,在EH患者体内,IGM进一步加重其血脂紊乱、UA及Fib升高等其他代谢异常。
UA、IGM不仅与高血压共同加重促进AS,而且可带来包括心脏、周围神经、肾脏等多个重要脏器功能的损害。其中,糖尿病性心肌病(diabetic cardiomyo-pathy)是糖代谢异常对心脏结构与功能损伤的主要病理基础,它可导致左心室功能不全,早期表现为左心室舒张功能障碍,而左心室收缩功能正常,故未显现心功能衰竭的临床症状,而在糖尿病性心肌病后期亦可出现左心室收缩功能异常。心脏超声多普勒是评估左心功能的一项无创手段,通常以LVEF来反映左心室收缩功能,LVEF≤40%被视为左心室收缩功能不全;而左心室舒张功能减退早期为左心室弛缓障碍(二尖瓣舒张早期流速E峰值减小),房室压差相对减少而左心房代偿性收缩增强(二尖瓣舒张晚期流速A峰值增大),故E/A<1;当左心室舒张功能进一步减退时,除左心室弛缓障碍外,尚有左心室顺应性下降,造成A峰值减少,同时左心房压力因左室顺应性下降而增大,使E峰值增大,故出现E/A>1的心脏舒张功能假性正常化,此时通过检测二尖瓣环舒张期运动速度可发现心脏舒张功能异常[3],表现为Ea/Aa值<1。本文通过对EH患者的心脏超声检查发现,EH患者在心脏收缩功能尚正常时,就已显示出心脏舒张功能障碍,且合并T2DM组患者心脏舒张功能障碍发生率显著高于单纯EH组;而那些出现左心室舒张功能障碍的EH患者,其合并T2DM的发病率显著高于无左心室舒张功能障碍的EH患者。进一步对这些EH患者的糖代谢状态进行分析发现,与无左心室舒张功能障碍的EH患者相比,出现左心室舒张功能障碍的EH患者的FBG及HbA1c水平等血糖代谢指标水平显著增高。结果提示,糖代谢异常可加重EH患者心功能障碍,后者在早期主要体现为左心室舒张功能异常,并与其血糖代谢紊乱程度密切相关,而左心室收缩功能尚无明显减退。其他研究亦发现,在血压正常、血糖控制良好且未出现收缩功能障碍的T2DM患者中,可能存在心脏舒张功能障碍,后者与其HbA1c水平、年龄、糖尿病病程密切相关[4-5]。此外,无CVD的T2DM患者出现心脏舒张功能障碍亦与其年龄、T2DM病程、糖尿病微血管病并发症及糖尿病性心脏自主神经病变程度显著相关[6-8]。值得提出,本文未发现左心室舒张功能障碍的EH患者与无左心室舒张功能障碍的EH患者之间PBG水平的差异。推测,这可能与PBG水平易受进食影响有关,而FBG为大部分时间的血糖水平,HbA1c则反映了T2DM患者近2~3月的平均血糖水平,后两者更好地反映了血糖波动的真实状态。
目前认为[9],糖尿病性心室舒张功能障碍的发病机制包括血糖增高导致心肌细胞损伤与心肌间质纤维化、冠脉小血管结构与功能损伤、伴随高胰岛素血症的胰岛素抵抗引起左心室肥厚、心肌细胞钙自稳机制障碍、心脏局部RAS系统的异常激活及糖尿病性自主神经病变等。其中,糖尿病致心血管自主神经功能异常是T2DM患者心功能障碍的一个重要原因[10]。本文前期研究结果亦显示,IGM不仅加重EH患者体内血管内皮损伤、加速AS,引起脉压增大和反映血压波动的血压变异性增大,而且加重其心脏自主神经功能的损害,后者表现为副交感神经功能减弱,而交感神经功能相对增强[11-13]。
总之,本文研究结果显示,IGM可加重EH患者左心室功能减退,尤其是早期心脏舒张功能障碍;改善EH患者的糖代谢状态,可能有助于延缓其左心功能异常的出现。
[参考文献]
[1] Salmasi AM, Alimo A, Dancy M. Prevalence of unrecognized abnormal glucose tolerance in patients attending a hospital hypertension clinic[J]. Am J Hypertens, 2004,17(6):483-488.
[2] Alberti KG, Zimmet P, Shaw J. Metabolic syndrome—a new world-wide definition. A Consensus Statement from the International Diabetes Federation[J]. Diabet Med, 2006, 23(5):469-480.
[4] Guo CY, Shen LH, Li HW, et al. Relation of hemoglobin A1c to myocardial acoustic densitometry and left ventricular diastolic function in patients with type 2 diabetes mellitus and without evident heart disease[J]. Diabetes Res Clin Pract, 2009, 83(3):365-370.
[5] Masugata H, Senda S, Goda F, et al. Left ventricular diastolic dysfunction in normotensive diabetic patients in various age strata[J]. Diabetes Res Clin Pract, 2008, 79(1):91-96.
[6] Patil MB, Burji NP.Echocardiographic evaluation of diastolic dysfunction in asymptomatic type 2 diabetes mellitus[J]. J Assoc Physicians India, 2012, 60:23-26.
[7] Poanta L, Porojan M, Dumitrascu DL. Heart rate variability and diastolic dysfunction in patients with type 2 diabetes mellitus[J]. Acta Diabetol, 2011, 48(3):191-196.
[8] Mishra TK, Rath PK, Mohanty NK, et al. Left ventricular systolic and diastolic dysfunction and their relationship with microvascular complications in normotensive, asymptomatic patients with type 2 diabetes mellitus[J]. Indian Heart J, 2008, 60(6):548-553.
[9] Mandavia CH, Aroor AR, Demarco VG, et al.Molecular and metabolic mechanisms of cardiac dysfunction in diabetes[J]. Life Sci, 2013, 92(11):601-608.
[10] Debono M, Cachia E. The impact of cardiovascular autonomic neuropathy in diabetes: is it associated with left ventricular dysfunction?[J]. Auton Neurosci, 2007,132(1/2):1-7.
[11] 王钢,夏冰. 糖代谢异常对原发性高血压患者血管内皮损伤的影响[J]. 心血管康复医学杂志,2013, 22(1):6-9.
[12] 王钢. 糖尿病对高血压患者动态血压及血压变异性的影响[J]. 实用老年医学,2006,20(5):335-337.
[13] Wang G. Effects of impaired glucose metabolism on heart rate variability and blood pressure variability in essential hypertensive patients[J]. J Huazhong Univ of Sci Technolog Med Sci, 2006,26(6):654-656.

