IL-33/ST2信号通路与炎症性肠病的研究进展
吉 挺(综述),李学良(审校)
(南京医科大学第一附属医院消化科,南京210029)
ST2在20世纪80年代被发现于小鼠成纤维细胞。因未发现其内源性配体,故功能一直未能完全明确。其后在犬的互补DNA文库中发现了一个前导肽,命名为白细胞介素(interleukin,IL)33,经过加工可成为成熟蛋白并激活ST2,由此,IL-33/ST2这一信号转导通路的研究逐渐增多,为实验室和临床研究提供了更多思路,在炎症性疾病、哮喘、自身免疫性疾病、心血管疾病等方面都出现了相关研究。该信号通路在与消化系统疾病,尤其是炎症性肠病之间联系的研究仍然较少。该文主要介绍IL-33/ST2信号通路以及其与炎症性肠病的关系。
1 IL-33/ST2简介
1.1ST2 ST2在1989年对小鼠成纤维细胞的研究中被发现,属于Toll样/IL-1受体超家族成员之一,该超家族成员因胞内结构域Toll/IL-1R(TIR)较多而得名[1]。TIR结构域位于胞质一侧,由大约160个氨基酸组成,定位于人类第2号染色体(2q12),在其中央有5个β片层,周围有5个α-螺旋。ST2主要有四种亚型,分别为ST2L、sST2、ST2V、ST2LV。ST2L(IL-1RL-1α)又称跨膜ST2蛋白,它由膜内、跨膜和膜内的三个肽段组成,分别是膜外的免疫球蛋白结构域,跨膜部分和膜内一个TIR胞质结构域组成。sST2(IL-1RL1-b)又称可溶性ST2蛋白,其结构中无ST2L所具有的免疫球蛋白结构域及跨膜部分,但C端有9个氨基酸组成的特殊序列。ST2V与ST2LV为ST2的另外两个剪切变体。ST2V膜外的免疫球蛋白结构域比ST2L少一个,此外,其C端被剪切成一个独特的疏水尾部。ST2LV与ST2L相比,仅具有膜外三个结构域及膜内TIR胞质结构域(图1)[1]。在小鼠皮肤组织受到紫外线照射或受TNF等促炎因子刺激时,可表达出sST2,与小鼠相比,人类sST2的表达可能更加普遍[2]。有研究表明,ST2主要表达在Th2类淋巴细胞和肥大细胞表面,有些粒细胞(如嗜酸粒细胞和嗜碱粒细胞)也能表达ST2L分子[3-4]。研究ST2功能存在一个主要的障碍,即缺乏特异性的内源性配体。

TIR:Toll样/IL-1受体
1.2IL-33 IL-1是一个基因家族,它包括IL-1α、IL-1β、IL-18等11个成员。2005年,Schmitz等[5]在犬的互补DNA文库中发现了一个前导肽,命名为IL-33,属于IL-1家族的新成员,其相对分子质量是30×103,由270个氨基酸构成,主要定位于人类染色体第9号染色体(9p24)。这种蛋白之前曾经被描述为在内皮细胞的胞核中高表达的高内皮微静脉核因子,它可以作为ST2的特异性配体并激活ST2,从而为研究ST2信号转导通路提供了新的方向。IL-33主要由N端的核定位信号,落旋-转角-螺旋基础结构以及C端的一个IL-1家族成员共同的结构域组成。IL-33在体内各系统器官的细胞中广泛分布,这些细胞主要是非造血起源细胞,如内皮细胞、脂肪细胞、成纤维细胞、平滑肌细胞、支气管上皮及肠上皮细胞,在血液细胞中表达,主要是巨噬细胞和树突状细胞等有呈递抗原作用的细胞[4]。IL-33需要经过激活才可以发挥其生物学作用。传统的观点认为,IL-33前体同IL-1β和IL-18一样,不含有分泌信号肽的序列,因此它需要经过一种胱天蛋白酶1(caspase-1)裂解,再与溶酶体膜融合,才能成为具有活性的细胞因子释放到胞外[6]。有研究表明,caspase-1的裂解作用可能激活IL-33,最终也可以使IL-33的作用失活[7]。有学者认为,中性粒细胞组织蛋白酶G和弹性蛋白酶能裂解全长的人IL-331~270,产生成熟的IL-3395~270、IL-3399~270和IL-33109~270。这些几种成熟的IL-33被中性粒细胞所活化,这些活化后的IL-33活性是原先完整IL-33的10倍(图2)[1]。

IL:白细胞介素
1.3IL-33/ST2通路 IL-33经过激活之后,可以转位到靶细胞的细胞膜上与受体相互作用,从而影响其下游的信号转导通路,还可以转位到靶细胞的细胞核,作为DNA核因子起作用。活化形式的IL-33在靶细胞膜表面与跨膜ST2受体,即ST2L及IL-1RAcP1(IL-1受体辅助蛋白)组成的受体复合物相结合,经过胞质结构域TIR与胞液形成二聚化,进入胞内,使下游的信号分子骨髓分化因子(MyD88)以及MAL(MyD88样衔接蛋白)激活。使IL-1相关激酶(IRAK)介导的TRAF6(肿瘤坏死因子相关因子6)活化。之后使下游的丝裂原激活蛋白激酶激活,再分别通过p38、c-Jun氨基端激酶、细胞外信号调节激酶激活,成为核转录因子AP-1,或者从TRAF6激活核因子κB激酶复合体抑制物,将复合体中的核因子κB释放出来。以上四种激活途径,使IL-33能转位到细胞核,作为核因子而起作用。如果靶细胞胞外的IL-33和sST2与SIL-1RAcP组成的受体复合物相结合,则不能通过跨膜进入胞内发挥其核因子的作用(图3)[8]。
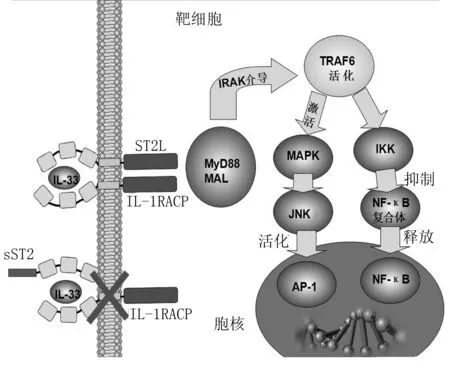
IL-33:白细胞介素33; IL-1RACP:白细胞介素1受体辅助蛋白; MyD88:髓样分化因子88; MAL:MyD88样衔接蛋白; TRAF6:肿瘤坏死因子受体相关因子6; MAPK:丝裂原活化蛋白激酶;JNK:c-Jun氨基端激酶; AP-1:活化蛋白1; IKK:核因子κB激酶抑制剂; NF-κB:核因子κB
2 IL-33/ST2信号通路和炎症性肠病的联系
IL-33/ST2信号通路在一些炎症相关性疾病中起重要作用,目前研究较为普遍的是哮喘、心血管疾病[9-10]。此外,还有过敏性鼻炎[11]、皮肌炎与多发性肌炎[12]、糖尿病[13]等。该信号通路在与消化系统疾病,尤其是炎症性肠病之间联系的研究仍然较少。近年来,Beltrán等[14]、Kobori等[15]、Pastorelli等[16]、Seidelin等[17]、Kakkar等[18]分别研究了IL-33/ST2通路与炎症性肠病的联系。
2.1IL-33/ST2在炎症性肠病的变化 Beltrán等[14]研究了活动期与非活动期的71例溃疡性结肠炎(ulcerative colitis,UC)患者,13例克罗恩病(crohn disease,CD)患者和20例健康对照者,炎症性肠病(inflammatory bowel disease,IBD)患者的血清ST2水平均高于健康对照组;其中,UC患者血清ST2水平与对照组相比显著升高,分析UC组、CD组和健康对照组的血清ST2中位数组间的差异,CD组与对照组、UC组与对照组、CD组与UC组的比较均有统计学意义;UC患者血清ST2中位数在活动期比非活动期升高,通过反转录聚合酶链反应分析sST2和ST2L亚型在IBD患者的肠黏膜组织中的表达,观察到的UC患者的sST2 mRNA聚合酶链反应产物比非活动期UC、CD和健康对照组表达增加,ST2L产物在各组之间并未显示出明显的差异,此外,UC组患者在活动期和非活动期比较,sST2 mRNA水平在UC活动状态较高(P=0.0281),使用了酶联免疫吸附试验法测量从活检组织提取出的ST2蛋白水平,IBD患者肠黏膜ST2水平显著高于健康对照组;活动期和非活动期UC患者肠黏膜ST2总含量之间无统计学意义;IL-33蛋白总含量组间差异明显,其中UC组高于对照组、UC组高于CD组;活动期UC患者比较非活动期表现出更高的IL-33水平,经过相关性分析,活动期UC患者血清ST2分别与组织ST2呈正相关(r=0.2374,P=0.0451),与血清IL-33呈正相关(r=0.2386,P=0.0443),与组织IL-33呈正相关(r=0.2450,P=0.040);非活动期UC患者的血清ST2与血清IL-33之间呈负相关(r=-0.5644,P=0.0059),该项研究首次显示了ST2和IL-33水平在IBD患者中表达升高,UC结肠黏膜ST2和IL-33的表达高于CD和健康对照组,而从外周血也能反映出这些变化,IBD和对照组外周血中的ST2水平与sST2有关,sST2 mRNA和其蛋白仅在活动期UC的肠道黏膜中显著升高,sST2水平在UC患者活动期增加,可能是因为UC的炎症过程中产生的促炎细胞因子增多。目前已有研究表明,IBD患者的成纤维细胞长期暴露于炎性刺激下,可表达sST2而非ST2L[19]。sST2升高可能是因为其对IL-33/ST2信号通路具有一定的调节作用。血清和结肠sST2水平升高与UC的活动程度相符合表明,该蛋白可能通过负反馈机制来控制炎症。IL-33/ST2信号通路是一个促炎系统,它可以促进IL-5、IL-6、IL-17生成增加,其中IL-17在慢性炎症肠道疾病中的重要作用较为明确。而这种促炎作用可以被sST2负向调节。许多促炎分子也属于该受体家族,例如IL-1R就是IL-1系统负反馈调节的一个典型例子。
2.2IL-33的双重调节作用 在Pastorelli等[16]研究发现,IBD患者的IL-33在核定位,其功能类似于IL-1α或高迁移率族蛋白B1(HMGB1),当定位到胞核时,有较强的转录抑制作用。此外,IL-33可能在核外也有作用,它主要在细胞受到损害发生坏死时被作为一种警戒物质释放,警告免疫系统存在威胁,并启动炎症级联反应,分泌出Th2相关的细胞因子[20]。这说明IL-33具有双重调节作用,在某些条件下作为细胞因子、转录因子,它可能根据靶细胞上的ST2,而不同程度地影响肠道黏膜。遇到被激活的免疫细胞,IL-33可增强免疫反应,进一步加剧炎性反应的程度。IL-33的促炎作用已经在动物模型中得到证实。在聚糖硫酸钠诱导溃结的小鼠模型中,IL-33腹腔注射给小鼠,可导致诸如嗜酸性粒细胞和单核细胞浸润,上皮细胞增生肥大,黏液分泌增多,血清IgA和IgE水平升高这些Th2型应答[21]。Groβ等[22]在该聚糖硫酸钠溃结小鼠模型中说明了外源性IL-33在可以使Th1型免疫反应向Th2型免疫反应倾斜。随后Pastorelli等[23]提出,IL-33的作用可能是诱导免疫细胞的聚集和激活到损伤部位,参与炎症和伤口愈合,它可能通过以上机制作用于肠道上皮细胞和成纤维细胞,诱导上皮细胞增殖和修复,促进伤口愈合。Kobori等[15]研究发现,IL-33可以特异性地表达于活动期UC患者溃疡性病变下方的肌纤维母细胞中,而CD患者则未见其表达,这表明与CD相比,IL-33在UC患者黏膜损伤/愈合中可能具有一定的功能。当IL-33/ST2信号异常时,上皮细胞增殖/修复受到阻碍,最终可能使肠道出现IBD的慢性炎症改变并且反复迁延不愈。除了IL-33,ST2也在IBD肠黏膜和血清升高,在非炎症结肠上皮中ST2表达丰富,但在UC或CD慢性炎症的上皮细胞,ST2的表达缺失、减少,重新分布。在活动期IBD患者的肠系膜组织中,ST2阳性细胞(抗原递呈细胞和T细胞)在固有层中清晰可见,ST2在内脏周围脂肪组织中强烈表达[16]。
2.3IL-33/ST2与肠黏膜各种细胞的可能联系 最近,García-Miguel试图对IL-33/ST2通路在IBD肠道黏膜促进炎症的机制进行更进一步细致的研究,得出结论(表1)[24]。

表1 肠道先天免疫细胞对IL-33刺激的反应
3 研究意义
炎症性肠病的生物标志物具有的特殊性:需要检测方便、微创、低成本、快速有效,能够评估不同个体疾病的发展风险、活动程度,监测疗效,对疾病的复发有一定的预测价值。目前,IBD的生物标志物包括血清特异性抗体,如抗中性粒细胞胞质抗体、抗酿酒酵母抗体、C反应蛋白、红细胞沉降率,粪便中的蛋白,如钙卫蛋白和乳铁蛋白。但是,这些标志物往往存在灵敏度或特异度偏低等缺点,不能及时或真实地反映肠道黏膜的损伤情况。sST2蛋白近期已被确定为一个可用于检测心脏衰竭,自身免疫性疾病和哮喘的可靠的生物学标志物,sST2能否作为一项可靠生物学标志物而用于IBD有待进一步研究[9-10,25]。Díaz等[26]对108例IBD患者(82例UC,26例CD)及43例非IBD健康对照者血清sST2进行分析,根据临床、内镜和病理特点分级,活动期患者血清sST2值(235.80 ng/L)显著高于非活动期(33.19 ng/L)患者,也高于非IBD和HC组;CD患者的血清sST2平均水平为54.17 ng/L,显著高于HC组;对比活动期和非活动期UC,在截断值为74.87 ng/L的情况下,灵敏度、特异度以及划分UC轻重能力的准确度分别为83.33%、83.33%和83.33%;根据受试者工作特征曲线评估其鉴别活动与非活动的能力,AUC值为0.92(0.86~0.97,P<0.0001);UC患者血清sST2与内镜(r=0.76,P<0.0001)和组织学评分(r=0.67,P<0.0001),促炎因子(r=0.69,P<0.0001),肿瘤坏死因子α(r=0.61,P<0.0001)均明显正相关;不同程度炎症肠道中ST2的水平和血清sST2水平也有正相关关系,分别是轻度(r=0.44,P=0.004)、中度(r=0.59,P=0.002)、重度(r=0.82,P=0.002)。这说明sST2水平与疾病严重程度与炎性因子相关,可能成为一种用以区分活动期与非活动期UC的生物学标记,并且可以评估疾病的严重程度。
4 小 结
IL-33/ST2信号通路介导主要参与了调节Th2细胞反应为主的炎症过程,是Th2细胞因子生成的关键调节通路之一,它可以引起炎症的组织病理学改变。对IL-33/ST2信号通路机制的详细研究,有助于研究炎症性肠病的新治疗靶点,比如临床上应用细胞因子受体阻断剂(肿瘤坏死因子α)治疗IBD并取得了一定成效[27]。此外,它可能有助于对IBD反复迁延不愈机制的研究。IL-33/ST2在炎症性肠病的作用及作用机制的研究仍相对有限,有待更多详细的研究进一步发掘其在临床诊疗中的价值。
[1] Lefrançais E,Roga S,Gautier V,etal.IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G[J].Proc Natl Acad Sci U S A,2012,109(5):1673-1678.
[2] Tominaga S.A putative protein of a growth specific cDNA from BALB/c-3T3 cells is highly similar to the extracellular portion of mouse interleukin 1 receptor[J].FEBS Lett,1989,258(2):301-304.
[3] Suzukawa M,Iikura M,Koketsu R,etal.An IL-1 cytokine member,IL-33,induces human basophil activation via its ST2 receptor[J].J Immunol,2008,181(9):5981-5989.
[4] Wood IS,Wang B,Trayhurn P.IL-33,a recently identified interleukin-1 gene family member,is expressed in human adipocytes[J].Biochem Biophys Res Commun,2009,384(1):105-109.
[5] Schmitz J,Owyang A,Oldham E,etal.IL-33,an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J].Immunity,2005,23(5):479-490.
[6] Choi YS,Park JA,Kim J,etal.Nuclear IL-33 is a transcriptional regulator of NF-κB p65 and induces endothelial cell activation[J].Biochem Biophys Res Commun,2012,421(2):305-311.
[7] van de Veerdonk FL,Netea MG,Dinarello CA,etal.Inflammasome activation and IL-1β and IL-18 processing during infection[J].Trends Immunol,2011,32(3):110-116.
[8] Miller AM.Role of IL-33 in inflammation and disease[J].J Inflamm(Lond),2011,8(1):22.
[9] Grotenboer NS,Ketelaar ME,Koppelman GH,etal.Decoding asthma:translating genetic variation in IL33 and IL1RL1 into disease pathophysiology[J].J Allergy Clin Immunol,2013,131(3):856-865.
[10] Willems S,Hoefer I,Pasterkamp G.The role of the Interleukin 1 receptor-like 1(ST2) and Interleukin-33 pathway in cardiovascular disease and cardiovascular risk assessment[J].Minerva Med,2012,103(6):513-524.
[11] Kamekura R,Kojima T,Takano K,etal.The role of IL-33 and its receptor ST2 in human nasal epithelium with allergic rhinitis[J].Clin Exp Allergy,2012,42(2):218-228.
[12] Yuan L,Yao L,Zhao L,etal.Serum levels of soluble ST2 and interleukin-33 in patients with dermatomyositis and polymyositis[J].Clin Exp Rheumatol,2013,31(3):428-432.
[13] Miller AM,Purves D,McConnachie A,etal.Soluble ST2 associates with diabetes but not established cardiovascular risk factors:a new inflammatory pathway of relevance to diabetes?[J].PLoS One,2012,7(10):e47830.
[14] Beltrán CJ,Núez LE,Díaz-Jiménez D,etal.Characterization of the novel ST2/IL-33 system in patients with inflammatory bowel disease[J].Inflamm Bowel Dis,2010,16(7):1097-1107.
[15] Kobori A,Yagi Y,Imaeda H,etal.Interleukin-33 expression is specifically enhanced in inflamed mucosa of ulcerative colitis[J].J Gastroenterol,2010,45(10):999-1007.
[16] Pastorelli L,Garg RR,Hoang SB,etal.Epithelial-derived IL-33 and its receptor ST2 are dysregulated in ulcerative colitis and in experimental Th1/Th2 driven enteritis[J].Proc Natl Acad Sci U S A,2010,107(17):8017-8022.
[17] Seidelin JB,Bjerrum JT,Coskun M,etal.IL-33 is upregulated in colonocytes of ulcerative colitis[J].Immunol Lett,2010,128(1):80-85.
[18] Kakkar R,Hei H,Dobner S,etal.Interleukin 33 as a mechanically responsive cytokine secreted by living cells[J].J Biol Chem,2012,287(9):6941-6948.
[19] Kumar S,Tzimas MN,Griswold DE,etal.Expression of ST2,an interleukin-1 receptor homologue,is induced by proinflammatory stimuli[J].Biochem Biophys Res Commun,1997,235(3):474-478.
[20] Palmer G,Lipsky BP,Smithgall MD,etal.The IL-1 receptor accessory protein(AcP) is required for IL-33 signaling and soluble AcP enhances the ability of soluble ST2 to inhibit IL-33[J].Cytokine,2008,42(3):358-364.
[21] Oboki K,Ohno T,Kajiwara N,etal.IL-33 is a crucial amplifier of innate rather than acquired immunity[J].Proc Natl Acad Sci U S A,2010,107(43):18581-18586.
[22] Groβ P,Doser K,Falk W,etal.IL-33 attenuates development and perpetuation of chronic intestinal inflammation[J].Inflamm Bowel Dis,2012,18(10):1900-1909.
[23] Pastorelli L,De Salvo C,Cominelli MA,etal.Novel cytokine signaling pathways in inflammatory bowel disease:insight into the dichotomous functions of IL-33during chronic intestinal inflammation[J].Therap Adv Gastroenterol,2011,4(5):311-323.
[24] García-Miguel M,González MJ,Quera R,etal.Innate immunity modulation by the IL-33/ST2 system in intestinal mucosa[J].Biomed Res Int,2013,2013:142492.
[25] Stragier E1,Van Assche G.The use of fecal calprotectin and lactoferrin in patients with IBD.Review.[J].Acta Gastroenterol Belg,2013,76(3):322-328.
[26] Díaz-Jiménez D,Núez LE,Beltrán CJ,etal.Soluble ST2:a new and promising activity marker in ulcerative colitis[J].World J Gastroenterol,2011,17(17):2181-2190.
[27] MacDonald TT,Biancheri P,Sarra M,etal.What′s the next best cytokine target in IBD?[J].Inflamm Bowel Dis,2012,18(11):2180-2189.

