微囊藻藻胆蛋白光敏杀虫剂毒杀机制研究
梁 杰, 武子涵, 黄 蓓
(安徽大学 生命科学学院, 合肥 230601)
目前,有害藻类引起的水体富营养化、水华已成为国内外普遍关注的环境问题,其中微囊藻水华是淡水水体中危害最严重的一类[1-2]。杀虫剂在农林病虫害防治方面发挥重要作用,但是由于化学农药本身的限制及不合理使用,造成了严重的环境污染[3-5]。光活化杀虫剂是最近几年发展起来的一种新型农药,它具有高效、低毒等特点[6-8]。目前,比较有效的光敏剂有染料类如赤藓红B,噻吩类如α-三噻吩4,卟啉类如血卟啉甲醚,生物碱类如呋喃喹啉碱等[9]。其中用于光活化杀虫剂研究的光敏剂主要有卟啉类、咕吨染料、植物源光毒素等[10]。MC-PBP提取自微囊藻,其主要功能是辅助色素能提高光合作用的电子传递效率。MC-PBP在光照后能产生活性氧等自由基,产生光活化作用,是一种潜在的光敏剂[11-12]。
本文探讨了MC-PBP光活化作用对果蝇(Drosophilamelanogaster)的半数致死浓度和致死剂量;通过研究MC-PBP对草地夜蛾卵巢细胞SpodopteaFrugiperda21 (SF21)的增殖抑制率、细胞内丙二醛(malondialdehyde, MDA)的生成量、细胞内还原型谷胱甘肽(glutathione, GSH) 水平变化的影响,研究MC-PBP光敏杀虫剂的作用和机理。
1 材料与方法
1.1 实验材料和试剂
草地夜蛾卵巢细胞SpodopteaFrugiperda21 (SF21)由中国科学技术大学蔡刚实验室惠赠。果蝇(Drosophilamelanogaster)由安徽大学生命科学实验教学中心提供。
MTT(溴化二甲噻唑二苯四氮唑)购于美国sigma公司;吖啶橙、异丙醇、甲醇、酵母粉、玉米粉、琼脂、蔗糖、硫代巴比妥酸(TBA)、5,5′-二硫代双-(2-硝基)苯甲酸( DTNB)、血卟啉甲醚(HMME)等购于合肥博美生物公司。
溶剂A 的配制:称取3 g SDS 溶于100 mL 异丙醇中, 用1 mol/L HCl 调pH 值至4.5, 置4℃ 冰箱中待用。
TBA-TCA-HCl溶液:用0.125 mol/L 盐酸配制16.8% TCA 溶液,将41.6 mg 硫代巴比妥酸(TBA) 溶于10 mL TCA-HCl溶液。
1.2 实验方法
1.2.1 MC-PBP的提取
采集自巢湖的微囊藻,晒干粉碎过350目筛后低温干燥保存。称取一定量的干藻粉破壁、离心、重悬、硫酸铵沉淀、PBS透析,通过光谱和色谱检测其纯度。
1.2.2 MC-PBP对果蝇的光活化毒杀作用
试验设置A组 (实验组)和B组 (对照组),每组MC-PBP浓度为0~4000 μg/mL。同时选取已报道的光敏剂HMME做为对照试验,设置C组(实验组),D组(对照组),浓度梯度同上。每管接入20只羽化4 d的果蝇,黑暗条件下,25℃恒温培养箱培养48 h。
果蝇培养48 h之后,将A组和C组置于自然光下平均光照强度47.5 klux光照累计时间90 min。B组和D组对照组在黑暗条件下继续培养,光照后计数A、 B、C和D组每孔线虫存活的个体数,移入黑暗处24 h后再次计数。计算死亡率和半数致死浓度LC50。
1.2.3 MC-PBP对SF21细胞增殖的影响
本实验以MTT 法测定细胞活力。试验设置实验组和对照组,MC-PBP浓度为0~400 μg/mL,将实验组置于自然光下平均光照强度47.5 klux光照累计时间90 min,而对照组在黑暗条件下继续培养培养相同时间。实验组在光照90 min之后,与对照组在黑暗条件下继续培养24 h或48 h之后, 每孔加入10 μL 5 mg/mL 的MTT,继续培养4 h。培养结束后每孔加入100 μL溶剂A, 酶标仪上测定OD575值,求出细胞存活率。
1.2.4 MC-PBP处理后细胞内丙二醛(MDA) 生成量测定
本实验以TBA 法测定MDA生成量。实验分组、MC-PBP浓度和光照强度及时间同1.2.3。实验组在光照后,与对照组在黑暗条件下继续培养24 h或48 h之后,加入2 mL TBA-TCA-HCl溶液,水浴、离心,取上清液在535 nm 处比色。计算MDA生成量。
1.2.5 MC-PBP处理后细胞内GSH相对含量测定
本实验以5,5′-二硫代双-(2-硝基)苯甲酸( DTNB) 法测定细胞内GSH 的相对含量。实验分组、MC-PBP浓度和光照强度及时间同1.2.3。实验组在光照后,与对照组在黑暗条件下继续培养24 h或48 h之后,加入0.25 mL 的DTNB 溶液,10 min 后在420 nm 处比色。计算细胞内GSH 的相对含量。
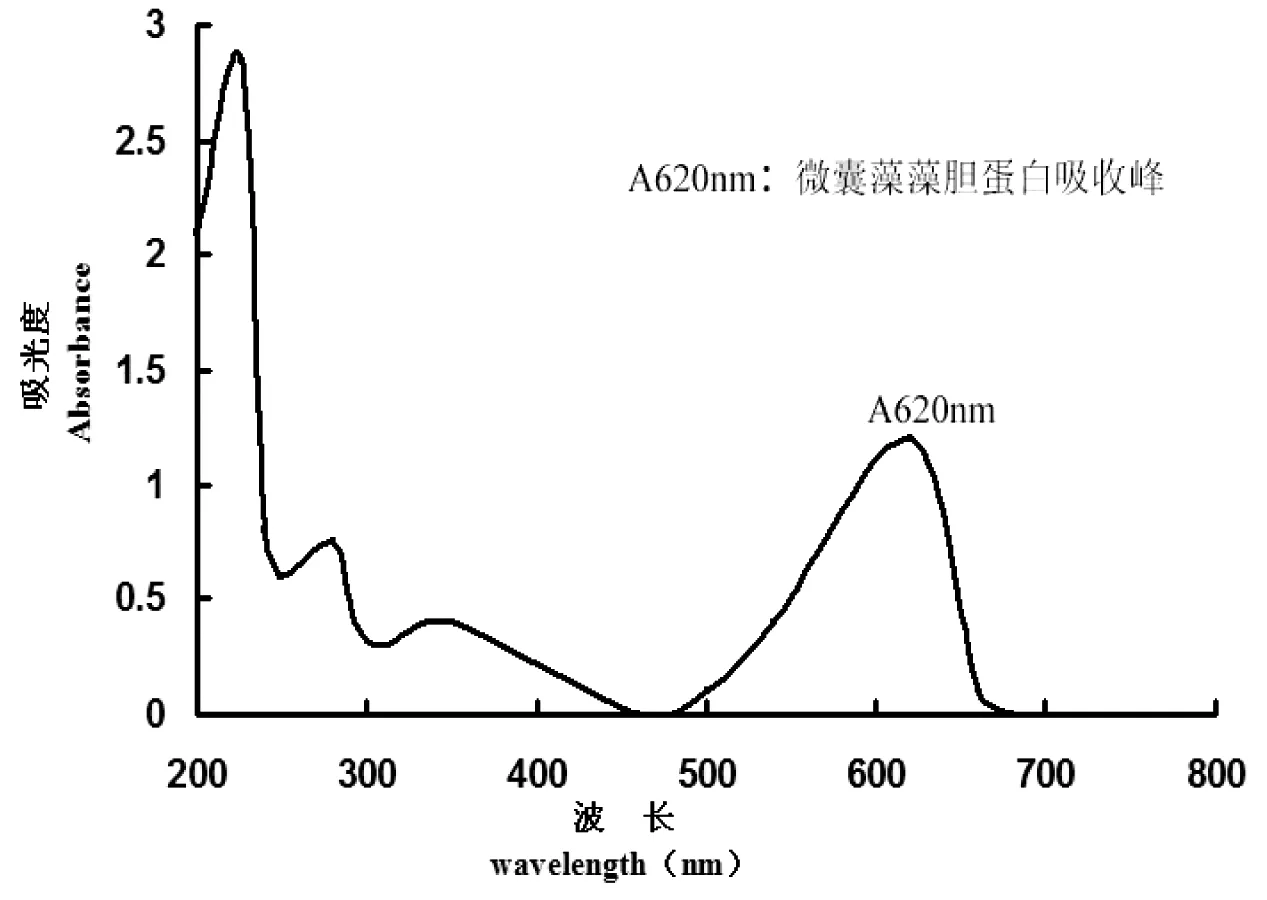
图1 微囊藻藻胆蛋白光谱图Fig 1 MC-PBP scanned with a full spectrum from 200 nm to 700 nm
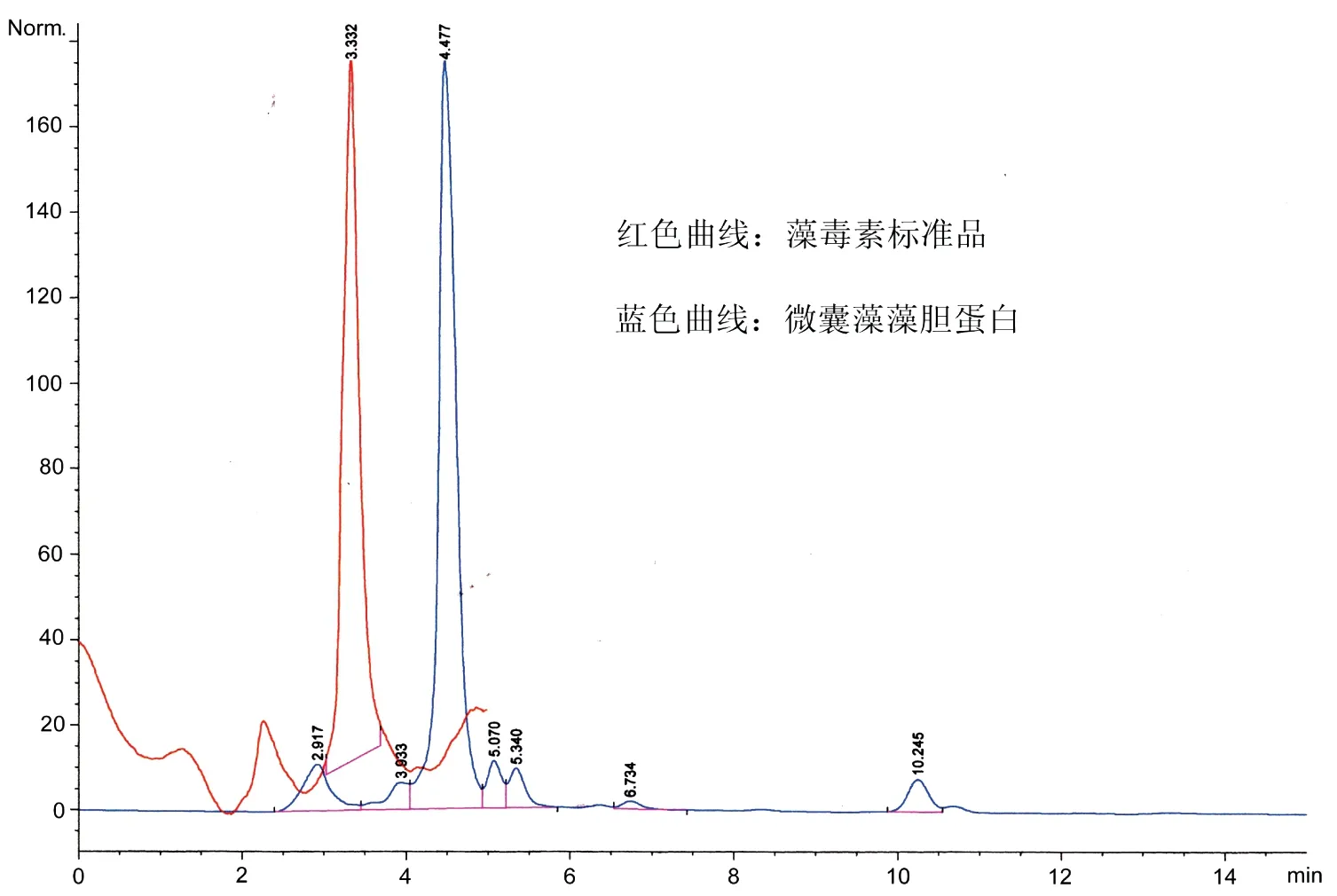
图2 微囊藻藻胆蛋白纯度的检测Fig 2 The purity of MC-PBP determined by HPLC
2 结果与分析
2.1 MC-PBP纯度的检测
MC-PBP在200~700 nm进行光谱扫描,MC-PBP在620 nm处有一个吸收峰(图1),而且 A620 / A280的比率是1.6。为检测提取的MC-PBP是否含有藻毒素,本实验用高效液相色谱的方法检测。图2所示,在238 nm处,标准品藻毒素出现峰值时间为3.332 min(红色曲线),而MC-PBP出现峰值时间是在4.477 min(蓝色曲线)。由此可知本实验所用MC-PBP不含藻毒素。
2.2 MC-PBP对果蝇的光活化毒杀效果
本实验选取光敏剂HMME作为实验对照组。HMME是国内研发的第2代光敏剂,与第1代光敏剂photofrinⅡ(混合物,主要含血卟啉)[13]相比它的优点是选择性更高、效应更强、毒性低而且避光时间更短[14]。目前,HMME主要作为光动力药物投入使用以治疗人体肿瘤疾病[15-16]和用作杀虫剂[17-18]。如图所示:与不光照的对照组(图3,B组)相比,A组随着MC-PBP浓度升高,其死亡率不断升高,且果蝇的LC50为750 μg/mL,致死剂量为4000 μg/mL(图3,A组);与D组相比,C组在0~4000 μg/mL范围内,HMME对果蝇的毒杀作用与其浓度成正相关且果蝇的LC50为1000 μg/mL(图3,C组)。与C组相比,A组即在相同浓度下,MC-PBP对果蝇的毒杀效果较HMME毒杀效果更好(图3)。
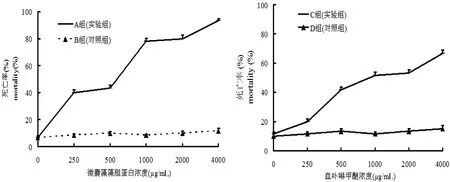
图3 微囊藻藻胆蛋白及血卟啉甲醚对果蝇光活化作用Fig 3 MC-PBP and HMME photoactivate for Drosophila melanogaster
2.3 MC-PBP对草地夜蛾卵巢细胞SF21的作用
在细胞及分子水平探讨MC-PBP光敏剂的毒杀机理,本实验选择具代表性的害虫草地夜蛾的卵巢细胞SF21为实验对象,在自然光光照强度47.5 klux,光照时间90 min,用MTT法检测细胞存活率。图4所示,在MC-PBP浓度0~400 μg/mL时,随着MC-PBP浓度的升高,对细胞的杀伤率增加。光照处理后24 h,400 μg/mL的MC-PBP对细胞的抑制作用达到45%(图4 A); 48 h之后,400 μg/mL的MC-PBP对细胞的抑制作用达到65%(图4 B),有显著性效果(*P<0.05)。
2.4 MC-PBP处理后SF21细胞内丙二醛(MDA) 生成量
MDA是脂质过氧化的终产物之一, 其生成量反映了细胞脂质过氧化的程度。本实验以TBA 法测定MDA生成量。
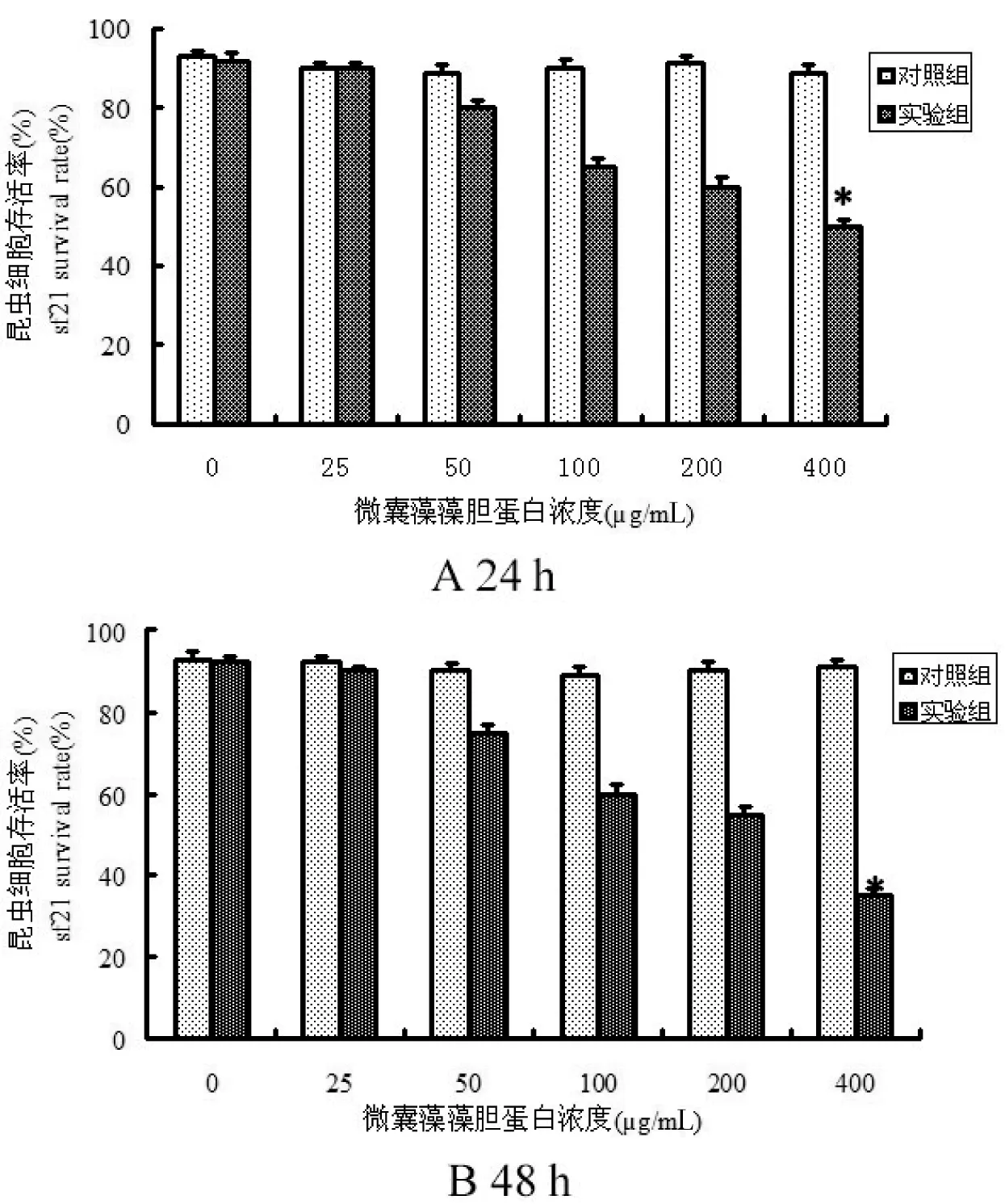
图4 藻胆蛋白对昆虫细胞SF21的作用Fig 4 Photoactivated toxicity of MC-PBP on SF21
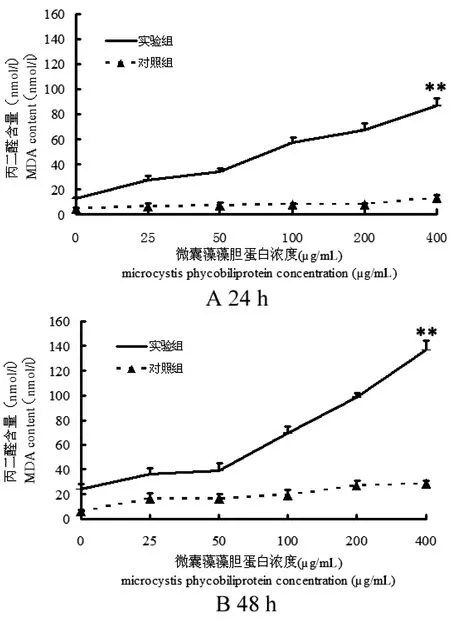
图5 藻胆蛋白光敏作用对SF21细胞内丙二醛(MDA) 生成量的影响Fig 5 Determination of malondialdehyde content in Sf21 cells
图5可知, 在MC-PBP浓度0~400 μg/mL范围内, SF21细胞内MDA含量明显升高,且MDA的生成量与其浓度呈正相关。光照24 h之后,MC-PBP浓度在400 μg/mL时,细胞内MDA含量为86.79 nmol/L (图5 A),光照48 h之后,细胞内MDA含量达到137 nmol/L (图5 B),有显著性效果。不同浓度MC-PBP处理细胞后, 对照组与光照组MDA生成量具有显著性差异(**P<0.01)。
2.5 MC-PBP处理后细胞内GSH相对含量
细胞内的还原型谷胱甘肽(glutathione,GSH)具有中和自由基、抗氧化的特性,其含量能直接说明细胞抗氧化损伤的能力。
图6可知, 光活化后的MC-PBP处理SF21细胞能导致细胞内还原型GSH相对含量随MC-PBP浓度升高而显著降低。光照24 h之后,MC-PBP浓度在400 μg/mL时,细胞内GSH相对含量降低42% (图6 A), 光照48 h之后,细胞内GSH相对含量则降低53% (图6 B)。由图可知随藻胆蛋白浓度升高, 细胞的抗氧化能力逐渐减弱。MC-PBP浓度相同时实验组与对照组有显著性差异(*P<0.05)。
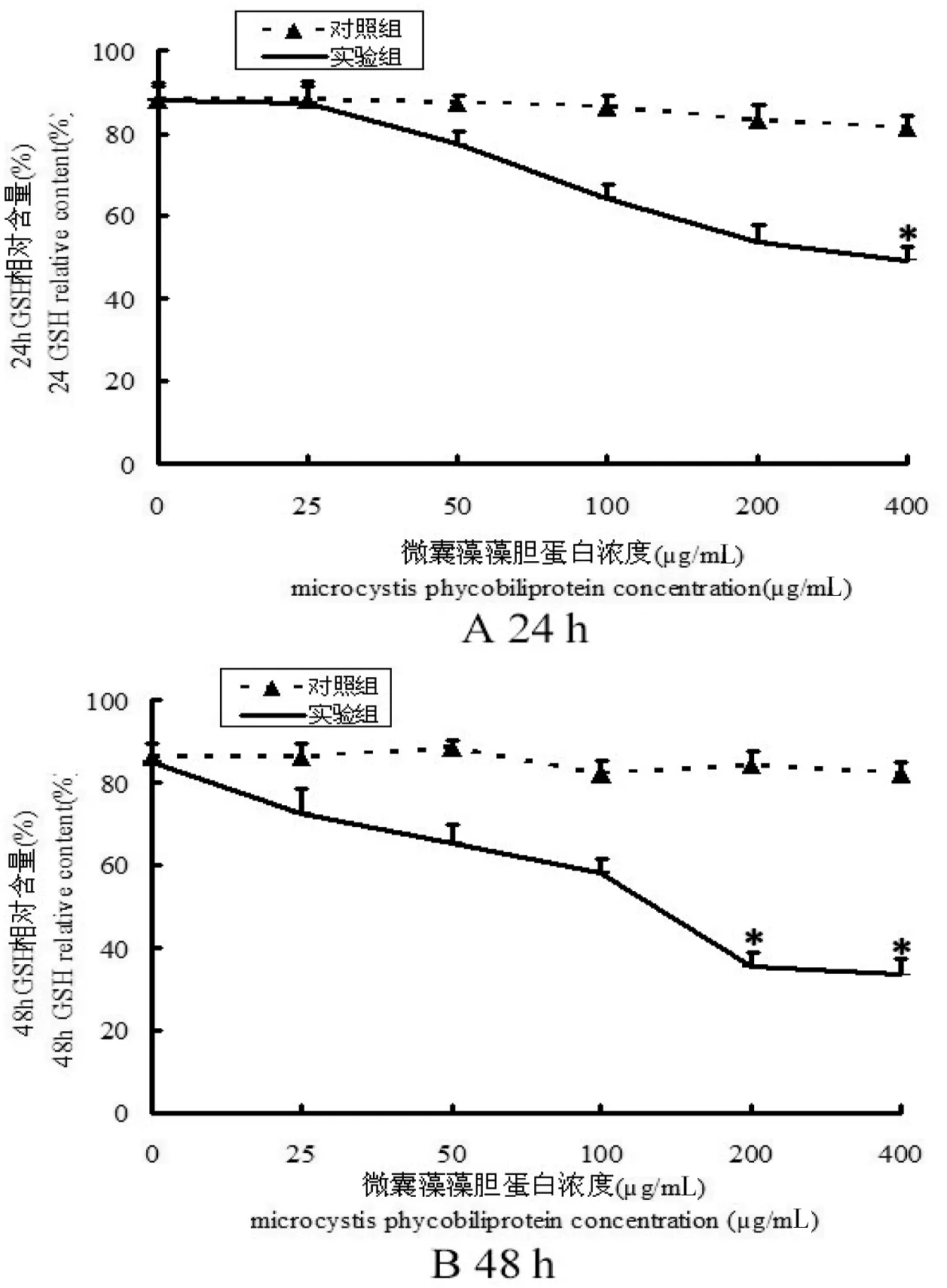
图6 藻胆蛋白处理后,SF21细胞内GSH相对含量Fig 6 Determination of GSH relative content in Sf21 cells
3 讨论
藻胆蛋白是重要的捕光色素蛋白,在光照时下,当存在合适的电子供体或电子受体,它能给出电子,产生自由基[19-21]。大量的自由基能够影响脂质的过氧化和GSH的抗氧化能力[22]。
本研究发现,光活化后的MC-PBP使细胞内MDA含量明显增加, 还原型GSH水平减少, 表明激发态的MC-PBP损伤SF21细胞是与细胞内脂质过氧化和SF21细胞抗氧化损伤能力的减弱有关。
实验中发现MC-PBP比HMME的效果要好,可能是因为MC-PBP较血啉甲醚对光有更宽的吸收范围[10]。
综上所述,本实验通过MC-PBP对果蝇和SF21细胞光活化作用的研究,阐述了MC-PBP光敏杀虫剂的毒杀机制;MC-PBP提取自微囊藻,不仅能让微囊藻变废为宝,而且能减少淡水水体富营养化和水华现象,还能克服化学农药带来的环境问题和耐药性问题。
参考文献:
[1]吕 晋, 邬红娟,马学礼,等.武汉市湖泊蓝藻分布影响因子分析[J].生态环境,2008,17(2):515-519.
[2]段成志.程海水环境质量现状及趋势分析[J].城市建设理论研究(电子版),2012,(3).
[3]郑美娟,于晓菲,王 健,等.湿地中农药的累积与净化[J].湖北农业科学,2013,52(8):1737-1742.
[4]侯改萍.谈谈化学农药[J].华 章,2012,(27):299.
[5]刘玉娟.怎样安全使用化学农药[J].农民致富之友,2011,(23):49.
[6]杨雪云,赵博光,魏启华.新的天然化合物杀虫剂——植物源光敏毒素[J].南京林业大学学报(自然科学版),2000,24(5):77-80.
[7]马金石,成 昊,张 驿,等.新型绿色农药——光活化农药[J].化学进展,1999,11(4):341-347.
[8]Wu R H, Hu S, Xu H H, et al. The synthesis and photolarvicidal activity of 2, 5-diarylethynylthiophenes[J]. J Photochem Photobiol B, 2007, 88(2/3):180-184.
[9]李 玥.光活化杀虫剂研究进展[J].化学进展,2004,16(1):110-115.
[10]王春梅,郑学礼.光活化杀虫剂的研究与应用[J].国际医学寄生虫病杂志,2007,34(1):46-49.
[11]李月梅,郭亚平,李 琦,等.卟啉杀虫剂对稻蝗的毒杀作用及机理初探[J].山西大学学报:自然科学版,2005,28(2):196-201.
[12]Dondji B, Duchon S, Diabate A, et al. Assessmentof laboratory and field assays of sunlight-induced killing of mosquito larvae by photosensitizers[J]. J Med Entomol,2005, 42(4):652-656.
[13]Helleck A M, Hartberg W K. Effects of photofrin II on adults ofEretmapoditesquinquevittatus[J]. J Am Mosq Control Assoc, 2000, 16(3):248-253.
[14]Gu Y, Huang N Y, Liang J, et al. Clinical study of 1949 case of port vine stains treated with vascular photodynamic therapy[J]. Ann Dermatol Venereol, 2007, 134(3):241-244.
[15]王嘉倍,刘连新,王晨宇,等.血卟啉单甲醚对人肝细胞癌细胞系HepG_2的光动力杀伤效应[J].中华肝胆外科杂志,2009,15(12):924-927.
[16]刘力华,黄明辉,张宏波,等.血卟琳单甲醚光敏剂光动力学疗法对人乳腺肿瘤细胞生长周期的阻滞作用及其凋亡研究[J].中国综合临床,2011,27(9):945-947.
[17]Tronchin B A M, Bortolotto L, Verdiglione R, et al. Porphyrins and related compounds as photoactivatable insecticides 1 phototoxic activity of hematoporphyrin towardCeratitiscapitataandBactroceraoleae[J]. Photochemistry and Photobiology, 1998, 67(2):206-211.
[18]Tronchin B A M, Bortolotto L, Jori G. Porphyrins and related compounds as photoactivatable insecticides. 3. Laboratory and field studies[J]. Photochem Photobiol, 2000, 71:123-127.
[19]王塔娜,邰丽华,图雅嘎日拉,等.节旋藻藻胆蛋白对果蝇性活力及繁殖能力的影响[J].内蒙古师范大学学报:自然科学汉文版, 2010, 39(6): 608-611.
[20]吴华莲,陈填烽,尹 希,等.硒对钝顶螺旋藻氧化损伤的拮抗作用的光谱学特性及机制[J].光谱学与光谱分析,2012,32(3):749-754.
[21]张晓平,李慧芬.藻蓝蛋白抗肿瘤及其作用机制研究进展[J].医学研究杂志,2013,42(9):26-28,41.
[22]王塔娜,邰丽华,敖 恩,等.节旋藻藻胆蛋白对果蝇总抗氧化能力和丙二醛的影响[J].中国老年学杂志,2012,32(21):4695-4687.

