分离自象山港的15种海洋微藻脂肪酸比较研究
芦文奇, 周海波, 陈 娇, 徐继林, 周成旭, 马 斌, 严小军
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
微藻是海洋初级生产力的主要组成部分,多种海洋生物体内的脂肪酸都是通过摄食海洋微藻而获取[1]。如沿海滩涂贝类的主要饵料来源是某些特定的海洋微藻,这些微藻细胞中脂肪酸的含量及种类直接影响着滩涂贝类的生长发育[2-3]。目前滩涂贝类人工育苗中沿用的饵料微藻均来自国内屈指可数的几个微藻种质库,长期的扩繁使得实际生产中繁殖能力和营养品质大大降低,急需筛选出品种更多、脂肪酸适宜、适合在不同温度条件下繁殖以及繁殖能力迅速的优良饵料微藻品种,以满足品种日益丰富、规模越来越大的滩涂贝类苗种培育的要求。其中,脂肪酸组成是衡量微藻饵料效果的最主要指标[4-7]。
象山港是浙江省一重要港湾,湾内海洋单细胞微藻丰富,为湾内多种经济贝类及其他海产动物的生长繁殖提供了充足的饵料供应。本研究从象山港分离出了15种微藻并进行扩大培养,并对其脂肪酸组成进行了检测和分析研究,以期为海产动物尤其是滩涂贝类新型饵料的探索提供营养学方面的理论基础。
1 材料与方法
1.1 微藻样品及培养
微藻藻种由宁波大学海洋生物教育部重点实验室藻种室提供,均分离自浙江省象山港,共15株, 隶属于5个纲,分别是:中心硅藻纲(Coscinodiscophyceae)的脆根管藻(Rhizosoleniafragilissima)/1、布氏双尾藻(Ditylumbrightwellii)/2、中华盒形藻(Bidduphiasinensis)/3、佛氏海毛藻(Thalassiothrixfrauenfeldii)/4、威氏海链藻(Thalassiosiraweissflogii)/5及假微型海链藻(Thalassiosirapseudonana)/6;针胞藻纲(Raphidphyceae)的赤潮异弯藻(Heterosigmaakashiwo)/7;纵裂甲藻纲(Desmophyceae)的海洋原甲藻(Prorocentrummicans)/8和尖叶原甲藻(Prorocentrumtriestinum)/9;甲藻纲(Dinophyceae)的锥状斯克里普藻(Scrippsiellatrochoidea)/10、共生甲藻(Symbodiniumsp.)/11、沃氏藻(Woloszynskiasp.)/12、米氏凯伦藻(KareniamikimotoiHasen)/13及裸甲藻(Gymnodiniumsp.)/14和颗石藻纲(Coccolithophyceae)的颗石藻(Pleurochrysissp.)/15。微藻培养海水经0.45 μm醋酸纤维滤膜过滤后煮沸冷却,培养液采用浙江水产学院三号配方(盐度25)。藻种先在5 L的锥形瓶中自然光培养1周,培养温度为(20±2)℃。后部分转入光生物反应器,在 160 μmol.m-2.s-1光强,(20±2)℃下培养1周左右,每天测定微藻密度,当到达稳定期后,4000 r/min下分别对瓶中的藻和光生物反应器中的藻离心收集,冷冻干燥,-20℃下充氮冷冻保存。
1.2 样品预处理
准确称取3份100 mg左右的微藻干品,分别参考改进后的Bligh-Dyer法[8]提取总脂于4 mL棕色带密封盖的样品瓶中。样品瓶使用前洗净烘干后置于干燥器中保存,用分析天平准确称重,总脂提取后置于干燥器中12 h后用分析天平准确称重,两者之差得到总脂准确重量,结果取均值。
总脂提取后加入2 mL 5%~6%氢氧化钾甲醇水(V/V为4∶1)溶液,充氮气1 min,密封,60℃水浴皂化2 h, 冷却,氯仿: 正己烷(V/V 1∶4)6 mL分3次提取,加入1 g无水硫酸钠吸水12 h,旋转蒸发仪真空干燥,加入100 μL过量BSTFA,密封,60℃水浴2 h,N2吹干,正己烷定容,进行GC-MS分析。
1.3 GC-MC分析
采用QP2010气相色谱-质谱联用分析仪(日本SHIMADZU公司)进行GC-MS分析[9]。GC条件:色谱柱采用30 m ×0.25 mm×0.25 m SPB-50色谱柱(美国SUPELCO公司),进样口的温度为250℃,载气为高纯氦,流速为0.81 mL/min,柱前压73.0 kPa。起始温度为150℃,保持3.5 min后,以20℃/ min升至200℃,保持5 min,再以5℃/ min升至280℃,保持30 min。分流进样,分流比为50∶1。MS条件: 用EI源分析时电子能量设为70 eV,离子源温度为200℃,接口温度为250℃,选择SCAN模式,质量扫描范围为40~600,溶剂延迟3.5 min。用CI 电离源分析时反应气为甲烷。定性分析:选用C19∶0脂肪酸作为内标,其他组分各自相对C19: 0脂肪酸的保留时间作为定性依据。从GC-CIMS-TIC图中各组分的质谱,可以初步确定出各组分的分子量,再根据GC-EIMS-TIC中各组分的离子碎片质量谱图,通过NIST 库并参考脂肪酸标准进行鉴定。定量分析:在50 mg左右的微藻样品中准确加入50 μg C19∶ 0 脂肪酸标准物质作为定量内标,再用内标法计算各组分在样品中的含量。
2 结果与讨论
2.1 总脂含量
15株微藻在给定条件下培养14 d左右,在稳定期后收集并冷冻干燥,通过Bligh-Dyer法提取总脂得到各样品总脂占干重含量(表1)。表1可见,从象山港分离的15株微藻总脂含量在4.46%~19.8%之间,其中总脂含量高于10%的有9种,分别是布氏双尾藻、佛氏海毛藻、赤潮异弯藻、海洋原甲藻、尖叶原甲藻、斯克里普藻、共生甲藻、沃氏藻和米氏凯伦藻,而脆根管藻和假微型海链藻含量较低,不足5%。
大型藻的总脂含量仅为干重的1%左右[10],可见海洋微藻的总脂含量总体远高于大型藻类。微藻的总脂含量代表了藻类积累脂类的能力。有研究表明[11],微藻总脂含量会随着培养时间的增加而不断增加,到平台末期达到最高,所以研究不同海洋微藻间总脂含量差别需要控制在同一个培养时期进行收集。
2.2 微藻的脂肪酸组成
根据气相色谱质谱总离子图中各分离的离子碎片质量图谱通过检索并参考脂肪酸标准,从15株微藻中一共鉴定出23种脂肪酸(表2)。其中,饱和脂肪酸有10种,单不饱和脂肪酸4种,多不饱和脂肪酸9种。
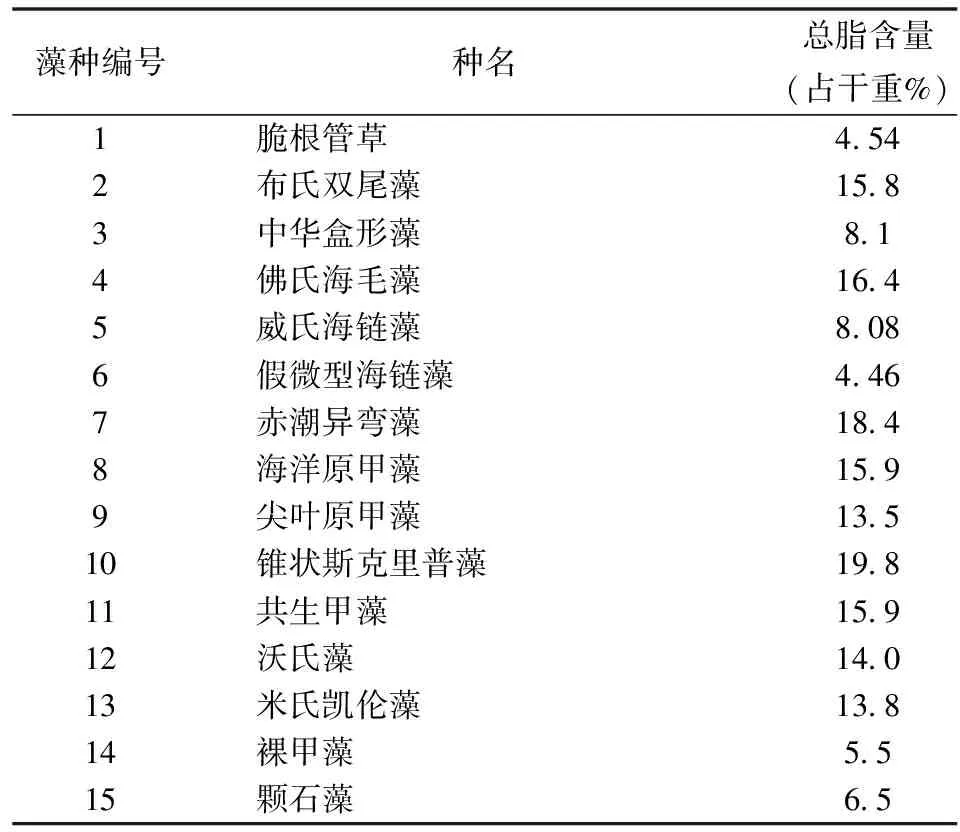
表1 15种微藻脂肪酸总脂含量
2.2.1 中心硅藻纲的脂肪酸组成
从象山港新分离出的15种微藻中,隶属于中心硅藻纲的微藻有6种。总体而言,这6种硅藻均含有高比例的C14、C16和C20系列脂肪酸,18C系列的脂肪酸含量很低,尤其含有高比例的C14∶0、C16∶0、C16∶1(n-7)脂肪酸和EPA,并含有一定含量的DHA,这些特性均符合标准的硅藻纲微藻的脂肪酸特征组成[14]。
虽然这6种中心硅藻纲微藻总体脂肪酸组成相近,但各种微藻间仍存在一定的差异。脆根管藻、布氏双尾藻、中华盒形藻和威氏海链藻中含量最高的脂肪酸均为EPA,占总脂肪酸的比例均超过20%,其中中华盒形藻的EPA含量高达31.38%,另从威氏海链藻也检测到超过5%的DHA,其他3种DHA的含量也在2%左右。
这6种中心硅藻纲微藻中,佛氏海毛藻跟其他几种藻有较大区别,主要表现在C14∶0、C16∶1(n-7)和C18∶1(n-7)脂肪酸均比其他5种藻中对应的脂肪酸比例要高,相反DHA和EPA的含量则要比其他5种藻要低。事实上在本文报道的所有15种微藻中,该藻所含的C14∶0、C16∶1(n-7)和C18∶1(n-7)脂肪酸占对应微藻总脂肪酸的比例均是最高,分别高达34.27%、24.83%和6.67%。
2.2.2 针胞藻纲的脂肪酸组成
本文研究的15种象山港微藻中,只有赤潮异弯藻隶属于针胞藻纲。赤潮异弯藻作为一种常见的海洋赤潮品种,许多研究者开展了大量关于该藻对其他海洋生物的影响研究,还未见其脂类组成特别是脂肪酸组成的研究报道。本文从该藻中共检测出19种脂肪酸(表2),跟中心硅藻纲明显不同,其C14系列脂肪酸含量相对较低,而C16、 C18和 C20系列的脂肪酸含量均较高,尤其含有高组分含量的C16∶0、C18∶4(n-3)和EPA,其中EPA含量高达35.25%,在本文研究的15种微藻中含量最高。
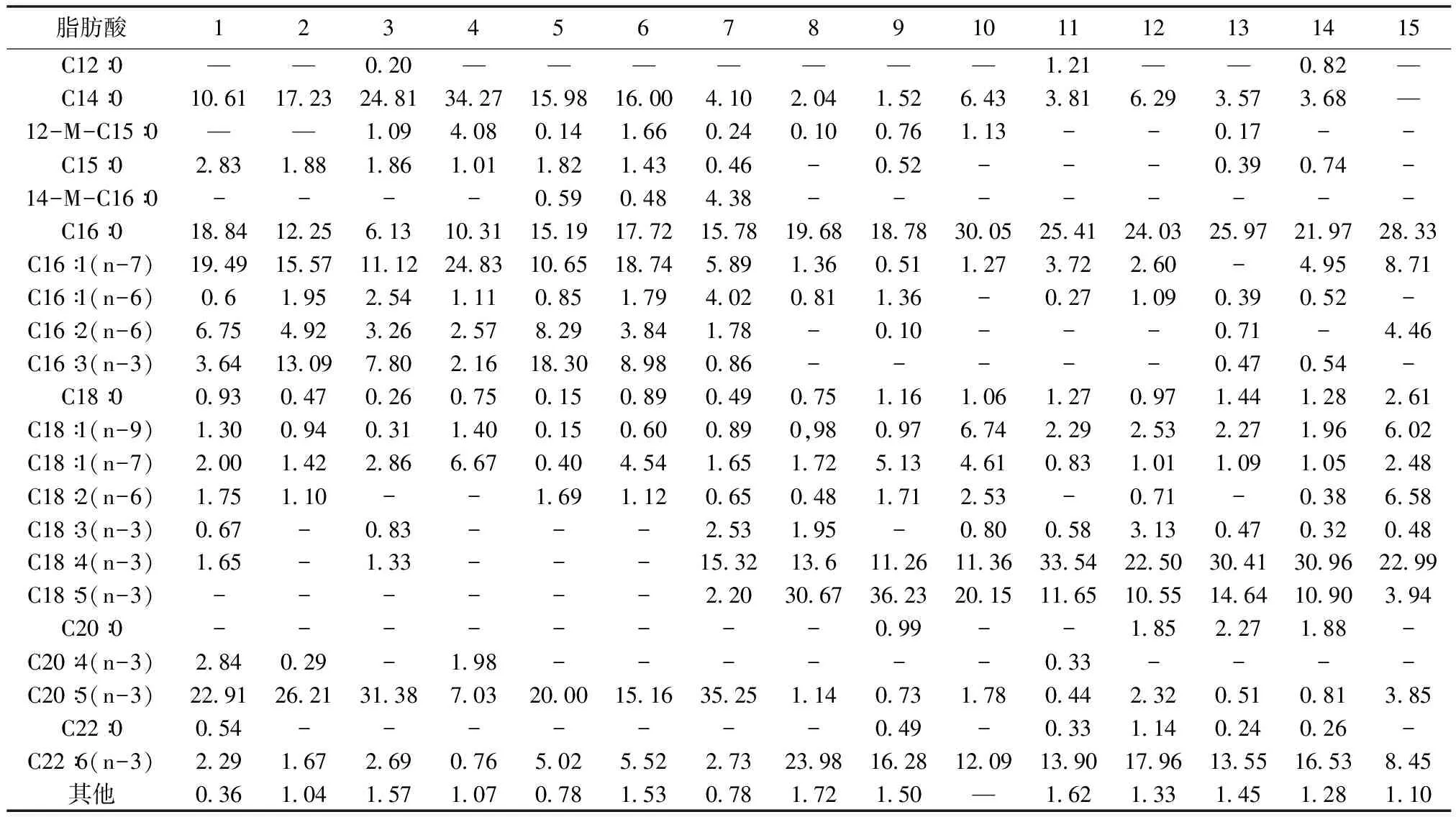
表2 15种微藻的脂肪酸组成
2.2.3 纵裂甲藻纲的脂肪酸组成
海洋原甲藻和尖叶原甲藻这两株隶属于纵裂甲藻纲的微藻,也显示出跟其他藻类明显不同的脂肪酸组成,其C18和C22系列的脂肪酸明显高于其他藻类,而C14和C15脂肪酸含量相对较低,C16不饱和脂肪酸也明显较低。其中EPA的含量明显不如前两纲的微藻,含量较高的脂肪酸为C16∶0、C18∶4(n-3)、C18∶5(n-3)和DHA,特别是两种高度不饱和脂肪酸C18∶5(n-3)和DHA,占总脂肪酸含量分别超过30%和16%,在所有微藻中均是最高,考虑到这2种藻的总脂含量也都超过微藻干重的15%,所以这两种藻在饵料营养和人体健康营养开发研究方面将有着较广泛的前景。
2.2.4 甲藻纲的脂肪酸组成
从象山港新分离出的15种微藻中,隶属于甲藻纲的微藻有5种。从总体脂肪酸分布来看,跟纵裂甲藻纲的脂肪酸组成比较接近,主要几个高含量组成的脂肪酸也是C16∶0、C18:4(n-3)、C18∶5(n-3)和DHA,几乎不含有C15∶0系列脂肪酸。跟纵裂甲藻纲不同的是,其C16:0含量总体要比在纵裂甲藻纲中的含量高。另外,虽然甲藻纲和纵裂甲藻纲的C18∶4(n-3)和C18∶5(n-3)含量均较高,但纵裂甲藻纲的C18∶5(n-3)含量是C18∶4(n-3)含量的3倍左右,而在甲藻纲中相反,除了锥状斯克里普藻外,其他藻中C18∶4(n-3) 含量均是C18∶5(n-3)含量的2~3倍。至于锥状斯克里普藻中该现象为什么跟其他甲藻相反,还需在化学分类学上进一步研究和探讨。
2.2.5 颗石藻纲的脂肪酸组成
颗石藻又称钙板金藻、园石藻,属于定鞭藻门、颗石藻纲、钙质鞭毛藻科,是一种比较特殊的藻类,能产生由碳酸钙构成的外壳(颗石粒),死后这些碳酸钙会沉积到海底,在海洋碳循环中扮演着重要的角色。本文从颗石藻中共检测出13种脂肪酸,其中含有高比例的C16∶0和C18∶4(n-3),含量跟甲藻纲中相近。另外含有一定含量C16∶1(n-7)、C18∶1(n-9)、C18∶2(n-6)、EPA和DHA,这些特性跟金藻纲的微藻脂肪酸特性非常接近[14],不同的是,其碳数低于15的脂肪酸系列在颗石藻中没有检测到。
2.3 讨论
本研究中的15种微藻分别隶属于5个门纲,其中,中心硅藻纲中共有的含量相对较高的主要脂肪酸为C14∶0、C16∶0、C16∶1(n-7)和EPA,针胞藻纲的赤潮异湾藻则含有高比例的C16∶0、C18∶4(n-3)和EPA,纵裂甲藻纲和甲藻纲中共有的含量相对较高的主要脂肪酸为C16∶0、C18∶4(n-3)、C18∶5(n-3)和DHA,而隶属于定鞭藻门颗石藻纲的颗石藻含量相对较高的主要脂肪酸分别为C16∶0和C18∶4(n-3)和DHA,各纲间脂肪酸组成各异,跟很多研究得出的各纲的主要脂肪酸种类一致[12-14],说明微藻中的脂肪酸确实可以作为微藻化学分类的重要参考依据。
早在20世纪就有许多研究已经表明哺乳动物的生长发育离不开其自身所不能合成的不饱和脂肪酸,而直到1972年,水产动物对饵料中不饱和脂肪酸的需求才得以确定[15]。脂类为水产动物幼体变态过程提供重要的营养基础,如淡水鱼需要亚油酸和亚麻酸等,而海水鱼除了上述的脂肪酸外,还需要AA(花生四烯酸)、EPA(二十碳五烯酸)及DHA(二十二碳六烯酸)等高级不饱和脂肪酸。表2中的数据是以各种脂肪酸所占总脂含量的百分比来表示,是一个相对含量。在评价某种微藻的脂肪酸含量是否能满足某种水产动物的营养需要时,还应考察这种微藻的总脂含量的多少。一般认为总含量达到10%且富含EPA 和DHA的微藻是优质饵料的选择品种[16], 如总脂含量偏低和缺乏EPA和DHA 等长链不饱和脂肪酸,对贝类、虾等的饵料效果不好。微藻的总脂含量和各种脂肪酸的组成比例,是构成微藻营养价值的主要限制因素之一[17]。
本文所测定的15种微藻总脂含量绝大部分接近或高于10%,所以EPA和DHA的含量可以作为是否是优质饵料微藻的参考指标。15种微藻中均含EPA和DHA,只是各藻类的含量有所差别,中心硅藻纲微藻和针胞藻纲微藻EPA含量很高,而纵裂甲藻纲、甲藻纲和颗石藻的DHA含量相对较高,因此在实际生产中可通过饵料的组合投喂方式实现营养的均衡化,如将含有高量EPA的中心硅藻纲微藻跟含高含量DHA的甲藻纲或定鞭藻混合投喂,从而实现在实际生产过程脂肪酸的均衡供给。当然,培养过程中一些甲藻可能会产生一定的生物毒素,从而危害到培养生物,所以最终一种藻能否作为生物的优质饵料,还需要在生产过程中进行预先投喂实验以确定其实际饵料效果。
参考文献:
[1]Dalsgaard J, St John M, Kattner G, et al. Fatty acid trophic markers in the pelagic marine environment [J]. Advances in Marine Biology, 2003, 46: 225-340.
[2]Thompson P A, Harrison P J. Effect of monospecific algal diets of varying biochemical composition on the growth and survival of Pacific oysters (Crassostreagigas) larvae[J]. Mar Biol, 1992, 13: 645-654.
[3]Utting S D, Millican P F. Techniques for the hatchery conditioning of bivalve brood stocks and the subsequent effect on egg quality and larval quality. In: Lavens, P, Jaspers E, Roelants l.(Eds.), Larvi′9-Fish and Shellfish Larviculture symposium [J]. European Aquaculture Society, 1995, 24: 64-71.
[4]Soudant P, Marty Y, Moal J, et al. Effect of food fatty acid and sterol quality onPectenmaximusgonad composition and reproduction process[J]. Aquaculture, 1996, 143:361-378.
[5]Thompson P A, Guo M, Harrison P J. Nutritional value of diets that vary in fatty acid composition for larval Pacific oysters (Crassostreagigas)[J]. Aquaculture, 1996, 143: 379-391.
[6]Hannich J T, Umebayashi K, Riezman H. Distribution and functions of sterols and sphingolipids[J]. J Cold Spring Harb Perspect Biol, 2011, 3(4): 47-62.
[7]Soudant P, SanIes M V, Quere C, et al. The use of lipid emulsions for sterol supplementation of spat of the Pacific oyster,Crassostreagigas[J]. Aquaculture, 2000, 184: 315-326.
[8]Bligh E G, Dyer W J. A rapid method lipid extraction and purification[J]. Can J Biochem Physiol, 1959, 37: 911-923.
[9]徐继林, 严小军, 朱艺锋,等. 一种饵料微藻的脂肪酸甾醇分析及化学分类的探讨[J]. 海洋学报, 2005, 27(4): 121-126.
[10]俞建江, 李荷芳, 周汉秋. 10种海洋微藻总脂、中性脂和极性脂的脂肪酸组成[J]. 水生生物学报, 1999, 23(5): 481-487.
[11]Su X L, Xu J L, Yan X J, et al. Lipidomic changes during different growth stages ofNitzschiaclosteriumf. minutissima[J]. Metabolomics, 2013,9:300-310.
[12]李荷芳, 周汉秋. 海洋微藻脂肪酸组成的比较研究[J]. 海洋与湖沼, 1999, 30(1) : 34-39.
[13]蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报, 2003, 27(3): 243-247.
[14]徐继林, 严小军. 脂类分析在海洋微藻化学分类学上的研究进展[J]. 海洋通报, 2004, 23(2): 65-72.
[15]代田昭彦. 水产饵料生物学[M]. 恒星社厚生阁版, 1972: 303-333.
[16]马志珍. 常用微藻饵料效果的综合评价[J]. 现代渔业信息, 1992, 11(7): 12-19.
[17]李爱杰. 中国对虾配合饵料研究概况[J]. 海洋渔业, 1988, 10(4): 128-160.

