细菌群体感应信号网络及其应用
徐 芳, 李 军, 段云飞, 刘晓光
(江苏大学 生命科学研究院, 镇江 212013)
异源的种群和环境对微生物的生存和行为均产生显著影响,也赋予它们与生俱来的社会性。迄今无论是真菌还是细菌中都发现存在群体感应(Quorum sensing, QS)现象。群体感应的概念最初在1994年由Fuqya等人提出,而首次发现QS现象的是Hastings与他的同事。他们发现当海洋费氏弧菌Vibriofischeri的种群密度达到一定阈值时具有生物发光的功能[1]。QS 是细胞与细胞间的通讯系统,通过产生和感应化学信号分子,以物种复杂性和种群密度依赖的方式同步调控一组基因的表达。进一步与其它调控系统进行整合形成多层次的信号转导网络,使细菌不仅能感应局部种群密度信号,同时整合各种环境信号,并迅速作出应答以控制自身重要的生物学过程。细菌利用QS调控系统以群体协作的方式对种群的社会行为产生影响,使之获得竞争优势,从而大大增强了微生物在环境中生存的几率。QS作为新的分子靶标在农业、医药和环保等领域已展示出诱人的应用前景[2-3]。
细菌QS信号分子具有多样性。用于种内交流的信号分子,也称为自我诱导物(autoinducers, AIs) 主要包括G+细菌产生的寡肽和G-细菌产生的乙酰基高丝氨酸内酯(N-acylhomoserine lactones, AHLs),铜绿假单胞菌(Pseudomonasaeruginosa)等还产生喹诺酮PQS信号[4],以及黄单胞菌Xanthomonas产生的扩散性信号分子DSF等[5];以及用于种间交流的呋喃酮酰硼酸(AI-2)[6]。然而G-变形杆菌纲中主要依赖AHL介导的LuxI/LuxR 型QS系统。同时AHLs信号分子可根据C3 位置有无取代基(3-O 或3-OH 或无),以及乙酰基侧链长度进行分类。
LuxI/LuxR 型QS系统的组成及功能。以V.fischeri为例,经典的QS系统由LuxI和LuxR 2个蛋白组成。LuxI是AHL信号分子合成酶,LuxR则作为信号反应调节子。LuxR作为受体蛋白与信号分子结合,形成受体-自体诱导物复合体,然后与靶基因启动子上的一段20 bp的反向回文序列(luxbox)结合,激活(或抑制)荧光素酶基因簇luxCDABE和其它靶基因的转录,包括luxI基因自身正调控。LuxI/LuxR同源物目前已在100多种细菌中被鉴定[7]。大量研究已表明:作为转录水平的全局调控系统,QS调控的表型是多样的,如生物发光,水平基因转移,生物膜形成,致病性和产生抗生素和其它次生代谢物等;然而它们的进化选择主要基于种群密度依赖的协同基因表达所传递的竞争优势[8-11]。有趣的是某些细菌种中同时存在多个QS回路组成复杂的信号网络,对于调控细菌生理、行为和环境适应性发挥至关重要的作用。
1 群体感应信号网络及其功能
随着研究的深入,相继发现多种细菌具有两个以上的QS系统,且不同QS系统间相互作用,允许细菌在2个不同的基因表达程序之间切换:一种程序有利于在低细胞密度下的非社会性个体行为;另一种程序则有利于在高细胞密度下的群体和社会行为[12]。
1.1 铜绿假单胞菌(P. aeruginosa)的QS系统
条件致病菌P.aeruginosa是具有复杂QS系统的典型代表,调控细菌10%的基因,这需要消耗细菌自身大量ATP,所以不同QS系统的启动具有严格的时序性,而不是同时表达,受到精细调控。其中最先发现的2个AHL-介导的LasRI(主要合成长链3-O-C12-HSL)和RhlRI(负责合成短链C4-HSL)系统,后来发现还有第3个QS系统依赖于喹诺酮PQS信号,主要在指数生长阶段后期产生;而RhIR和RhII组成的QS回路首先被启动,在入侵宿主时发挥主导作用,如在宿主表面形成生物膜,抵抗外界条件(如抗生素等)对细菌的破坏;当侵入宿主后,PQS是主要调控因素,负责产生毒力因子等次生代谢物,直接对宿主产生致病性。
此外, 3个系统互相调控,更好地适应环境。LasRI通过调控弹性蛋白酶和外毒素影响致病性,而rhlRI还可调控铁载体和绿脓菌素,研究发现,不是所有致病因子均由前两者调控,PqsR-PQS也调控部分致病基因,且这部分致病基因不受前两个QS调控;同时3个QS系统相互作用,而且共同调控许多靶基因,比如,lasRI位于rhlRI的上游,是QS网络系统的主控因子,它激活下游RhlRI系统的表达[13],并且通过激活PqsH、PqsR上调PQS,而RhlR则通过抑制PqsR、PqsABCD下调PQS系统;同时PQS可上调rhlI和lasRI的表达[7],这表明,PQS建立了rhlI和lasRI的调控关系。综上研究结果表明,第3个QS系统PqsR-PQS对细菌自身致病性及对环境适应力方面增加了另外一层的控制。
1.2 植物共生根瘤菌Rhizobium leguminosarum的多个QS系统
在植物相关细菌中具有多个QS系统的代表是豌豆根瘤菌R.leguminosarumbv.viciae,已经鉴定由raiIR,rhiIR,cinIR和traIR4个QS系统组成,在固氮根细菌与宿主植物建立共生互作关系中发挥重要作用。其中cinIR位于染色体上,产生3-OH-C14∶1-HSL,处于QS网络上游,正调控tra和raiQS系统,参与生长抑制。而tra和rhl2个QS系统则位于质粒pRL1JI上。其中traQS系统负责产生3-O-C8-HSL,控制质粒的结合转移;而rhlQS系统则产生几个短链AHLs(C6/C7/C8-HSL),影响结瘤效率。raiRIQS系统则位于另一个质粒上pIJ9001,也产生几个短链的AHLs,但目前功能未知[14]。
1.3 植物生防菌普城沙雷氏菌Serratia plymuthica的QS系统
最近已报道S.plymuthica中存在3个LuxI/LuxR型QS系统,可产生10 余种AHL信号分子,代表性AHLs有3-oxo-C6-HSL 、C4-HSL、C6-HSL和3-OH-C6-HSL[8-9],参与调控胞外酶和抗生素产生,运动性和生物膜形成,以及生防活性和诱导系统抗性等多种生防相关表型[10-11],尽管对几个QS系统间如何相互作用还有待进一步研究。
1.4 QS信号网络调控的功能
以P.aeruginosa为例,QS可直接或间接调控基因组中高达10%的编码基因[15]。全局鉴定QS调控的靶基因和蛋白表明,除了控制细菌毒力(分泌因子如毒素和胞外酶),QS还调节参与中心代谢、脂肪酸代谢和辅因子合成等相关基因的表达,可引起细菌生理的重要改变,对细菌在高密度种群环境下的适应性有所贡献[16]。细菌中QS网络组成及其调控的表型详见表1。
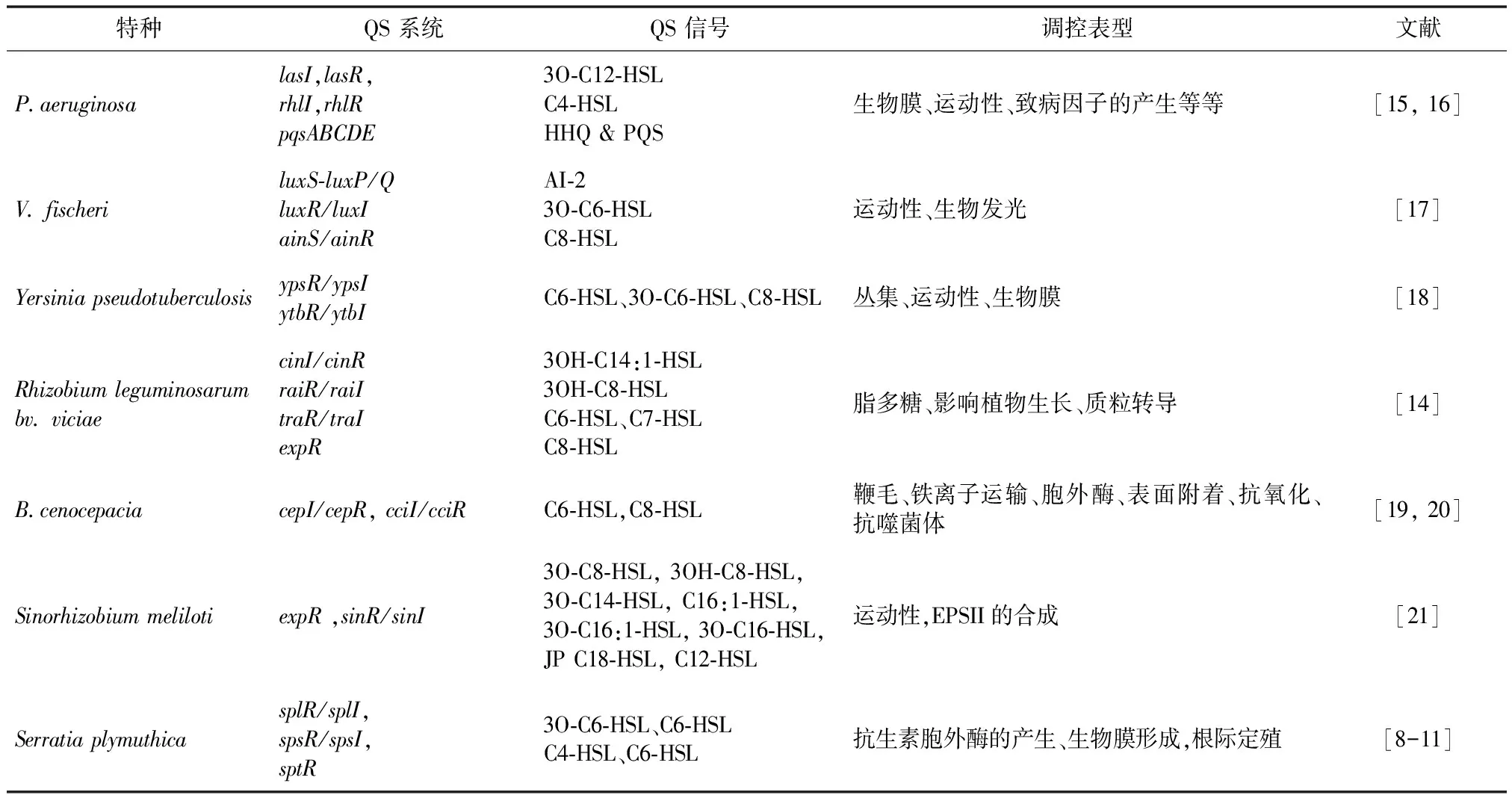
表1 细菌QS信号网络及其功能
1.5 QS与其它调控系统之间的互作
QS除了直接调控细菌多种基因表达而改变细菌的生理和行为,还可以通过与其它全局调控因子的整合互作进入细菌复杂的信号转导网络发挥更强大的功能。首先QS可与双因子系统(Two-component system,TCS)互作。霍乱弧菌V.cholerae是人类致病菌,其 VarS/VarA通过几个小RNA Qrr 调控LuxR同源物HapR[22]。另外,QS调控细菌胞内第二信使c-di-GMP。研究发现V.cholerae中低细胞浓度时,QS信号分子AI-2及CAI-1浓度较低,使膜上受体LuxP/Q及CpqS处于高度磷酸化水平,从而激活LuxO,处于激活状态的LuxO激活下游基因qrr sRNA的表达,而qrr sRNA一方面通过促进VCA0939(GGDEF结合蛋白)提高c-di-GMP表达,一方面通过降解mRNA抑制hapR(高细胞浓度时的QS主要调控因子)表达;c-di-GMP激活VpsT及VpsR,其中VpsT正调控生物膜,VpsR激活低细胞浓度主控因子AphA,从而调控低细胞浓度时各种基因的表达,如毒力因子等。反之,细菌浓度和AHL信号水平相对较高时,c-di-GMP表达量低, HapR反而被激活,从而抑制了vpsT基因转录,并调控高细胞浓度时的相关基因表达[23]。c-di-GMP可调控多种表型,QS通过调控代谢酶,从而间接调控c-di-GMP,这种双重调控避免了细胞因浓度低时,QS信号分子无法启动相关基因,赋予了细菌更好适应环境的能力。
QS与其他全局调控子互作研究已较广泛,以P.aeruginosa为例,与其QS系统紧密联系的全局调控子很多,比如Vfr-一种与cAMP作用,调控该菌致病性的全局调控子;RpoS-稳定期调控因子,影响QS所调控基因的40%,与lasRI起相互激活作用;QscR-P.aeruginosa中第3个不产生AHL的luxR型调控子,其延迟QS调控基因的表达;其他的与QS有调控作用的还有RelA、ANR、RsaL、VqsR、MvfR、βRsmA等等[12]。
2 群体感应系统的应用
2.1 群体感应信号调节与寄主植物的有益互作
QS信号不仅作为细菌细胞间通讯的语言,协同调节细菌基因表达和社会行为,研究发现它还作为跨界信号调节细菌与真核寄主的互作。如前所述,AHL信号控制共生根瘤细菌的结瘤固氮能力和生防菌S.plymuthica的生防活性和诱导系统抗病性。另外,根瘤菌Sinorhizobiummeliloti分泌的3O-C14-HSL已报道可以提高拟南芥的防病能力[24];而Stenotrophomonasmaltophilia产生的QS因子rpf/DSF可促进细菌在根际定植及植物生长[15]。
植物转基因技术也证明操纵细菌AHL信号可以降低病害严重度,改善植物防御能力,表明以QS信号作为分子靶标对于改善植物防病、促生和抗逆性方面有广阔的应用前景。例如通过QS信号淬灭的策略,表达AHL信号降解酶AiiA (AHL-lactonase)的烟草和马铃薯植物株系均表现出明显增强了对软腐细菌的抗病性[25]。Barriuso等通过西红柿LasI转基因株系表明QS参与Burkholderiagraminis诱导的植物生长促进和对盐胁迫的耐力[26]。
植物可以感知和应答细菌产生的QS信号影响其生长发育和防御能力。反之,细菌也可以通过感应和结合寄主植物分泌的信号,激活生防相关基因的表达,有效抑制植物病害。根际假单胞菌中的PsoR属于LuxR家族蛋白的一种特例。PsoR不响应细菌自身分泌的AHL信号,只能与寄主植物分泌的少量化学物质互作,从而激活生防相关基因表达,有效防治小麦幼苗根际腐烂等,进化树分析还显示,在黄单胞菌Pseudomonas、农杆菌Agrobaterium和根瘤菌等多种植物相关细菌中均存在PsoR同源蛋白[27]。尽管是否具有相似的功能还有待验证。
2.2 细菌群体感应与环境
许多细菌还可以通过自身的QS调控系统影响周围环境。枯草芽孢杆菌QS信号参与净化水体中多余的有机物质,降低氨和氮的浓度,从而净化水质[28]。绿藻广泛分布于海水、淡水等各种水环境中,参与形成海洋生物污垢,可造成重大经济损失。绿藻以孢子形式繁殖,研究发现细菌QS信号分子可促进Ca2+产生从而调控绿藻鞭毛的运动性以及孢子在细菌表面的附着能力,调节孢子定殖[29]。另外,V.Anguillarum产生的3O-C10-HSL可抑制孢子附着,而Sulfitobacterspp. 和Shewanellaspp.分泌的AHL也抑制绿藻孢子的萌发[30]。以上数据表明多种海洋细菌产生的QS信号具有清洁海洋生物污垢的潜能。
同时环境因子也会干扰细菌QS调控。 环境中NO可以通过QS调控Vibrioharveyi鞭毛产生和生物膜形成[31];温度、pH值和营养条件等对AHL信号分子的产生也有动态的影响。例如,假单胞菌在25℃条件下产生2种AHL信号3O-C12-HSL 和C4-HSL;而在4℃ 时所产生的短链C4-HSL消失。另外,pH大于7.5时导致AHLs的稳定性下降;含不同碳源(葡萄糖,果糖,木糖,麦芽糖等)的培养基对AHL信号分子的产生水平和种类也有影响[32]。植物根际细菌Ralstoniasolanacearum产生AHL 需要胁迫和稳定期的σs因子,而该因子在细菌饥饿条件下和进入稳定期生长阶段时活性最高[33]。
2.3 群体感应在医学领域的应用
临床广泛使用抗生素治疗细菌感染不但对人体有一定副作用,还促使细菌产生耐药性。QS参与调控致病细菌毒力因子产生和生物膜形成,研究QS信号分子抑制剂或降解酶,干扰QS信号交流已成为防治细菌新策略之一[34];同时因其干扰生物膜形成从而增强了对抗生素治疗的敏感性。更重要的是,因为QS不影响细菌生长,没有选择压力可以避免或延缓细菌抗药性产生。因此QS作为潜在的防治细菌新靶标备受关注。研究发现P.aeruginosaAHL受体RhlR和LasR的新型抑制剂—mBTL(meta-bromo-thiolactone),可阻止细菌对人体肺上皮细胞的侵染,抑制绿脓菌素及生物膜形成;mBTL还能预防P.aeruginosa对秀丽隐杆线虫的侵染[35]。另外QS信号分子本身也可作为潜在药物化学先导物有待进一步研发。以P.aeruginosa为例,HHQ、PQS和 3O-C12-HSL在人体免疫系统和心血管功能调节、细胞凋亡、细胞色素抑制和突破表皮细胞障碍等方面都发挥积极作用[36]。
3 展望
群体感应现象的发现被视为近20年来微生物研究领域中最重大的进展之一。细菌利用QS调控系统以群体协作的方式对种群的社会行为产生影响,赋予细菌类似多细胞群体行为的能力,使之更好地适应不断变化的环境。QS在农业、生物技术和医学等诸多领域展示了广阔的应用前景。未来的挑战包括解析QS信号级联反应及其与细菌复杂调控网络的整合;揭示细菌与真核生物之间的跨界信号转导以及调控其分子互作的机制等。进一步通过整合系统生物学和合成生物学的方法建立复杂细菌信号调控网络的模型,以鉴定新的抗细菌靶标,用于诊断与防治传染病;同时应用于植病生防和预防海洋生物污垢等。
参考文献:
[1]Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bactrriol, 1994, 176:269-275.
[2]Case R J, Labbate M, Kjelleberg S. AHL-driven quorum-sensing circuits: their frequency and function among the proteobacteria [J]. ISME J, 2008, 2: 345-349.
[3]Srivastava D, Waters C M. A tangled web: regulatory connections between quorum sensing and cyclic Di-GMP [J]. J Bacteriol, 2012,194: 4485-4493.
[4]Schuster M, Greenberg E P. A network of networks: Quorum-sensing gene regulation inPseudomonasaeruginosa[J]. Int J Med Microbiol, 2006, 296: 73-81.
[5]Peyman A, Henry M, Massimiliano C, et al. The DSF quorum sensing system controls the positive influence ofStenotrophomonasmaltophiliaon plants[J]. PLoS One, 2013,8: e67103.
[6]Lupp C, Ruby E G.Vibriofischeriuses two quorum-sensing systems for the regulation of early and late colonization factors [J]. J Bacteriol, 2005, 187:3620-3629.
[7]Rutherford S T, Bassler B L. Bacterial quorum sensing: its role in virulence and possibilities for its control[J].Cold Spring Harb Perspect Med, 2012, 2(11): a012427.
[8]Liu X, Jia J, Popat R, et al. Characterisation of two quorum sensing systems in the endophyticSerratiaplymuthicastrain G3: differential control of motility and biofilm formation according to life-style [J]. BMC Microbiol, 2011, 11:26.
[9]Duan Y F, Zhou M, Guo S, et al. Cloning and preliminary identification of SptR, a LuxR-like regulator fromSerratiaplymuthica[J]. Afr J Microbiol Res, 2012, 6:6333-6339.
[10]Liu X, Bimerew M, Ma Y, et al. Quorum-sensing signaling is required for production of the antibiotic pyrrolnitrin in a rhizospheric biocontrol strain ofSerratiaplymuthica[J]. FEMS Microbiol Lett, 2007, 270: 299-305.
[11]Pang Y, Liu X, Ma Y, et al. Induction of systemic resistance, root colonisation and biocontrol activities of the rhizospheric strain ofSerratiaplymuthicaare dependent on N-acyl homoserine lactones [J]. Eur J Plant Pathol, 2009, 124(2): 261-268.
[12]Ng W L, Bassler B L. Bacterial quorum-sensing network architectures [J]. Annu Rev Genet, 2009, 43:197-222.
[13]Schuster M, Greenberg E P. A network of networks: Quorum-sensing gene regulation inPseudomonasaeruginosa[J]. Int J Med Microbiol, 2006, 296(2/3):73-81.
[14]Sanchez C M, Bauer W D, Gao M, et al. Quorum-sensing regulation inrhizobiaand its role in symbiotic interactions with legumes [J]. Philos Trans R Soc Lond B Biol Sci, 2007, 362:1149-1163.
[15]Williams P, Cámara M. Quorum sensing and environmental adaptation inPseudomonasaeruginosa: a tale of regulatory networks and multifunctional signal molecules [J]. Curr Opin Microbiol, 2009,12:182-191.
[16]Wagner V E, Bushnell D, Passador L, et al. Microarray analysis ofPseudomonasaeruginosaquorum-sensing regulons: effects of growth phase and environment[J]. J Bacteriol, 2003,185: 2080-2095.
[17]Lupp C, Urbanowski M, Greenberg E P, et al. TheVibriofischeriquorum-sensing systemsainandluxsequentially induce luminescence gene expression and are important for persistence in the squid host [J]. Mol Microbiol, 2003, 50:319-331.
[18]Atkinson S, Chang C, Patrick H L, et al. Functional interplay between the Yersinia pseudotuberculosis YpsRI and YtbRI quorum sensing systems modulates swimming motility by controlling expression of flhDC and fliA [J]. Mol Microbiol, 2008, 69: 137-151.
[19]O′Grady E P, Viteri D F, Malott R J, et al. Reciprocal regulation by the CepIR and CciIR quorum sensing systems inBurkholderiacenocepacia[J]. BMC Genomics, 2009, 10:441.
[20]Suppiger A, Schmid N, Aguilar C, et al. Two quorum sensing systems control biofilm formation and virulence in members of theBurkholderiacepaciacomplex [J].Virulence, 2013, 4: 400-409.
[21]Gao M, Chen H, Eberhard A, et al. SinI-and expR-dependent quorum sensing inSinorhizobiummeliloti[J]. J Bacteriol, 2005, 187 :7931-7944.
[22]Tsou A M, Liu Z, Cai T, et al. The VarS/VarA two-component system modulates the activity of theVibriocholeraequorum-sensing transcriptional regulator HapR [J]. Microbiol, 2011, 157:1620-1628.
[23]Srivastava D, Waters C M. Regulatory connections between Quorum sensing and cyclic Di-GMP [J]. J Bacteriol, 2012, 194:4485-4493.
[24]Zarkani A A, Stein E, Röhrich C R,et al. Homoserine lactones influence the reaction of plants toRhizobia[J]. Int J Mol Sci, 2013, 14: 1722-1746.
[25]Dong Y H, Wang L H, Xu J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase [J].Nature, 2001, 411:813-817.
[26]Barriuso J, Ramos S B, Fray R G, et al. Transgenic tomato plants alter quorum sensing in plant growth-promotingrhizobacteria[J].Plant Biotechnol J, 2008, 6:442-452.
[27]Subramoni S, Gonzalez J F, Johnson A, et al. Bacterial subfamily of LuxR regulators that respond to plant compounds [J]. Appl Environ Microbiol, 2011, 77:4579-4588.
[28]陈 瑞,王大力.枯草芽孢杆菌的群体感应信号系统及其在环境领域的应用前景[J].安全与环境学报,2012,12:5-8.
[29]Joint I, Tait K, Callow M E, et al. Cell-to-cell communication across the prokaryote-eukaryote boundary [J]. Science, 2002, 298:1207.
[30]Twigg M S, Tait K, Williams P, et al. Interference with the germination and growth of Ulva zoospores by quorum-sensing molecules from Ulva-associated epiphytic bacteria [J]. Environ Microbiol, 2013, doi: 10.1111/1462-2920.12203.
[31]Henares B M, Xu Y, Boon E M. A nitric oxide-responsive quorum sensing circuit inVibrioharveyiregulates flagella production and biofilm formation [J]. Int J Mol Sci, 2013, 14:16473-16484.
[32]綦国红.碳源及温度对食源假单胞菌群体感应信号分子产生的影响[J]. 中国生物工程杂志, 2006, 26: 72-76.
[33]Flavier A B, Schell M A, Denny T P. An RpoS (sigmaS) homologue regulates acylhomoserine lactone-dependent autoinduction inRalstoniasolanacearum[J]. Mol Microbiol, 1998, 28:475-486.
[34]Middleton B, Rodgers H C, Cámara M, et al. Direct detection of N-acylhomoserine lactones in cystic fibrosis sputum[J]. FEMS Microbiol Letters, 2002, 207:1-7.
[35]O′Loughlin C T, Miller L C, Siryaporn A et al. A quorum-sensing inhibitor blocksPseudomonasaeruginosavirulence and biofilm formation [J]. Proc Natl Acad Sci USA, 2013, 9:17981-17986.
[36]Kim K, Kim Y U, Koh B H, et al. HHQ and PQS, twoPseudomonasaeruginosaquorum-sensing molecules, down-regulate the innate immune responses through the nuclear factor-kappaB pathway [J]. Immunology, 2010, 129:578-588.

