RhoA基因在胰腺癌组织中的表达及其与肿瘤临床病理特征的关系
李金海,戴华卫,张海峰
(温州医科大学附属第三医院 普通外科,浙江 温州 325200)
·论 著·
RhoA基因在胰腺癌组织中的表达及其与肿瘤临床病理特征的关系
李金海,戴华卫,张海峰
(温州医科大学附属第三医院 普通外科,浙江 温州 325200)
目的:探讨RhoA基因在胰腺癌组织中的表达情况及其与胰腺癌临床病理特征的关系。方法:应用实时荧光定量PCR与Western blot同步检测48例胰腺癌患者癌组织及对应癌旁组织中RhoA mRNA及蛋白的表达情况,分析RhoA基因的表达与胰腺癌组织临床病理参数的关系。结果:肿瘤组织中RhoA mRNA的表达量明显高于癌旁组织(t=3.669,P=0.0007),RhoA mRNA在胰腺癌中的表达水平与肿瘤分化程度、有无门脉及淋巴结转移、pTNM病理分期密切相关,在中、低分化肿瘤(t=2.447,P=0.006)、门静脉受侵犯(t=2.544,P=0.008)、淋巴结转移(t=2.351,P=0.041)和pTNM分期较晚(Ⅲ和Ⅳ期,t=2.667,P=0.025)的患者中明显升高。Western blot结果显示肿瘤组织中RhoA蛋白的表达水平明显高于癌旁组织(t=3.461,P=0.0003);RhoA蛋白表达量与肿瘤侵袭能力以及肿瘤分期相关,RhoA蛋白的含量在中、低分化肿瘤(t=2.323,P=0.016)、门静脉受侵犯(t=2.119,P=0.036)、淋巴结转移(t=2.117,P=0.029)和pTNM分期较晚(Ⅲ和Ⅳ期,t=2.776,P=0.004)的患者中明显升高。结论:RhoA基因可能成为一种新的肿瘤标志物,用于判断肿瘤分化程度、转移能力和预后评估。
胰腺肿瘤;病理学,临床;基因表达;RhoA
胰腺癌是恶性程度高、病死率高的消化道恶性肿瘤,早期诊断和治疗一直是本专业领域的难题。随着分子诊断水平的提高,开发早期分子标志物以加强对胰腺癌的早期诊断、治疗及预后判断是目前研究的重点[1-2]。Rho蛋白属于小G蛋白超家族的亚家族成员,不仅参与细胞凋亡过程,而且决定细胞凋亡的开始[3-4]。RhoA基因与肿瘤浸润转移关系密切,但其在胰腺癌组织中的研究甚少。本研究目的在于探讨RhoA基因在胰腺癌组织中的表达情况并分析其与胰腺癌临床病理特征的关系。
1 材料和方法
1.1 材料选取我院2009-2012年行手术切除后经病理诊断为胰腺癌的标本48例,并以癌旁胰腺组织作为对照。组织学分级依据国际肿瘤组织学胰腺癌肿瘤分级标准。肿瘤的临床分期按照国际抗癌协会pTNM分期。
1.2 实时荧光定量PCR检测取所有标本的癌组织和癌旁胰腺组织各约40 mg,对每例标本的总RNA进行提取。样品进行目的基因的PCR扩增,产物做梯度稀释,用于做标准曲线样品。在同一块96孔板中加入制备好的样品及标准曲线样品。RhoA上游引物序列为5’-GAGCACACAAGGCGGGAG-3’,下游引物序列为5’-TGCCATATCTCTGCCTTCTTCA-3’;探针序列为5’-CCAAGATGAAGCAGGA-GCCGGTGA-3’。PCR循环条件:50个循环内50 ℃变性2 min,95 ℃退火10 min,95 ℃延伸30s,60 ℃再延伸30 s。重复3次。然后把加好样品的96孔板放在ABI 7700 Sequence Detector(购于上海康基生物有限公司)上进行反应,对标准曲线和样品的质量及浓度范围进行检测,标准曲线的相关系数应接近1。样品定量结果与βactin(购自美国eBioscience公司)相比为标本所测mRNA浓度。
1.3 Western blot测定三去污裂解液(购自美国eBioscience公司)提取细胞总蛋白,所得总蛋白经15%聚丙烯酰胺凝胶电泳转移至硝酸纤维素膜上,NBT/BCIP显色,计算机扫描蛋白质条带做灰度分析。以β-actin作内参照,RhoA/β-actin(灰度值的比值)代表RhoA的相对表达量,每个样本重复3次。
1.4 免疫组织化学染色按常规方法操作,ABC法染色。RhoA抗体(购自美国Bioworld生物科技有限公司)1:50稀释。
1.5 统计学处理方法应用SPSS 16.0统计软件。数据以±s表示,组间比较用Student’s t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 RhoA mRNA的表达通过实时荧光定量PCR方法对胰腺癌组织和癌旁胰腺组织中RhoA mRNA的表达水平进行检测。图1显示胰腺癌组织中RhoA mRNA的表达量明显高于癌旁胰腺组织(t=3.669,P=0.0007)。由表1可见RhoA mRNA胰腺癌组织中的表达水平与肿瘤分化程度、门脉转移、淋巴结转移及pTNM分期相关,在中、低分化肿瘤、门静脉受侵犯、有淋巴结转移和pTNM分期较晚(I I I和I V期)的患者中明显升高(P<0.05或P<0.01)。见表1。
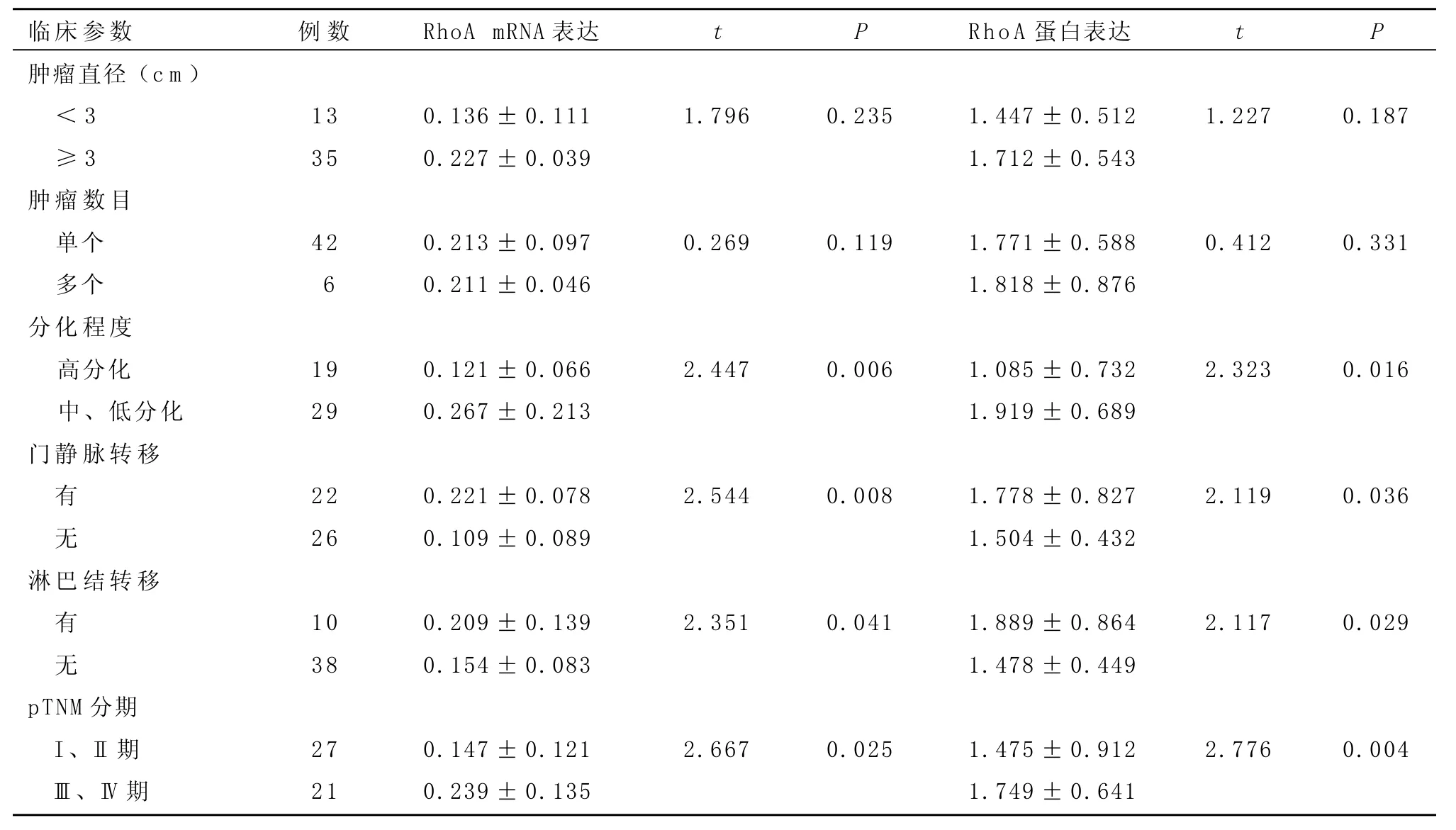
表1 胰腺癌的临床特征与RhoA mRNA和蛋白表达的关系
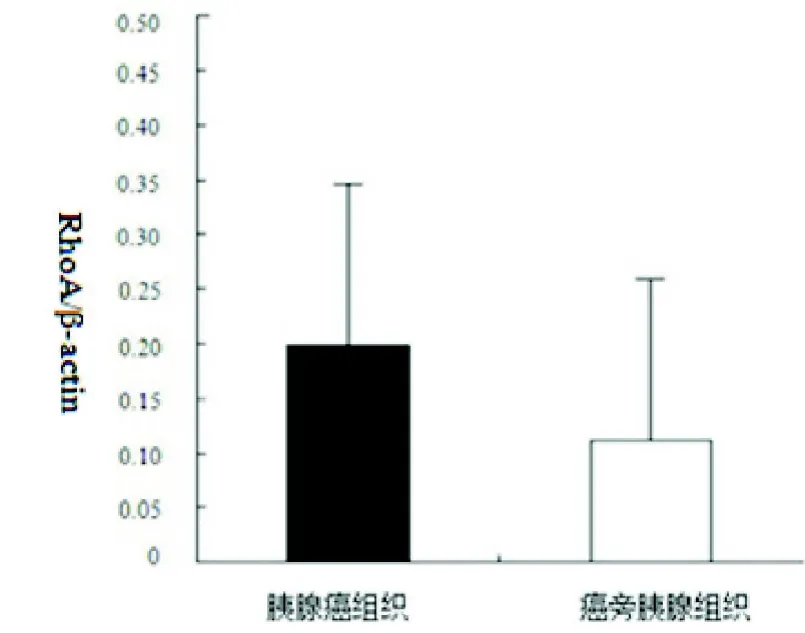
图1 实时荧光定量PCR方法检测胰腺癌和癌旁胰腺组织中RhoA mRNA的表达
2.2 RhoA蛋白的表达通过Western blot对胰腺癌组织和癌旁胰腺组织中RhoA蛋白的表达情况进行检测,结果显示胰腺癌组织中RhoA蛋白的表达水平明显高于癌旁胰腺组织(t=3.461,P=0.0003)。表1显示RhoA蛋白的含量在不同肿瘤大小、不同肿瘤灶数量间差异无统计学意义(P>0.05),但在中、低分化肿瘤、门静脉受侵犯、有淋巴结转移和pTNM分期较晚(I I I和I V期)的患者中明显升高(P<0.05或P<0.01),表明RhoA蛋白的表达与胰腺癌的分化程度、有无门静脉侵犯、有无淋巴结转移及pTNM分期相关。见表1、图2。
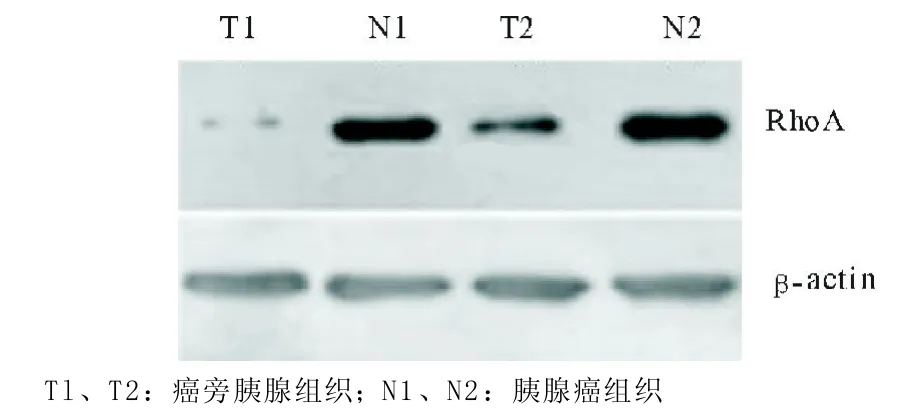
图2 Western blot检测RhoA蛋白的表达
2.3 免疫组织化学染色结果48例胰腺癌组织中RhoA表达阳性者有35例(占72.9%),癌旁胰腺组织中表达阳性者有21例(占43.8%),胰腺癌组织RhoA蛋白阳性率高于癌旁胰腺组织。RhoA蛋白主要沿细胞膜内侧呈线性分布,并在胞浆内呈散在棕色颗粒分布,胰腺癌组织表达主要为弥漫性分布,亦有较多局部或灶性分布,癌旁胰腺组织阳性表达以弥漫性分布为主,局部或灶性分布偏少(见图3)。
3 讨论

图3 胰腺癌和癌旁胰腺组织中RhoA蛋白的表达(ABC,×100)
Rho家族蛋白作为一种具有GTP酶活性的小分子G蛋白,含有Rho、Rac、Cdc42三个亚家族,23个成员,主要通过参与调节肌动蛋白(细胞骨架)的活动、细胞分裂增殖、细胞变形的过程,继而达到发挥调控肿瘤生长转移的作用。Rho家族蛋白几乎参与了肿瘤发生发展的每个环节,其中包括调节细胞骨架和细胞周期,改变细胞黏附和运动,改变细胞转化,参与肿瘤细胞侵袭转移,肿瘤细胞传代等。体外实验表明,Rho家族蛋白可以决定乳腺癌、前列腺癌及宫颈癌等多种肿瘤细胞的浸润、转移能力[5]。Ariake等[6]实验证实GCF2/LRRFIP1通过整合依赖RhoA蛋白活性来提高结肠癌的转移及肝脏浸润能力。此外,在肝癌、头颈部恶性肿瘤及膀胱癌等多种肿瘤的癌细胞和细胞外基质中均有RhoA蛋白的高表达,其高度表达与肿瘤的远处转移、侵袭关系密切[7-9]。陈碧君等[10]研究发现,Rho-ROCK细胞信号内途径参与胰腺纤维化,并对慢性胰腺炎、胰腺癌及糖尿病的治疗有重要意义。Paul等[11]通过荧光实时影像系统技术(fluorescence lifetime imaging microscopy-fluorescence resonance energy transfer,FLIM-FRET)检测RhoA蛋白活性的研究证实,突变型P53基因通过抑制RhoA蛋白活性来抑制胰腺癌细胞侵袭及转移。
由于受到病程、个体情况、治疗干预等因素的影响,要准确判断肿瘤组织的侵袭性存在困难,目前也没有公认的标准。根据肿瘤的临床病理特点进行分类简单易行,而且具有较高的准确性[12]。因此,本研究中我们按照肿瘤大小、数目、肿瘤分化程度、有无门静脉侵犯、有无淋巴结转移和肿瘤的pTNM分期等条件将所有胰腺癌分为两组,并应用实时荧光定量PCR、Western blot技术检测胰腺癌组织和癌旁胰腺组织中RhoA mRNA和蛋白的相对表达水平,结果提示,RhoA在胰腺癌组织中高表达,其表达量与胰腺癌的分化程度、门静脉转移、淋巴结转移以及pTNM分期相关。随着胰腺癌恶性程度及pTNM分期的增高,RhoA蛋白表达也增加,由此结果推测,RhoA蛋白可能参与了胰腺癌的发生、发展过程。Brad等[13]认为RhoA蛋白可以通过血管内皮生长因子诱导血管生成,从而促使肿瘤细胞向周围血管侵袭。本研究结果显示有门静脉侵犯或淋巴结转移的胰腺癌组织中RhoA mRNA和蛋白的表达量明显高于无门静脉侵犯及无淋巴结转移的胰腺癌组织,提示RhoA基因表达与胰腺癌的转移能力密切相关。
综上所述,RhoA蛋白不但在胰腺癌组织中表达增高,而且与胰腺癌的分化程度、门静脉侵犯及淋巴结转移与否及恶性程度密切相关。RhoA蛋白及其表达水平有望作为诊断及评判胰腺癌恶性程度的肿瘤标志物之一。
[1]Yoshimura H, Matsuda Y, Naito Z, et al. Ultra-high-resolution images of nestin and vimentin in pancreatic carcinoma cells using 2 novel microscopy systems[J]. J Nippon Med Sch, 2012, 79(6): 392-393.
[2]Zhang SN, Huang FT, Huang YJ, et al. Characterization of a cancer stem cell-like side population derived from human pancreatic adenocarcinoma cells[J]. Tumori, 2010, 96(6): 985-992.
[3]Park GB, Kim YS, Song H, et al. Cross-linking of CD80 and CD86 diminishes expression of CD54 on EBV-transformed B cells through inactivation of RhoA and Ras[J]. Immune Netw, 2011, 11(6): 390-398.
[4]David M, Petit D, Bertoglio J. Cell cycle regulation of Rho signaling pathways[J]. Cell Cycle, 2012, 11(16): 3003-3010.
[5]Chang YW, Bean RR, Jakobi R. Targeting RhoA/Rho kinase and p21-activated kinase signaling to prevent cancer development and progress[J]. Recent Pat Anticancer Drug Discov, 2009, 4(2): 110-124
[6]Ariake K, Ohtsuka H, Motoi F, et al. GCF2/LRRFIP1 promotes colorectal cancer metastasis and liver invasion through integrin-dependent RhoA activation[J]. Cancer Lett, 2012, 325(1): 99-107.
[7]Gen Y, Yasui K, Zen K, et al. A novel amplification target, ARHGAP5, promotes cell spreading and migration by negatively regulating RhoA in Huh-7 hepatocellular carcinoma cells[J]. Cancer Lett, 2009, 275(1): 27-34.
[8]Croucher DR, Rickwood D, Tactacan CM, et al. Cortactin modulates RhoA activation and expression of Cip/Kip cyclin-dependent kinase inhibitors to promote cell cycle progression in 11q13-amplified head and neck squamous cell carcinoma cells[J]. Mol Cell Biol, 2010, 30(21): 5057-5070.
[9]蒋磊, 赵宏俊, 王思齐, 等. Rho激酶抑制剂对膀胱癌细胞侵袭能力的影响[J]. 温州医学院学报, 2011, 41(5): 459-461.
[10]陈碧君, 孙子林, 李凤飞, 等. 胰腺星状细胞活化相关的信号转导通路[J]. 生命科学, 2010, 24(6): 583-587.
[11]Paul T, Ewan J, Jennifer P. Spatial regulation of RhoA activity during pancreatic cancer cell invasion driven by mutant p53[J]. Cancer Res, 2011, 71(3): 747-757.
[12]王德盛, 李郁, 刘正才, 等. 肝细胞肝癌中RhoA基因表达及其与肿瘤临床病理特征的关系[J]. 中华普通外科杂志, 2008, 23(12): 918-920.
[13]Brad A, Emily D, Dianne C, et al. RhoA/ROCK signaling is essential for multiple aspects of VEGF-mediated angiogenesis[J]. FASEB J, 2010, 24(9): 3186-3195.
(本文编辑:丁敏娇)
RhoA gene expression and clinicopathology parameters in pancreatic carcinoma
LI Jinhai, DAI Huawei,
ZHANG Haifeng.Department of General Surgery, the Third Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325200
Objective: To investigate the expression of RhoA gene in tissues of pancreatic cancer and to discuss its significance during carcinogenesis and progression of tumor.Methods:Intratumor RhoA expression level was determined and compared with that in adjacent nontumorous pancreatic tissues using quantitative real time polymerase chain reaction and Western blot in 48 samples of pancreatic carcinoma.Results:The mRNA levels of RhoA were significantly higher in tumor tissues than that in the unaffected portions (t=3.669, P=0.0007). The expression of RhoA mRNA in the primary lesion was higher in patients with low and middle differentiation cancer (t=2.447, P=0.006), protal vein invasion (t=2.544, P=0.008), lymph node metastasis (t=2.351, P=0.041), and advanced pTNM stage (stage III/IV, t=2.667, P=0.025) than in those without. There was a significant difference between high RhoA protein levels in the tumor tissues and noncancerous tissues in pancreatic carcinoma patients(t=3.461, P=0.0003), the quantity of RhoA expression associated with tumor invasion and metastasis. There was a significant association between high tumor RhoA protein levels and low and middle differentiation cancer (t=2.323, P=0.016), and the presence of protal vein invasion (t=2.119, P=0.036), lymph node metastasis (t=2.117, P=0.029), and advanced pTNM stage (t=2.776, P=0.004).Conclusion:There is a significant correlation among RhoA expression, tumor stage, and metastasis. The expression of RhoA can be used as a good tumor marker for invasive and advanced pancreatic carcinoma as well as a prognosis predictor.
pancreatic neoplasms; pathology, clinical; gene expression; RhoA
R735.2
A
1000-2138(2014)02-0130-04
2013-04-27
李金海(1983-),男,山东枣庄人,住院医师,硕士。

