卵巢恶性甲状腺肿临床病理分析
温莉虹,张虎祥,郑向阳,林克荣,张仕锵,张雷
(1.苍南县人民医院 病理科,浙江 温州 325800;2.温州医科大学附属第一医院 病理科,浙江 温州 325015;3.苍南县人民医院 妇科,浙江 温州 325800)
·临床经验·
卵巢恶性甲状腺肿临床病理分析
温莉虹1,张虎祥2,郑向阳1,林克荣1,张仕锵1,张雷3
(1.苍南县人民医院 病理科,浙江 温州 325800;2.温州医科大学附属第一医院 病理科,浙江 温州 325015;3.苍南县人民医院 妇科,浙江 温州 325800)
目的:分析卵巢恶性甲状腺肿(MSO)的临床病理特点。方法:收集5例MSO的临床资料对其进行病理组织学观察和免疫组织化学标记并复习相关文献。结果:5例MSO均表现为盆腔包块,无临床恶性及转移证据,形态学上常伴有畸胎瘤成分或可见甲状腺病变良性到恶性的移行过程,免疫组化TTF-1、TG阳性。结论:MSO是少见肿瘤,缺少特异临床症状,病理组织学诊断标准同甲状腺原发恶性病变,可为畸胎瘤的一部分。组织学可分为乳头型和滤泡型,总体预后好。
卵巢畸胎瘤;恶性甲状腺肿;癌,乳头状
1 资料和方法
1.1 一般资料收集苍南县人民医院和温州医科大学附属第一医院2007到2012年经病理诊断为MSO的病例5例,其中左侧2例,右侧3例,年龄39~67岁,平均58.1岁,均因B超发现盆腔包块入院。临床表现2例伴有反复腰痛,1例伴有阴道不规则出血,1例于3年前行对侧卵巢切除术,术后病理诊断为宫内膜样囊肿,此次伴腹胀不适,1例无明显不适,常规体检时意外发现;查体腹部稍膨隆,子宫后方触及包块,表面不规则,边界清,活动度可,无压痛。术中见肿物最大径5~12 cm,表面均光滑,与周围组织无粘连,邻近组织均未见异常结节,其中3例行双侧附件切除术,1例行全子宫加双附件切除术,1例行单侧附件切除术。术后随访10~36个月,患者均健在,无复发转移征象。甲状腺功能检查无异常,无甲亢、甲低病史。血清学检查CA125、AFP、CEA、TG均无异常。
1.2 方法手术切除标本送冷冻切片室做快速诊断,术后标本用4%中性甲醛溶液固定,石蜡包埋,常规制片,HE染色,显微镜下观察。免疫组织化学采用S-P法,一抗为CK7、CK19、CK20、TTF-1、TG、CgA、syn、Ki-67,所有抗体及试剂盒均购自北京中杉金桥生物技术有限公司。
2 结果
2.1 巨检卵巢肿物(见图1)大小分别为12 cm ×10 cm×6 cm,10 cm×10 cm×6 cm,10 cm× 9 cm×6 cm,8 cm×7 cm×4 cm,5 cm×2.5 cm ×2 cm,表面光滑。4例切面呈多房囊状,囊内见皮脂、毛发,在瘤体囊壁内侧见灰白结节或实性区,与周边界限尚清,面积约5.5 cm×5.5 cm,5.5 cm ×5 cm,3.2 cm×1.8 cm,2.5 cm×2 cm,切面灰红暗红,质地偏脆,未见明显出血坏死改变。1例表面光滑,切面呈囊性,囊内充满暗红色胶冻样物,局部切开时质地稍偏实,但未见明显肿物。
2.2 镜检卵巢组织切片中4例见到成熟性畸胎瘤的三胚层成分,包括成熟的鳞状上皮(见图2),皮肤附属器,纤维血管脂肪组织,成熟的神经胶质成分,部分成熟的甲状腺滤泡,滤泡扩张,充满类胶质,滤泡边缘见到吸收空泡,在正常的甲状腺滤泡中见多少不一的穿插于其中的分支乳头状结构,乳头由上皮衬复,上皮细胞极向紊乱,胞浆淡嗜酸性,含有纤维血管轴心(见图3),半数以上的乳头上皮可见乳头状癌特征性的核,包括增大的,卵圆形、长的和重叠核。典型的核为清澈的或呈毛玻璃样,出现核沟,核内假包涵体,核内小核仁(见图4)。一些区域的乳头形成迷宫样或梁状结构,乳头间质中见少量砂砾体,肿瘤实质内硬化并见多处钙化区,部分区域完全由乳头状结构组成。1例组织切片见大小不等的甲状腺滤泡,滤泡内充满类胶质,呈结节性甲状腺肿结构,但在滤泡中散在分布少量分支乳头状结构,细胞核呈毛玻璃样,并见核沟,少数乳头状结构中可见到纤维血管轴心,该例部分区域可见到甲状腺病变良性到恶性的移行过程,该例切片未见到其他的畸胎瘤成分。
2.3 免疫组化结果CK7胞质+、CK19胞质胞膜+(见图5)、CK20-、 TG胞质胞膜+(见图6)、TTF-1胞核+(见图7)、CgA-、syn-、Ki-67胞核<1%+。
2.4 病理诊断4例诊断为卵巢成熟性畸胎瘤伴甲状腺肿恶变(甲状腺乳头状癌),1例诊断为卵巢甲状腺肿伴甲状腺乳头状癌。

图1 大体形态示囊实性肿瘤,图左侧为囊性畸胎瘤区域,右侧为甲状腺乳头状癌区域
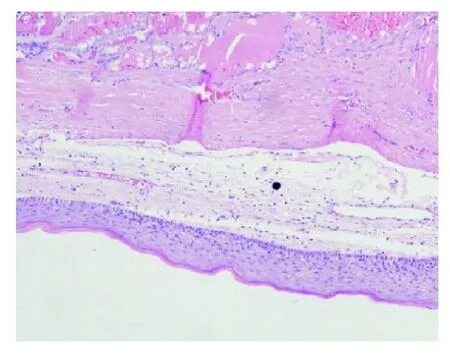
图2 成熟性畸胎瘤区,示分化好的鳞状上皮(HE,×100)

图3 甲状腺乳头状癌区,示复杂的分支状乳头,含纤维血管轴心(HE,×100)
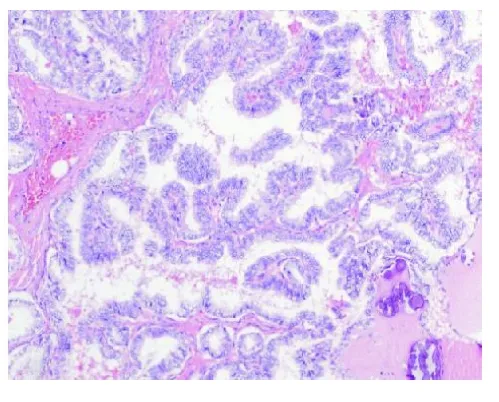
图4 乳头状癌特征性的核,毛玻璃核,出现核沟,核内假包涵体,重叠核(HE,×200)
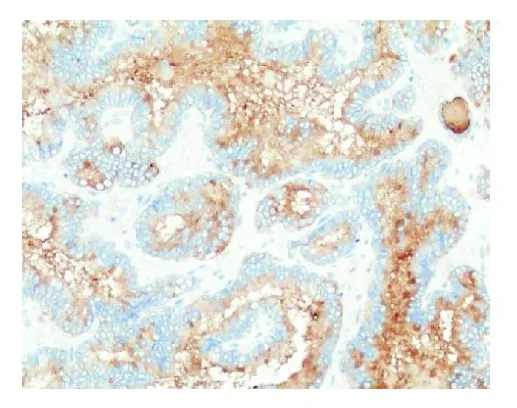
图5 乳头状癌区瘤细胞胞质、胞膜CK19呈阳性表达(SP,×200)
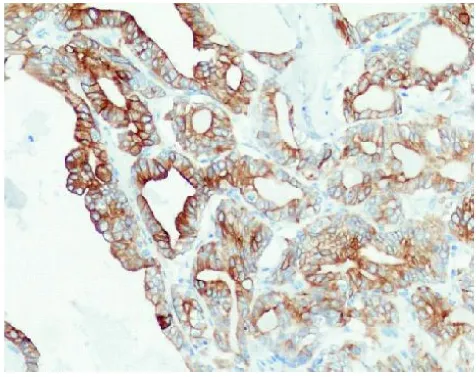
图6 乳头状癌区瘤细胞胞质、胞膜TG呈阳性表达(SP,×200)
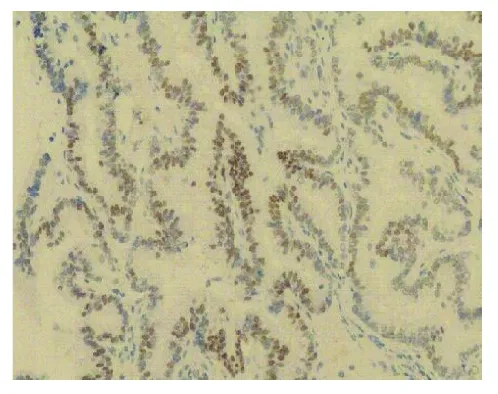
图7 乳头状癌区瘤细胞胞核TTF-1呈阳性表达(SP,×200)
3 讨论
3.1 组织发生卵巢甲状腺肿是完全或主要由甲状腺组织构成的成熟性畸胎瘤,是由最常见的畸胎瘤向单一胚层分化的肿瘤,占卵巢全部畸胎瘤的2.7%[1]。一般认为卵巢甲状腺肿来源于卵巢性细胞,此细胞在正常受精时可发育为胚胎,但未受精或在某些因子刺激下可发育为畸胎瘤,若畸胎瘤中甲状腺成分呈单相发展,掩盖其他胚层成分,则形成甲状腺肿或甲状腺占优势的畸胎瘤。MSO系卵巢甲状腺肿的恶变,占全部卵巢肿瘤的0.01%[1],其发病率较低。MSO由Boettling于1889年首次报道,虽少见,但近年报道逐渐增多,日益受到重视。
3.2 命名命名不一致,有卵巢甲状腺癌、卵巢甲状腺肿恶变、卵巢甲状腺肿恶变(滤泡癌或乳头状癌)等。国外文献一般统称MSO,如伴其他成分用“in”或“and”加以描述[2-3]。何春年等[4]提出将MSO分成两型,对于无畸胎瘤等成分又未见甲状腺恶性变移行过程的称为标准型MSO,即单纯型;如MSO伴有其他确切的畸胎瘤成分,称为癌变型MSO,或称畸胎瘤癌变。按此分型标准,本组中5例均为癌变型MSO,其中4例为三胚层成熟性畸胎瘤伴MSO,1例为单胚层畸胎瘤伴MSO。
3.3 临床病理学特点MSO患者多发生于绝经期后女性,临床症状无特异性,常表现为腰痛、腰酸、腹胀、腹痛、尿频等,可伴胸腔积液和腹水,多数因发现盆腔包块而就诊,偶尔伴假Meigs综合征或甲状腺亢进症状[5],血CA125、CEA、AFP通常正常,少数可有CA125和TG升高,超声检查通常为非特异的,与卵巢成熟性畸胎瘤难以区分[6],肿瘤常发生于单侧,通常情况下,术前很难作出明确诊断,在剖腹探查时,当有肿瘤穿透包膜及粘连、邻近器官的浸润和腹膜转移时,提示恶性可能性[7],但确诊仍依靠术后病理组织学检查。组织学大多数是在成熟性畸胎瘤中的甲状腺背景中见到局灶或广泛分布的甲状腺癌结构,组织学分型多为滤泡型和乳头型,少数只有MSO成分。本组中5例均系畸胎瘤背景中见到乳头状癌结构,未见只有MSO的病例。
3.4 诊断Urman等[8]从组织学将MSO分成3个类型:①经典型乳头状癌,具有典型的有纤维血管轴心乳头结构及特征性核改变,包括毛玻璃核(核大、深染、重叠,核仁不明显,位于增厚的核膜下),胞质陷入核内形成核内包涵体和核沟。②滤泡型乳头状癌,大部分或全部由滤泡构成,常缺乏乳头,诊断主要依据乳头状癌典型核的特征。③滤泡状癌,诊断较困难,仅根据肿瘤本身的组织结构、细胞学的非典型性和核分裂象不能判断良、恶性,主要根据肿瘤有无包膜和血管的浸润或远处转移。武忠弼等[9]、韩仲杰等[10]提出诊断原发MSO标准为:①肿瘤必须是卵巢甲状腺肿恶变者,有明确的侵犯和/或转移;②肿瘤类型必须类似滤泡和/或乳头状癌,偶为嗜酸细胞癌或间变癌;③免疫组化标记TG+;④必须排除甲状腺原发癌转移;⑤必须与卵巢甲状腺肿类癌或浆液性癌鉴别。WHO(2003)女性生殖器官病理学及遗传学分类[11]中提出,MSO的诊断标准与颈部甲状腺恶性病变的诊断标准相同。
MSO术中冷冻切片诊断较困难。因临床发病相对较少,如对MSO的认识不够,则可能出现误诊;又如本组有1例无明显肉眼可见肿物,因冰冻取材的局限性,如果取材不到,极有可能出现漏诊,造成冰冻切片结果出现偏差。在石蜡切片诊断中如对MSO认识不够,也有可能出现诊断困难,如滤泡型,仅根据肿瘤组织结构、细胞学非典型性、核分裂无法判断良恶性,而要确认肿瘤有无包膜、血管浸润及远处转移;再如乳头型,要看到经典的乳头状结构和典型的核改变。免疫组化常有助于确定甲状腺分化。本组5例石蜡切片均见甲状腺乳头状癌的形态学特点,结合免疫组化,诊断明确。
3.5 鉴别诊断原发性MSO必须排除甲状腺原发癌转移,需与卵巢甲状腺肿类癌、卵巢浆液性癌及颗粒细胞瘤相鉴别[12]。本组5例甲状腺B超未发现肿瘤,甲状腺功能检查无异常,免疫组化结果可以将其他类型肿瘤排除,符合原发性MSO诊断。
3.6 治疗及预后以往本病诊断标准混乱,再加上临床相当少见,至今治疗方法不一,手术仍是主要的治疗手段。手术范围从行单纯卵巢切除到全子宫、双附件、盆腔淋巴结清扫、大网膜切除、颈部甲状腺切除[13],年轻有生育要求的可行保守手术,合并局部或远处转移者行卵巢癌细胞减灭术,术后放疗。其他的辅助治疗包括放疗、化疗和甲状腺抑制剂治疗等。
MSO有别于卵巢畸胎瘤其他成分恶变,总体预后好,转移率低。MSO仅有5%发生转移,主要是腹内转移,经血道转移至肝、脑、肺、骨,转移至对侧卵巢的病例也有报道[14]。其预后取决于有无卵巢外肿瘤,若肿瘤局限于卵巢,预后较好,若有转移,则预后差。
[1]Tavassoli FA, Devliee P. WHO(2006)乳腺及女性生殖器官肿瘤病理学及遗传学[M]. 程虹, 戴林, 郭双平, 等, 译. 北京:人民卫生出版社, 2006: 213.
[2]Kabukcuoglu F, Baksu A, Yilmaz B, et al. Malignant struma ovarii[J]. Pathol Oncol Res, 2002, 8(2): 145-147.
[3]Volpi E, Ferrero A, Nasi PG, et al. Malignant struma ovarii: a case report of laparoscopic management[J]. Gynecol Oncol, 2003, 90(1): 191-194.
[4]何春年, 徐翠清, 陈琛, 等. 卵巢恶性甲状腺肿2例并文献复习[J].临床与实验病理学杂志, 2005, 20(3): 314-317.
[5]Zannoni GF,Gallotta V, Legge F, et al. Pseudo-Meigs’syndrome associated with malignant struma ovarii: a case report[J].Gynecol Oncol, 2004, 94(1): 226-228.
[6]路平, 虞积耀, 王嘉羚, 等. 卵巢原发性乳头状甲状腺癌临床病理分析[J]. 诊断病理学杂志, 2006, 13(6): 421-423.
[7]Robboy SJ, Anderson MC, Russell P. 女性生殖道病理学[M].回允中, 译. 北京: 北京大学医学出版社, 2005: 670.
[8]Urman R, Telind ER. Blaustein’s pathology of the female genitaltract[M]. 5th ed. NewYrok: Springer Verlag, 2002: 871-873.
[9]武忠弼, 杨光华. 中华外科病理学[M]. 北京: 人民卫生出版社, 2002: 1396-1397.
[10]韩仲杰, 姜颖, 林昌万. 恶性卵巢甲状腺肿一例[J]. 中华肿瘤杂志, 1998, 20(6): 478.
[11]Silverberg SG, Kurman RJ, Nogales F, et al. Tumours of the uterine corpus[M]//Tavassoli FA, Devilee P. World Health Organization classification of tumors. Pathology and genetics of tumours of the breast and female genital organs. Lyon: IARC Press, 2003: 172.
[12]胡孟钧, 骆雨春, 张春丽, 等. CK19在甲状腺良恶性乳头状增生中的表达和意义[J]. 诊断病理学杂志, 2003, 10(3): 128.
[13]魏风华, 邓文慧, 张毅. 腹膜播散性卵巢甲状腺肿临床分析[J]. 中国医刊, 2007, 42(5): 54.
[14]Ribeiro-Silva A, Bezerra AM, Serafini LN. Malignant struma ovarii: an autopsy report of a clinically unsuspected tumor [J]. Gynecol Oncol, 2002, 87(2): 213-215.
(本文编辑:丁敏娇)
Clinical and pathological analysis of malignant struma ovarii
WEN Lihong1, ZHANG Huxiang2, ZHENG
Xiangyang1, LIN Kerong1, ZHANG Shiqiang1, ZHANG Lei3.1.Department of Pathology,Cangnan County People’s Hospital, Wenzhou, 325800; 2.Department of Pathology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Gynaecology, Cangnan County People’s Hospital, Wenzhou, 325800
Objective: To analyze the clinical pathological features of malignant struma ovarii (MSO).Methods:The clinical data, histological and immumohistochemical finding of 5 cases of MSO was researched with review of literature.Results:Pelvic mass was showed in all the 5 cases, without any clinical evidence of malignancy or metastasis. Morphologically, MSO was found to arrise from teratoma, sometime with transition from benign to malignant, immunohistochemistry showed TTF-1 and TG positive.Conclusion:As a rare tumor, MSO, whose histopathological diagnostic criteria is similar to that of the thyroid primary malignant lesion, is lack of specific clinical symptoms and may be constituent of teratoma. It is divided into papillary and follicular types in histology. It has a good prognosis.
ovarian teratoma; malignant struma ovarii; carcinoma, papillary卵巢恶性甲状腺肿(malignant struma ovarii,MSO)是临床少见的肿瘤,常缺乏独特的临床特征,诊断主要依靠病理组织学和相关免疫组织化学检测技术。笔者收集5例MSO病例,并结合文献探讨其临床病理特点。
R365
B
1000-2138(2014)02-0141-04
2013-06-06
温莉虹(1980-),女,浙江苍南人,主治医师。

