P53结合蛋白1在宫颈鳞癌中的表达及其临床意义
诸海燕,金纬纬,胡燕,郑飞云
(1.温州医科大学附属第一医院 妇科,浙江 温州 325015;2.温州市中西医结合医院 妇科,浙江温州 325000)
·临床经验·
P53结合蛋白1在宫颈鳞癌中的表达及其临床意义
诸海燕1,金纬纬2,胡燕1,郑飞云1
(1.温州医科大学附属第一医院 妇科,浙江 温州 325015;2.温州市中西医结合医院 妇科,浙江温州 325000)
目的:探讨P53结合蛋白1(53BP1)在宫颈鳞癌组织中的表达情况及其与临床分期、分化程度、淋巴结转移以及病灶大小的关系。方法:选取2010年5月至2011年8月期间在温州医科大学附属第一医院妇科收治的临床资料完整的52例宫颈鳞癌、30例宫颈上皮内瘤变(CIN)和20例正常宫颈组织,采用实时荧光定量PCR技术检测53BP1 mRNA的表达水平,并对其表达水平与临床病理特征的关系进行统计学分析。结果:宫颈鳞癌组织中53BP1 mRNA相对表达水平明显低于正常组织,差异具有统计学意义(P<0.05)。宫颈鳞癌中高分化组中53BP1 mRNA相对表达水平明显高于宫颈鳞癌低分化组,差异具有统计学意义(P<0.05)。宫颈鳞癌无淋巴结转移组中53BP1 mRNA相对表达水平明显高于宫颈鳞癌淋巴结转移组,差异具有统计学意义(P<0.05)。宫颈鳞癌FIGO I期组和FIGOⅡ期组以及宫颈鳞癌大病灶组和小病灶组间53BP1 mRNA相对表达水平比较,差异均无统计学意义(P>0.05)。结论:53BP1在宫颈鳞癌组织中表达减低,与分化程度、淋巴结转移有关,与病灶大小、临床分期无明显相关。
宫颈肿瘤;实时荧光定量;聚合酶链反应;P53结合蛋白1
宫颈鳞癌的发生、发展是一个多因素、多步骤的过程,涉及多方面的机制。近年来研究发现,P53结合蛋白1(53BP1)与多种恶性肿瘤如乳腺癌[1]、肺癌[1-2]、皮肤癌[3]有关,但关于其在宫颈鳞癌组织中的表达情况以及与临床病理特征关系的研究尚少。本研究应用实时荧光定量PCR(real-time fluorogentic quantitative polymerase chain reaction,RFQ-PCR)检测宫颈鳞癌患者肿瘤组织中53BP1的表达情况,观察其表达与临床病理特征的关系,探讨53BP1在宫颈鳞癌发生、发展过程中的作用。
1 资料和方法
1.1 一般资料选择2010年5月至2011年8月在温州医科大学附属第一医院行手术治疗的临床资料完整的5 2例宫颈鳞癌和3 0例宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)病例。82例患者年龄33~52岁,平均(42.2±3.8)岁,所有患者术前均未接受放疗或化疗。52例宫颈鳞癌患者按2009年国际妇产科联盟FIGO分期标准:I期30例,I I期22例;根据病灶大小分成小病灶34例(直径≤4 cm)和大病灶18例(直径>4 cm);病理分级为G1 18例,G2 22例,G3 12例;有盆腔淋巴结转移者12例,未转移者40例。另选取20例同期因子宫肌瘤行子宫全切术的正常宫颈新鲜标本作为对照组。新鲜组织离体后迅速液氮冷冻,-80 ℃保存备用。
1.2 试剂与方法
1.2.1 试剂:RT-PCR试剂盒、RNA提取试剂Trizol均由美国Invitrogen公司提供。
1.2.2 实验方法:按照Trizol试剂盒说明书提取各组织总RNA,测定RNA的浓度、纯度符合要求后,进行反转录。cDNA合成反应体系中加入5×反转录缓冲液4 μL(含Mg2+10 mmoL/L),三磷酸脱氧核苷混合液(dNTP)1μL,Random primer 1μL,酶混合液1μL,提取的RNA lμL,以及RNA酶灭活水12μL。反转录反应条件如下:65 ℃ 5 min,42 ℃60 min,70 ℃ 5 min,循环1次。反转录反应产物于-20 ℃冰箱保存备用。利用在线Primer 5.0软件设计引物,再用Oligo 6.0软件评估,由Invitrogen公司合成。53BP1基因引物序列(产物大小183 bp)上游:5’-CCTCAGGCTCTGGTGACTTC-3’,下游:5’-TG ACAGCACAGCCCAGTAAG-3’;以GAPDH作为内参照,其引物序列(产物大小314 bp)上游:5’-GGTCGGAGTCA ACGGATTTG-3’,下游5’-ATGAGCCCCAGCCTTCTCCAT-3’。反应体系为25μ L,反应条件:94 ℃ 30 s,57℃ 30 s,72 ℃ 60 s,40个循环;72 ℃延伸10 min。以正常宫颈组织为对照组,53BP1 mRNA相对表达量用以下公式计算:folds=2-ΔΔCt,其中Δ ΔCt=处理组(Ct目的基因-Ct内参照基因)-对照组(Ct目的基因-Ct内参照基因)。
1.3 统计学处理方法采用SPSS 15.0软件进行统计学分析。两样本的均数比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 53BP1在不同宫颈组织中的表达情况组织提取总RNA的时间为获得新鲜标本后1~2个月。所有样本RNA的A260/A280为1.7~1.9,结果显示各样本RNA完整性佳,纯度高,可信度好。53BP1基因与内参照(GAPDH)之Ct值及扩增曲线均由RFQ-PCR仪自动给出(见图1A-B),经熔解曲线分析,目的基因和内参基因均表现为单峰,熔解温度适宜,故判断PCR反应特异性强(见图2A-B)。计算结果示,53BP1 mRNA相对表达量符合正态分布(P=0.542),53BP1 mRNA在CIN、宫颈鳞癌组织中相对表达量分别为1.424±0.40、0.5724±0.148。统计学分析显示宫颈鳞癌组织中53BP1 mRNA的相对表达量明显低于CIN及正常宫颈组织(P<0.05),CIN与正常宫颈组织比较差异无统计学意义(P>0.05)。
图1 53BP1和内参GAPDH的Ct值

图2 53BP1和内参GAPDH的熔解曲线
2.2 53BP1的表达与临床病理特征的关系宫颈鳞癌中高分化组中53BP1 mRNA相对表达水平明显高于宫颈鳞癌低分化组,差异具有统计学意义(P<0.05)。宫颈鳞癌无淋巴结转移组中53BP1 mRNA相对表达水平明显高于宫颈鳞癌淋巴结转移组,差异具有统计学意义(P<0.05)。宫颈鳞癌FIGO I期组和FIGO I I期组以及宫颈鳞癌大病灶组和小病灶组中53BP1 mRNA相对表达水平比较,差异无统计学意义(P>0.05)。见表1。
3 讨论
3.1 53BP1在宫颈鳞癌发生、发展中的作用53BP1是由Iwabuchi等[4]通过酵母双杂交筛选获得的与p53相互作用的蛋白,其基因定位于15q15-21上。53BP1生理功能广泛,不仅参与DNA损伤修复反应,而且调控细胞周期。由于能快速地聚集在DNA双链断裂部位,53BP1被认为是内源性DNA双链损伤的标记分子之一[3,5]。目前研究认为53BP1基因可能是一个抑癌基因,从正常细胞、癌前病变到肿瘤的发生、发展过程中,53BP1表达减少甚至失活,细胞凋亡率降低。研究已证实在多种人类恶性肿瘤组织中如肺癌、乳腺癌、恶性黑色素瘤等中均存在53BP1表达异常缺失[1,6]。Nuciforo等[7]对非鳞状细胞肺癌发生过程进行研究发现,从正常上皮到低度异型增生开始,肿瘤进展过程中存在进行性的大量的53BP1丢失。杜然等[8]应用免疫组化方法研究了53BP1蛋白与前列腺癌之间的关系,结果发现53BP1在良性前列腺增生、高级别上皮内瘤变和癌旁良性前列腺上皮内的表达高于前列腺癌组织。本研究采用RFQPCR法检测宫颈鳞癌、癌前病变和正常宫颈组织,发现53BP1 mRNA在宫颈鳞癌组织中的相对表达量明显低于CIN以及正常宫颈组织,提示53BP1在宫颈鳞癌的发生、发展过程中可能具有类似于抑癌基因的功能。
表1 宫颈鳞癌患者临床病理特征与53BP1 mRNA表达水平的关系(±s)
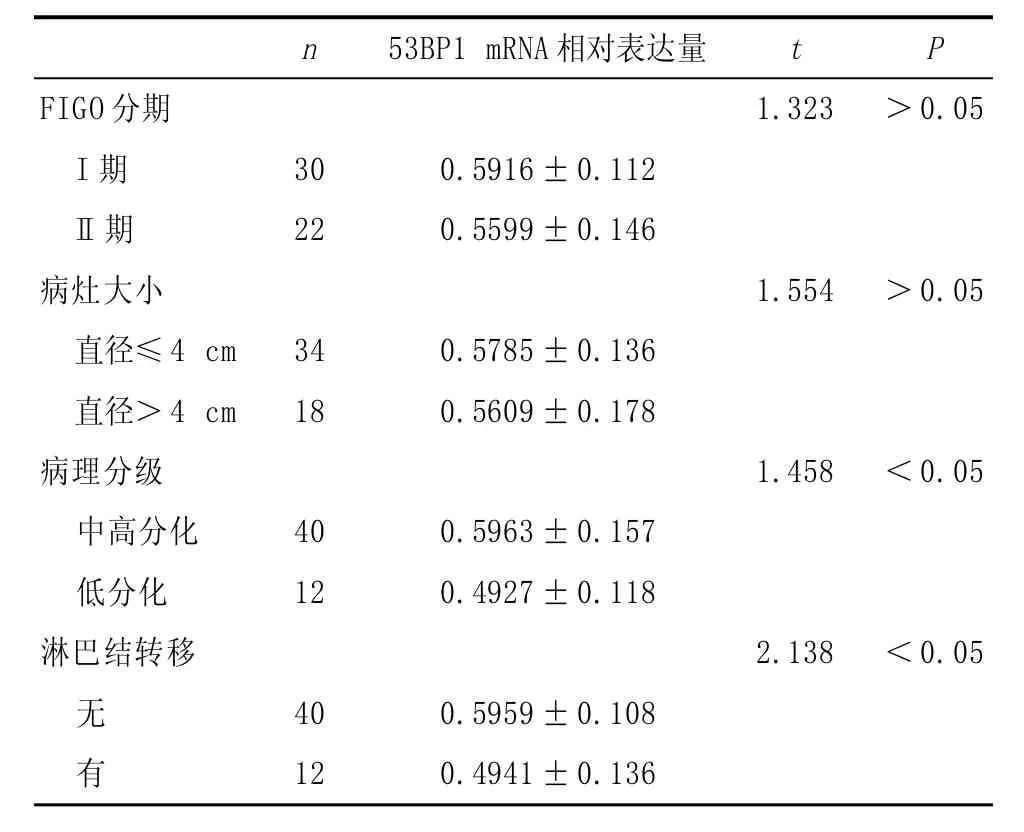
表1 宫颈鳞癌患者临床病理特征与53BP1 mRNA表达水平的关系(±s)
n 53BP1 mRNA相对表达量t P FIGO分期I期I I期病灶大小直径≤4 cm直径>4 cm病理分级中高分化低分化淋巴结转移1.323>0.05 30 22 0.5916±0.112 0.5599±0.146 1.554>0.05 34 18 0.5785±0.136 0.5609±0.178 1.458<0.05 40 12 0.5963±0.157 0.4927±0.118 2.138<0.05无有40 12 0.5959±0.108 0.4941±0.136
动物实验研究显示,53BP1缺失的小鼠更易形成肿瘤,同时还有机体发育迟缓、免疫缺陷、放射线敏感性改变等异常表现[9]。但53BPl的肿瘤抑制机制目前尚未完全清楚。Gorgoulis等[6]的实验发现,P53相关细胞凋亡的减少与肿瘤细胞53BP1 mRNA和相应蛋白表达降低存在相关性;53BPl基因的失活会导致细胞从与癌基因诱导的细胞周期阻滞中逃逸,并且会损害依赖P53的细胞凋亡。关于53BP1对卵巢癌生长能力影响的研究[10]发现:①53BP1通过降调Bcl-2及p-Akt蛋白表达,同时增强Bax以及P21wafl/cip1蛋白的活性,增加卵巢癌细胞的凋亡率及G2/M期阻滞,从而抑制卵巢癌细胞的增殖生长能力。②53BP1通过降调节上皮性卵巢癌细胞MMP-9的分泌水平抑制其侵袭能力。③53BP1延迟了上皮性卵巢癌细胞裸小鼠移植瘤形成的时间,抑制移植瘤的生长速度及大小,并延长荷瘤裸小鼠的生存时间,降低了上皮性卵巢癌细胞的裸小鼠致瘤能力。关于53BP1与宫颈癌的关系,Matsuda等[11]通过免疫荧光法研究发现53BP1核聚水平和HPV感染以及p16 INK4a高表达相关,认为其可能与HPV感染以及复制压力相关。
3.2 53BP1的表达与宫颈鳞癌临床病理特征的关系
本研究分析了53BP1 mRNA的表达水平与宫颈鳞癌临床病理参数之间的关系,结果显示53BP1 mRNA的降调与宫颈鳞癌分化程度相关,低分化组53BP1 mRNA表达水平明显低于中高分化组,这与唐卓葳等[12]关于乳腺癌的研究结果类似。本研究还观察到53BP1 mRNA的降调与宫颈鳞癌淋巴结转移相关,有淋巴结转移组的53BP1 mRNA表达水平明显低于无淋巴结转移的宫颈鳞癌,在有淋巴结转移的宫颈鳞癌组织中53BP1的降调可能与修复DNA损伤能力显著降低有关[12]。Bouwman等[13]通过对286例乳腺癌患者癌组织中53BP1 mRNA及蛋白水平的表达情况的研究也得到了类似的结果。但本研究中53BP1 mRNA的降调与宫颈鳞癌病灶大小、临床分期无明显相关。
综上所述,检测53BP1有助于综合判断宫颈鳞癌的恶性程度和转移潜能,但是关于53BP1在宫颈鳞癌方面的研究仍处于初级阶段,其具体机制,还需要继续深入研究。
[1]Bartkova J, Horejsi Z, Sehested M, et al. DNA damage response mediators MDC1 and 53BP1: constitutive activation and aberrant loss in breast and lung cancer, but not in testicular germ cell tumours[J]. Oncogene, 2007, 26(53): 7414-7422.
[2]Lai TC, Chow KC, Lin TY, et al. Expression of 53BP1 as a cisplatin-resistant marker in patients with lung adenocarcinomas[J]. Oncol Rep, 2011, 24(2): 321-328.
[3]Naruke Y, Nakashima M, Suzuki K, et al. Alteration of p53-binding protein 1 expression during skin carcinogenesis: association with genomic instability[J]. Cancer Sci, 2008, 99 (5): 946-951.
[4]Iwabuchi K, Li B, Massa HF, et al. Stimulation of p53-mediated transcriptional activation by the p53-binding proteins, 53BP1 and 53BP2[J]. J Biol Chem, 1998, 273 (40): 26061-26068.
[5]Nakashima M, Suzuki K, Meirmanov S, et al. Foci formation of P53-binding protein 1 in thyroid tumors: activation of genomic instability during thyroid carcinogenesis[J]. Int J Cancer, 2008, 122(5): 1082-1088.
[6]Gorgoulis VG, Vassiliou LV, Karakaidos P, et al. Activation of the DNA damage checkpoint and genomic instability in human precancerous lesions[J]. Nature, 2005, 434(7035): 907-913.
[7]Nuciforo PG, Luise C, Capra M, et al. Complex engagement of DNA damage response pathways in human cancer and in lung tumor progression[J]. Carcinogenesis, 2007, 28(10): 2082-2088.
[8]杜然, 张惠箴, 陈杰, 等. 53BP1蛋白表达缺失与前列腺腺癌临床病理的关系[J]. 临床与实验病理学杂志, 2011, 27(1): 44-47.
[9]Ward IM, Difilippantonio S, Minn K, et al. 53BP1 cooperates with p53 and functions as a haploinsufficient tumor suppressor in mice[J]. Mol Cell Biol,2005, 25(22): 10079-10086.
[10]Hong S, Li X, Zhao Y, et al. 53BP1 suppresses tumor growth and promotes susceptibility to apoptosis of ovarian cancer cells through modulation of the Akt pathway[J]. Oncol Rep, 2012, 27(4): 1251-1257.
[11]Matsuda K, Miura S, Kurashige T, et al. Significance of p53-binding protein 1 nuclear foci in uterine cervical lesions: endogenous DNA double strand breaks and genomic instability during carcinogenesis[J]. Histopathology, 2011, 59(3): 441-451.
[12]唐卓葳, 吴诚义. 53BP1在乳腺癌中的表达及其意义[J]. 中国普通外科杂志, 2009, 18(5): 518-521.
[13]Bouwman P, Aly A, Escandell JM, et al. 53BP1 loss rescues BRCA1 deficiency and is associated with triple-negative and BRCA-mutated breast cancers[J]. Nat Struct Mol Biol, 2010, 17(6): 688-695.
(本文编辑:丁敏娇)
Study on the expression and its clinical significance of 53BP1 in cervical carcinoma
ZHU Haiyan1, JIN
Weiwei2, HU Yan1, ZHENG Feiyun1.1.Department of Gynecology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Gynecology, Wenzhou Traditional Chinese Combined with Western Medicine Hospital, Wenzhou, 325000
Objective: To explore the expression of P53-binding protein 1 (53BP1) in the tissue of cervical squamous carcinoma and relationship among their clinical stages, the degree of differentiation, lesion of lymph node metastasis and size.Methods:Fifty-two cases of cervical squamous carcinoma, 30 cases of cervical intraepithelial neoplasia (CIN) and 20 cases of normal cervical tissue were selected. Then the real-time fluorescent quantitative PCR was adopted for the detection of 53BP1 mRNA expression, and the statistical analysis of its expression and its clinical pathological characteristics were complemented as well.Results:53BP1 mRNA in cervical squamous carcinoma relative expression levels were significantly lower than that in normal tissue, and the difference was statistically significant (P<0.05). 53BP1 mRNA expression in the differentiation of cervical squamous carcinoma in higher group level was significantly higher than that in the group of poorly differentiated carcinoma of the cervix, and the difference was statistically significant (P<0.05). 53BP1 mRNA in cervical lymph node metastasis-free group relative expression levels were significantly higher than that in the cervical lymph node metastasis group, and the differences were statistically significant (P<0.05). Compared the expression levels in FIGO I group of cervical cancer and cervical carcinoma FIGO II group, and focus-group and small lesions 53BP1 mRNA, the difference was not statistically significant (P>0.05).Conclusion:53BP1 expression in cervical squamous cancer reduction is associated with the degree of differentiation, lymphatic metastasis, and lesion size, while it is not significantly related in clinical stages.
uterine cervical neoplasms; real-time fluorogentic quantitative; PCR; 53BP1
R71
B
1000-2138(2014)02-0134-04
2013-09-08
温州市科技计划基金资助项目(Y2009 0261)。作者简介:诸海燕(1978-),女,浙江温州人,主治医师,硕士。
胡燕,主任医师,Email:627830566@qq.com。

