颅内脑发育性静脉异常并发海绵状血管瘤2例报道并文献复习
钟小丽 李小波 范学军
脑静脉血管畸形(cerebralvenousmalformation,CVM)是由先天性发育异常导致的,亦称脑发育性静脉异常(developmentalvenousanomaly,DVA),又名脑静脉性血管瘤(cerebralvenousangioma,CVA)。1963年由Courville首先报道[1]。1986年Las.janunias认为本质上该病是一种正常引流静脉的非病理性变异,故称为DVA。DVA本身可引起各种症状,但一般症状较轻,其中大部分DVA患者终身可以无症状,因而未引起足够关注,临床报道病例亦少。最近发现DVA常和动静脉畸形、海绵状血管瘤(cerebralcavernousmalformation,CCM)、硬脑膜动静脉瘘、脑毛细血管扩张症等血管畸形联合出现,往往导致病情加重,此时保护DVA对上述联合出现的疾病的治疗极其关键。因此,深入了解脑静脉系统的解剖特点,加强对DVA的认识,并探查DVA与动静脉畸形、CCM、硬脑膜动静脉瘘、脑毛细血管扩张症等脑血管畸形之间的关系,对提高脑血管畸形的临床诊断及治疗水平具有重要意义。现将2例DVA并发CCM病例报道如下,以进一步提高对本病的认识,为以后临床诊治提供帮助。
1 临床资料
病例1,患者,女,42岁,主因“头痛1年余,加重3d”于2013年10月19日就诊于本科。患者于1年余前无明显诱因出现头痛,呈间歇性额顶部胀痛,有紧箍感,尚可忍受,多于紧张及情绪激动时发作,平静后可缓解,无明显伴随症状。于3d前出现上述症状加重,头痛程度明显加重,难以忍受,遂于2013年10月19日就诊于本院门诊,予查头部CT见左侧基底节内囊前支片状高密度灶(图1),考虑脑出血或血管瘤可能,遂收住院。既往史、个人史无特殊,家人无类似症状。入院查体:体温36.3℃,脉搏60次/min,呼吸20次/min,血压102/67mmHg(1 mmHg=0.133kPa)。精神可,心、肺、腹无阳性体征。神经系统查体:神志清楚,言语流畅清晰,颅神经检查无明显异常。脑膜刺激征未引出。四肢肌力、肌张力正常。四肢深浅感觉正常,腱反射对称正常,双侧病理征未引出,跟膝胫运动正常,步态正常。患者于本院住院期间辅助检查:血脂示甘油三脂(2.44mmol/L),低密度脂蛋白胆固醇(3.37mmol/L),血常规、尿常规、大便常规、凝血功能、肝肾功能、空腹血糖、电解质正常。胸片及心电图正常。查头部MRI(平扫+增强+MRA+SWI)示左侧基底节结节状混杂信号灶,周围见环形低信号灶,SWI示左侧基底节呈低信号(图2~4),诊断为海绵状血管瘤,但患者头部SWI序列中显示低信号灶周围隐约可见条状血管影伸入,MRA未见明显异常,为进一步明确,予行脑血管DSA检查提示左侧基底节区异常静脉改变,考虑发育性静脉异常可能(见图5),临床诊断为“脑发育性静脉异常并发颅内海绵状血管瘤”。患者入院后予以改善微循环、护脑等对症处理后头痛症状好转,予转神经外科行颅内海绵状血管瘤伽马刀治疗。

图1 头颅CT示左侧基底节高密度灶

图2 MRA未见明显异常

图3 MRI头颅示左侧基底节可见大小约1.0×1.3cm结节状混杂信号灶,周围见环形低信号灶
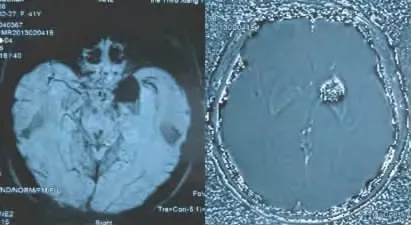
图4 SWI序列可见左侧基底节低信号改变,周围隐约可见条状血管影伸入,校正的相位图像上见左侧基底节区混杂信号灶

图5 脑血管DSA示左侧基底节可见多发髓静脉显影,放射状汇集呈一条扩张的中央静脉干,走行迂曲,向大脑大静脉及直窦方向引流
病例2,患者,男,43岁,主因“头颈部胀痛1月余”于2013年10月11日就诊于本科。患者于1月余前无明显诱因出现头痛,呈头顶及颈部间歇性胀痛,程度中等,可忍受,持续时间几分钟至数小时不等,无恶心呕吐、发热等伴随症状,遂于2013年10月11日收住本科住院治疗。既往有吸烟史20余年,20支/d,余个人史无特殊。家人无类似症状。入院查体:体温36.3℃,脉搏74次/min,呼吸20次/min,血压117/68mmHg(1mmHg=0.133kPa)。精神可,心、肺、腹无阳性体征。神经系统查体:神志清楚,言语流畅清晰,颅神经检查无明显异常。脑膜刺激征未引出。四肢肌力、肌张力正常。四肢深浅感觉正常,腱反射对称正常,双侧病理征未引出,跟膝胫运动正常,步态正常。患者于本院住院期间辅助检查:血常规、大小便常规、凝血功能、肝肾功能、空腹血糖、血脂、心肌酶学、电解质等正常,心电图正常。头部MRI(平扫+MRA+MRV+SWI)示右侧基底节混杂信号灶,边缘呈低信号环,诊断为颅内海绵状血管瘤。但其头部SWI序列见混杂信号灶边缘多支异常细小血管伸入,性质不明(图6~9)。遂予行股脑血管DSA检查明确为脑发育性静脉异常(图10)。诊断为“脑发育性静脉异常并发颅内海绵状血管瘤”。患者入院后予以醒脑、护脑等对症处理后病情好转,遂转神外经科行颅内海绵状血管瘤伽马刀治疗。
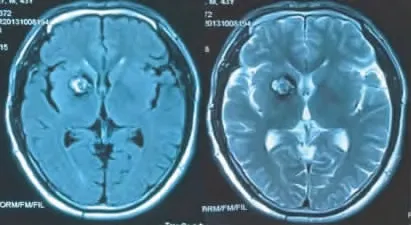
图6 头颅MRI示右侧基底节见一直径约2.1cm高低混杂信号灶,边缘呈低信号环,右侧基底节及右侧侧脑室旁多发条状异常信号影
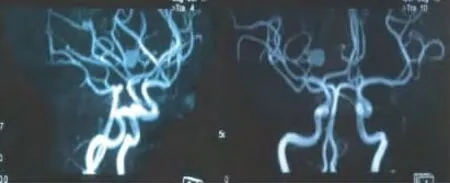
图7 MRA未见明显异常
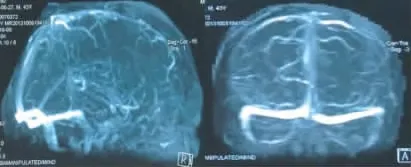
图8 MRV未见明显异常

图9 SWI示右侧基底节一直径约2.1cm高低混杂信号灶,边缘可见多支异常细小血管伸入,校正的相位图像见左侧基底节区混杂信号灶

图10 脑血管DSA示相当于右侧基底节可见多发髓静脉显影,放射状汇集呈一条扩张的中央静脉干,走行迂曲,向直窦方向引流
2 讨论
本报道2例患者,男(43岁)女(42岁)各1例,症状类似,均以头痛发病,症状呈间歇性,间歇期无明显症状,无伴随症状,缓慢起病,病程1月~1年。2例均无家族遗传史。神经系统体查均无异常。1例患者头部CT上见片状高密度灶,其内似可见点状钙化灶(图1)。均行头颅MRI-SWI证实病灶部位有呈“桑葚状”或网格状混杂信号团,周围环以低信号带,与正常脑组织分界清晰(图3、4,图6、9),支持海绵状血管瘤的诊断,2例患者颅内均为1个病灶,均分布于基底节(1例位于左侧,1例位于右侧,呈近似对称性)。
2例患者磁敏感成像(SWI)中可见混杂信号灶或低信号灶周围多支异常小血管伸入(图4,图9),性质待定,头部MRA或MRV未见明显异常(图2,图7、8),为进一步明确诊断,遂予行脑DSA检查。
本组2例患者DSA均表现为DVA的蜈蚣状影像特征,即静脉期示相当于基底节可见多发髓静脉显影,放射状汇集呈一条扩张的中央静脉干,走行迂曲,向大脑大静脉或直窦方向引流(图5,图10)。可明确诊断为脑发育性静脉异常。有研究报道,以上所述头部MRI-SWI所见异常血管影为集合静脉扩张、粗大、流速相对较快所致。蜈蚣样表现的病理解剖是因穿髓静脉血管壁缺乏平滑肌及弹力纤维而出现管壁增生、纤维样变性、异常扩张、硬化,腔内造影剂慢速流向粗大的集合静脉,由于单支或多支穿髓静脉扩张显影,出现蜈蚣样或放射状、轮辐状并向集合静脉会聚,形成水母头或蜈蚣状表像。但部分病例也可表现为杂乱的树丛状、网状等不典型改变。静脉引流方向因累及部位如幕上、幕下,浅髓、深髓静脉等的不同而异,深部穿髓静脉汇入横窦、乙状窦、基底静脉、大脑大静脉,浅髓引流静脉流向皮质进入上矢状窦,本组全部向深部引流。关于DVA的分布部位,有文献报道额叶多见,占36%~56%、顶叶12%~24%、颞叶19%、枕叶4%、小脑14%~29%、基底节6%、丘脑和脑室11%、脑干5%[2]。本报道2例患者均分布于基底节,1例位于左侧基底节,1例位于右侧基底节。本组2例患者DSA影像上引流静脉及扩张的髓静脉显像清晰,与MRISWI序列相比,能清楚显示血管数量及其走行。
DVA均可见于儿童及成人,以中年男性多见,研究发现DVA的发生率为2.5%~3%,占颅内及脊髓内血管畸形的63%,是常见的脑血管畸形[3~5]。有研究报道,大多数DVA患者无症状,多因其他疾病行CT或MR检查而偶然发现,少数病例以癫痫间、头痛、感觉、运动障碍及共济失调为首发,出血者仅占0.61%~1%[6~8]。组织学上DVA是由单个或多个扩张的髓质静脉放射状汇集到一支中心静脉,穿过大脑半球或小脑半球,引流入浅静脉或大脑大静脉等深静脉,最后进入相邻的静脉窦,无明显的供血动脉及直接的动静脉引流短路,DVA无增生能力,其散布于正常脑组织之中[9]。有部分相关研究显示,DVA是继发于妊娠期胎儿脑静脉栓塞后的一种代偿性发育结构。但亦有研究认为,DVA的发生与人类第1、9号染色体短臂的基因突变有关。DVA可能是多机制发病,其确切病因有待进一步研究。CCM为内皮细胞组成的扩张的窦状间隙,间隔胶原基质,但缺乏弹性蛋白、平滑肌及其他血管壁成分,是以灶性出血和癫痫间发作为特点的脑内错构瘤,其病灶在颅内界限清楚。临床分为两类,即散发性海绵状血管瘤(Sporadiccerebralcavernousmalformation,sCCM)、以常染色体不完全性显性遗传的家族性海绵状血管瘤(familialcerebralcavernousmalformation,fCCM)。本报道2例患者颅内均为单个病灶,且其家系调查中无类似病例,属非家族性CCM[10,11]。CCM临床表现多种多样,随部位而异。常见的临床症状为头痛、癫痫间发作、视力改变、进行性神经功能障碍和脑出血,也可以无症状,以反复出血、癫痫间、头痛多见,幕上病灶以癫痫间多见,幕下病灶以局部神经功能障碍多见。本报道2例患者,临床均表现为头痛,第1例患者考虑为颅内海绵状血管瘤并发颅内渗血所致,第2例患者头痛考虑为脑内血管异常所致紧张性头痛。从临床诊断来看,本2例患者均由于头痛表现经头部MRI-SWI检查先明确诊断为CCM,然后因磁敏感成像中见混杂信号灶或低信号灶周围多支异常小血管伸入,进一步行脑血管造影检查发现DVA。DVA起病隐匿,临床症状轻,且大部分可终身无症状,困此临床上难以发现。对于临床上发现的CCM患者,若查头部MRI-SWI发现异常血管影等异常影像,需进一步完善脑血管造影检查,以排除并发DVA可能。作为脑血管病检查的金标准,脑血管造影应作为DVA诊断的首选检查,且检查需密切观察静脉相早期或中期影像改变情况,以提高DVA检出率。
DVA常合并海绵状血管瘤、毛细血管扩张症及动静脉瘘,其中最常见的是海绵状血管畸形。有研究显示,DVA患者中合并海绵状血管畸形比率为13%~40%[12]。且这些患者的脑出血发生率显著高于单纯海绵状血管畸形患者[13]。关于DVA与sCCM发病机制之间的相互关系已成为近年来的一个研究热点[14],有研究者认为,DVA、海绵状血管畸形及毛细血管扩张症本质上为同类疾病[15]。近年来研究发现fCCM与DVA关系不密切,联合出现的发生率远远低于散发病例[16,17],因此提出DVA并发CCM可能有基因外的发生机制。如Petersen等研究观察到DVA改变在先,而后出现CCM,因而认为为引流静脉狭窄、内皮细胞损害、血细胞外渗导致CCM[3]。Larson等研究也提示同样的机制[18]。Hong等报道21例DVA区域内存在CCM病例,认为大部分(97%)的CCM远端引流静脉、髓静脉弯曲、成角,引流静脉狭窄,髓静脉扭曲[19],进一步表明DVA血管因素可造成血流障碍,是DVA区域内出现sCCM的关键因素[14]。本报道2例患者DVA并发sCCM联合出现,无颅内放疗史,发病前无MRI等记录,难以分析两者之间的先后或因果关系。对DVA并发CCM相邻关系的研究发现2例患者sCCM病灶均发生在DVA区域,MRI-SWI可见DVA与CCM紧密相接,由(图4,图9)可见引流静脉与CCM病灶呈成角弯曲,推测可能因血管引流不畅因素导致CCM形成,但其确切的发病机制仍不明确。2例患者头部MRI明确为颅内海绵状血管瘤,同时经DSA检查证实并发有静脉异常,无供血动脉(图5,图10),符合DVA并发海绵状血管瘤诊断。
据DVA的自然发展史,大多数无症状病例可无需处理,但应注意引流静脉梗死、颅内出血等并发症的出现,且合并CCM时颅内出血风险明显增大。目前DVA尚无特殊性治疗。DVA合并CCM的处理方法包括显微外科手术切除或应用立体定位放射治疗CCM,但外科切除CCM时应注意防范引流静脉梗死等并发症。当病变位于重要功能区,尤其靠近脑干者,更需慎重。对于MRI显示静脉充血、急性或亚急性缺血梗死的巨大、复杂的DVA病例时,应考虑予抗凝治疗。关于DVA是否适合外科处理,目前研究意见尚不一致。
1 Lasjaunias P,Burrows P,Planet C. Developmental venous 8nonl“es (DVA):theso-called veHous angioma. Neurosurg Rev,1986,9 (3):233-242.
2 Pereira VM,Geibprasert S,Krings T,et al. Pathomechanisms of symptomatic developmental venous anomalies. Stroke,2008,39 ( 12 ):3201.
3 Wilms G,Marchal G,Van Hecke P,et al. Cerebral venous angiomas.MR imaging at 1. 5 Tesla. Neuro-radiology,1990,32(2):81-85.
4 Saito Y,Kpbayashi N. cerepral venous angiomas: clinical cyaluation and possible etiology. Radiology,1981,139(1):87-94.
5 Jellinger k. Vascular malformations of the central nervous system: a morphological overview. Neurosurg Rev,1986,9(3):177-216.
6 Wiklins RH. Rengacharg SS. Neurosurgery update Ⅱ. New York: McGraw-lliu,1991. 134-139.
7 胡锦清,徐治敏.脑发育性静脉异常的影像学表现及诊断(综述).国外医学临床放射学分册,1998,4(6):336.
8 McLaughlin MR,Kondzidka D,Flickinger JC,et al. The prospective natural history of cerebral venous malformations. Neurosurgery,1998,43(2):195.
9 Ostertun B,Solymosi L. Magnetic resonance angiography of cerebral developmental venous anomalies:its role in differential diagnosis. Neuroradiology,1993,35(2):97-104.
10 Tanriover G,Boylan AJ,Diluna ML,et al. PDCD10,the gene mutated in cerebral cavernous malformation 3,is expressed in the neurovascular unit. Neurosurgery,2008,62(4):930-938.
11 Ardeshiri A,Beriras A,Beiras-Fernandez A,et al. Multiple cerebral cavernous malformations associated with extracranial mesenchymal anomalies.Neurosurg Rev,2008,31(1):11-17.
12 San Milla'n Rul'z D,Delavelle J,Yilmaz H,et al. Parenchymal abnormalities associated with developmental venous anomalies. Neuroradiology,2007,49(12):987-995.
13 Moriarity JL,Wetzel M,Clatterbuck RE,et al. The natural history of cavernous malformations:a prospective study of 68 patients. Neurosurgery,1999,44(6):1166-1171.
14 Dammann P,Barth M,Zhu Y,et al. Susceptibility weighted magnetic resonance imaging of cerebral cavernous malformations: prospects,drawbacks,and first experience at ultra-high field strength (7-Tesla) magnetic resonance imaging. Neurosurg Focus,2010,29(3):E5.
15 Abla A,Wait SD,Uschold T,et al. Developmental venous anomaly,cavernous malformation,and capillary telangiectasia: spectrum of a single disease. Acta Neurochir,2008,150(5):487-489.
16 Petersen TA,Morrison LA,Schrader RM,et al. Familial versus sporadic cavernous malformations:differences in developmental venous anomaly association and lesion phenotype. AJNR Am J Neuroradiol,2010,31(2):377-382.
17 Abdulrauf SI,Kaynar MY,Awad IA. A comparison of the clinical profile of cavernous malformations with and without associated venous malformations. Neurosurgery,1999,44(1):41-46.
18 Larson JJ,Ball WS,Bove KE,et al. Formation of intracerebral cavernous malformations after radiation treatment for cerebral nerve system neoplasia n children. J Neurosurgery,1998,88(1):51-56.
19 Hong YJ,Chung TS,Suh SH et al. The angioarchitectural factors of the cerebral developmental venous anomaly;can they be the causes of concurrent sporadic cavernous malformation? Neuroradiology,2010,52 (10):883-891.

