脊髓神经元凋亡在鞘内注射血小板活化因子诱发大鼠痛敏中的作用
杨京利 段宏伟 马国平
血小板活化因子(platelet-activatingfactor,PAF)是免疫细胞和炎症细胞产生的一种强效的炎症介质,PAF通过与其受体结合发挥生物学效应。近年有研究表明,PAF可能参与疼痛的中枢调控机制[1]。本研究旨在观察鞘内注射PAF对脊髓神经元凋亡的影响,并探讨脊髓神经元凋亡在PAF参与的疼痛调控机制中的作用。
1 材料与方法
1.1 材料及试剂 PAF购自Sigma公司,溶解于人工脑脊液;VonFrey纤维(Stoelting公司产品,美国),辐射热测痛仪(BME-410A型,中国医学科学院生物医学工程研究所),原位凋亡检测(TUNEL)试剂盒(北京中杉金桥生物技术有限公司)。
1.2 实验动物及分组 雄性Sprague-Dawley大鼠,体重200~250g,由华中科技大学同济医学院实验动物中心提供。大鼠腹腔注射10%水合氯醛(300 mg/kg)麻醉后参考Milligan等[2]的方法行鞘内置管术。将鞘内置管成功且无运动障碍的雄性Sprague-Dawley大鼠60只随机分为2组:对照组,30只,经鞘内所置PE-10导管注射10μl人工脑脊液(artificialcerebralspinalfluid,ACSF);PAF组,30只,鞘内注射PAF10μg,溶解于10μl人工脑脊液。
1.3 痛阈测定 鞘内置管后测定基础痛阈,分别于鞘内给药前1d、给药后1、3、5、7、14d分别测定机械痛阈(PWMT)和热痛阈(PWTL),将大鼠置于升高的金属网上,盖以透明的有机玻璃罩;先让大鼠适应环境15min,待大鼠的梳理和探究活动基本消失后用一系列标准化的vonFrey纤维垂直刺激大鼠后肢足底中部,使之稍成S形,持续6~8s,观察是否出现缩足反应;大鼠在刺激时间内或在移开von Frey纤维时立即出现快速的缩足反应,记为阳性反应,而身体活动所引起的缩足反应不记作阳性反应;每隔5s测1次,连测10次,诱发4~6次缩足的值作为50%缩足反应阈值。参照Hargreaves等[3]的方法,采用辐射热测痛仪(BME-410A型,中国医学科学院生物医学工程研究所)测定PWTL;将大鼠置入底板为玻璃板(厚度为2mm)的方形透明塑料笼中,适应环境5min;辐射热源为高强度卤素灯泡,置于玻璃板下方,调整灯泡和玻璃板间的距离使光束投射在玻璃板上的光斑直径为5mm,热源强度设定为10.5V;将加热灯泡对准后爪掌面正中,启动加热灯,大鼠移开后爪的瞬间仪器记录并显示的时间为热缩爪潜伏期;左右后爪各测1次,2次测痛间隔3 min,取平均值。
1.4 免疫组织化学染色 大鼠分别于给药后1、3、5、7、14d(每时点分别取6只大鼠)用10%水合氯醛分批麻醉下剖胸暴露心脏,经尖心部插管灌流固定,先用约200ml生理盐水快速冲洗至流出液澄清,再用500ml的4%多聚甲醛灌流固定,然后取L4-L6段脊髓组织置于30%多聚甲醛液中后固定24 h,再将其常规石蜡包埋,3μm连续切片,行TUNEL染色;应用图像分析仪分析脊髓中的凋亡神经细胞,并计算凋亡指数(AI),AI=凋亡细胞核数/总细胞核数×100%。
1.5 统计学处理 所有数据以均数±标准差(¯x±s)表示,采用SPSS11.0统计软件包,2组间比较采用非配对t检验,疼痛与调亡指数的相关性采用直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 PAF鞘内注射1d后诱发大鼠触觉痛敏和热痛敏,各组大鼠机械缩爪阈值和热缩爪潜伏期的变化见图1~2。

图1 术后1dPAF组触诱发痛逃避潜伏期显著降低,各时间点与对照组比较有显著性差异(P<0.05);与对照组比较,PAF组在术后1、3、5、7d的触诱发痛觉潜伏期延长,2组各时间点比较均有显著性差异(P<0.01)
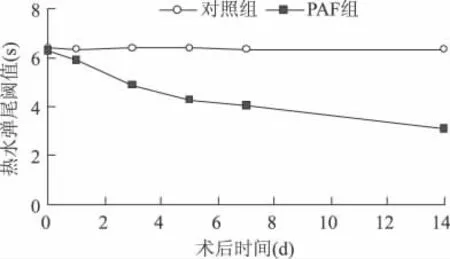
图2 术后1dPAF组热水尾弹痛觉潜伏期显著降低,各时间点与对照组比较有显著性差异(P<0.05);与对照组比较,PAF组在术后1、3、5、7d的热痛觉潜伏期延长,2组各时间点比较均有显著性差异(P<0.01)
2.2 2 组神经细胞凋亡变化
鞘内注射PAF1d后PAF组所有组织切片均有不同程度分布的阳性细胞,与对照组比较有显著性差异(P<0.01)(表1)。PAF组在术后1和3d可见少量标记的阳性细胞,并于术后5d达到高峰,术后7d仍可见较多阳性细胞表达,术后14d则仅有少量表达;凋亡指数与疼痛(r=0.9,P<0.01)呈正相关。
3 讨论

图3 对照组脊髓中有极少量阳性细胞表达(SABC法×400倍)
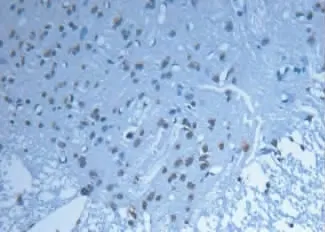
图4 PAF组凋亡阳性细胞显著增多,表现为胞核中棕褐色颗粒状物(SABC法×400倍)

表1 坐骨神经结扎后脊髓神经细胞凋亡指数(¯x±s,n=6,%)
疼痛在脊髓水平的调控和整合与脊髓神经元及其递质有关。许多研究表明,PAF可能参与痛觉信号的传导和调控。Hasegawa等[4]与Okubo等[5]的研究证实,脊髓和背根神经节的PAF及其受体参与外周神经损伤诱发的触觉痛敏。Tsuda等发现,PAF受体敲除小鼠生理状态下对热和机械刺激呈现正常反应,而对局部注射福尔马林和辣椒素以及内脏炎症诱发的慢性疼痛表现为疼痛反应减轻现象[6]。Morita等的研究报道表明,PAF鞘内注射可诱发小鼠触觉异常痛敏和热痛敏[7]。Marotta等的研究显示,皮下注射PAF诱发大鼠自发性疼痛和机械痛敏[8]。
PAF作为中枢神经介质,在病理状态下与多种原因的神经毒性有关。体外实验中谷氨酸处理的神经元PAF水平升高,PAF受体拮抗剂对谷氨酸神经毒性有保护效应,表明PAF参与谷氨酸神经毒性。Hostettler等的研究显示,PAF诱导培养的神经中枢星形胶质细胞和少突胶质细胞死亡[9]。Bate等的研究表明,纳摩尔浓度的PAF诱导神经元表型改变,进而激活小胶质细胞,激活的小胶质细胞随后杀死amyloid-beta1-42损伤的神经元,并且前列腺素D受体拮抗剂减轻PAF诱导的神经元死亡[10]。Li等的研究中PAF受体拮抗剂PMS777对amyloid-beta诱导的神经元凋亡和神经炎有保护作用,提示PAF在神经元凋亡和神经炎中的作用[11]。
本实验结果表明,鞘内注射PAF1d后脊髓神经元就有凋亡细胞出现,而后迅速上调,至5d达峰值,然后慢慢降低。本实验的行为学测定表明,大鼠鞘内注射PAF1d后就可诱发出机械性触诱发痛和热痛觉过敏,然后日趋加重,这与脊髓神经元凋亡的时间契合。术后7d大鼠脊髓凋亡神经元减少,但是机械性触诱发痛和热痛觉过敏仍加剧,故本研究认为大鼠脊髓神经元死亡增多,正常神经元数目减少,导致疼痛更重,即认为脊髓神经元的凋亡与机械性触诱发痛和热诱发的持续性疼痛有密切关系。
本研究结果表明鞘内注射PAF诱发大鼠痛敏,同时伴有脊髓神经元的凋亡,脊髓神经元的凋亡可能参与鞘内注射PAF诱发的大鼠触觉异常痛敏和热痛敏。PAF作为一种神经活性介质,可能通过以上机制参与脊髓水平疼痛的中枢调控。
1 Marotta DM,Costa R,Motta EM,et al. Mechanisms underlying the nociceptive responses induced by platelet-activating factor (PAF) in the rat paw. Biochem Pharmacol,2009,77(7):1223-1235.
2 Milligan ED,Hinde JL,Mehmert KK,et al. A method for increasing the viability of the external portion of lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods,1999,90(1): 81-86.
3 Hargreaves K,Dubner R,Brown F,et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain,1988,32(1):77-88.
4 Hasegawa S,Kohro Y,Shiratori M,et al. Role of PAF receptor in proinflammatory cytokine expression in the dorsal root ganglion and tactile allodynia in a rodent model of neuropathic pain. PLoS One, 2010,5(5):e10467.
5 Okubo M,Yamanaka H,Kobayashi K. Up-regulation of platelet-activating factor synthases and its receptor in spinal cord contribute to development of neuropathic pain following peripheral nerve injury. Mol Pain,2012,8:8.
6 Tsuda M,Ishii S,Masuda T,et al. Reduced pain behaviors and extracellular signal- related protein kinase activation in primary sensory neurons by peripheral tissue injury in mice lacking platelet-activating factor receptor. J Neurochem,2007,102(5):1658-1668.
7 Morita K,Kitayama T,Morioka N,et al. Glycinergic mediation of tactile allodynia induced by platelet-activating factor (PAF) through glutamate-NO-cyclic GMP signalling in spinal cord in mice. Pain,2008,138(3):525-536.
8 Marotta DM,Costa R,Motta EM,et al. Mechanisms underlying the nociceptive responses induced by platelet-activating factor (PAF) in the rat paw. Biochem Pharmacol,2009,77(7):1223-1235.
9 Hostettler ME,Carlson SL. PAF antagonist treatment reduces proinflammatory cytokine mRNA after spinal cord injury. Neuroreport,2002,13(1):21-24.
10 Bate C,Kempster S,Williams A. Platelet-activating factor antagonists protect amyloid-beta damaged neurons from microglia-mediated death.Europharmacology,2006,51(2):173-181.
11 Li J,Hu J,Shao B,et al. Protection of PMS777,a New AChE Inhibitor with PAF Antagonism,Against Amyloid-beta-Induced Neuronal Apoptosis and Neuroinflam-mation. Cell Mol Neurobiol,2009,9(4):589-55.

