钙蛋白酶在MPP+诱导的多巴胺能神经元损伤中的作用
张振涛 张国新 王洪财 熊 婧 胡 丹 张兆辉
帕金森病(Parkinsondisease,PD)是最常见的神经变性疾病之一,最典型的临床表现是静止性震颤、肌强直、运动迟缓、姿势步态障碍等运动症状,PD运动症状的病理基础是黑质致密部多巴胺能神经元变性缺失。但是迄今为止多巴胺能神经元损伤的确切机制尚未阐明[1]。有研究发现帕金森病发病过程中钙蛋白酶活性增强,但其在多巴胺能神经元损伤中的作用尚不明确[2]。本研究利用MPP+诱导的PC12细胞凋亡为模型,观察了钙蛋白酶在帕金森病发病中的作用。
1 材料与方法
1.1 主要仪器及试剂
钙蛋白酶抗体和MDL28170购自Calbiochem公司,MTT和神经生长因子购自Sigma公司,ALLN购自SantaCruz公司,钙蛋白酶活性检测试剂盒购自Abcam公司,其余试剂为国产分析纯。大鼠嗜铬细胞瘤细胞系(PC12细胞)由武汉大学典型培养物储藏中心提供。
1.2 PC12细胞培养及诱导分化
PC12细胞置于DMEM培养基中,内含10%(体积分数)热灭活小牛血清、青霉素100U/ml、链霉素100U/ml,于5%(体积分数)CO2,37℃培养箱内进行培养,隔天换液;药物处理前l周用NGF(终浓度为0.1μg/ml)诱导PCI2细胞神经元样分化。
1.3 MTT法检测细胞活力
调节细胞密度约2×105/ml,以100μl/孔接种于96孔板,分别加入75mmol/L的MPP+处理2、4、8和12h,每种处理设立6个复孔,每孔加5mg/ml MTT10μl,继续培养4h;弃培养基,每孔加二甲基亚砜100μl,37℃孵育20min,至颗粒溶解,在酶标仪上测定570nm的吸光度值,将其作为反映PC12细胞活性和代谢状况的参数。细胞存活率=试验组吸光度值/对照组吸光度值×100%。
1.4 流式细胞术检测细胞凋亡
PC12细胞经MPP+处理后24h收获细胞,以4℃预冷的PBS洗细胞2次,制成单细胞悬液。调整细胞密度为5×105/ml,取100μl细胞悬液 加入5μlAnnexin-FITC和10μl20pg/mlPI溶液,混匀后室温避光孵育15min,加入400μlPBS,流式细胞仪进行荧光强度分析与早期凋亡细胞检测。
1.5 免疫印迹法
PC12细胞经处理后收集细胞,加细胞裂解液后在冰上裂解,1300r/mm离心10min,取上清液,测定蛋白浓度后聚丙烯酰胺凝胶电泳,电转至硝酸纤维素膜上,然后用钙蛋白酶抗体4℃孵育过夜,二抗孵育后显色、曝光。
1.6 钙蛋白酶活性检测
根据钙蛋白酶活性检测试剂盒说明书,细胞处理后使用裂解液裂解细胞,离心取上清液,蛋白定量后取100μg蛋白,加入10μl10×反应缓冲液和5 μl钙蛋白酶底物,37℃避光反应1h,然后使用400 nm激发波长、505nm发射波长检测荧光强度。
1.7 统计学处理
各组数据均用¯x±s表示,采用SPSS软件,采用单因素方差分析(ANOVA)中的SNK-q检验。P<0.05为有显著性差异。
2 结果
2.1 MPP+对钙蛋白酶表达水平的影响
在MPP+处理不同时间点收集细胞,免疫印迹发现,神经元样分化的PC12细胞经75mmol/L MPP+处理后总钙蛋白酶水平无明显变化,但活化的钙蛋白酶水平显著增高。活化的钙蛋白酶水平在MPP+处理后时间依赖性增高,12h后达到对照组的3.22倍(图1)。

图1 MPP+对钙蛋白酶表达水平的影响 A为免疫印迹;B为灰度值变化;与对照组比较,*P<0.05
2.2 MPP+、ALLN和MDL28170对钙蛋白酶活性的影响
MPP+处理后蛋白酶活性呈时间依赖性增高,并一直持续到12h。钙蛋白酶抑制剂ALLN(50 μmol/L)和MDL28170(10μmol/L)能够显著抑制MPP+诱导的钙蛋白酶活化(图2)。

图2 MPP+对钙蛋白酶活性的影响 与对照组比较,*P<0.05;与MPP+12h组比较,#P<0.05
2.3 钙蛋白酶抑制剂对细胞活力的影响
75mmom/LMPP+处理12h后细胞活力降至对照组的57.25%,钙蛋白酶抑制剂ALLN(50μmol/L)处理组细胞活力升高到对照组的79.25%,而MDL28170(10μmol/L)处理组细胞活力也升高到对照组的73.5%(P<0.05)(图3)。
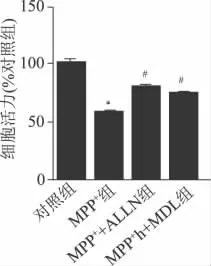
图3 钙蛋白酶抑制剂对细胞活力的影响 与对照组比较,*P<0.05;与MPP+组比较,#P<0.05
2.4 钙蛋白酶抑制剂对细胞凋亡的影响75 mmom/LMPP+处理12h后细胞凋亡率升高22.3%,显著高于对照组(P<0.05),而钙蛋白酶抑制剂ALLN(50μmol/L)和MDL28170(10μmol/L)均显著降低MPP+诱导的细胞损伤(P<0.05)(图4)。

图4 钙蛋白酶抑制剂对细胞凋亡的影响 与对照组比较,*P<0.05;与MPP+组比较,#P<0.05
3 讨论
迄今为止,帕金森病多巴胺能神经元损伤的确切机制尚未阐明,也没有针对发病机制的治疗方法。因此寻找参与多巴胺能神经元损伤的关键分子是目前帕金森病发病机制研究的热点和难点问题。既往研究发现,遗传和环境因素会导致一系列病理生理变化,如氧化应激、线粒体功能障碍、蛋白异常折叠等,但这些因素如何进一步导致多巴胺能神经元损伤并不明确[3]。本研究使用MPP+诱导的PC12细胞凋亡为模型,观察了钙蛋白酶在多巴胺能神经元损伤中的作用。
MPP+是MPTP的活性代谢产物,MPTP可诱导人类和灵长类动物出现类似帕金森病的临床表现。MPTP在体内被代谢为MPP+,MPP+通过神经元表面的多巴胺转运体进入细胞后损伤线粒体复合物Ⅰ的功能,导致多巴胺能神经元损伤[4]。PC12细胞来源于大鼠肾上腺嗜铬细胞瘤细胞,经神经生长因子诱导后具备某些神经元的特性,如停止分裂、生长出神经元样突起等[5],因此常用其制作帕金森病细胞模型[6,7]。本研究使用MPP+处理神经元样分化的PC12细胞,发现处理后细胞活力显著下降,因此我们使用该模型作为帕金森病神经元损伤的体外模型,探寻导致神经元损伤的关键分子机制。
钙蛋白酶是身体各组织广泛存在的一种蛋白酶,既往研究发现它参与体内一系列重要的生理和病理过程,其发挥活性需要钙离子的参与[8,9]。目前为止并未发现钙蛋白酶对其底物蛋白的切割需要特定的氨基酸序列,也未明确其识别底物的方式。既往研究发现,钙蛋白酶切割一系列底物蛋白,如tau蛋白、TDP-43蛋白等,参与阿尔茨海默病和肌萎缩侧索硬化的发病过程[10~12],但其在帕金森病中的作用并不明确。本研究发现MPP+处理4h后PC12细胞内钙蛋白酶蛋白表达水平开始增高,到12h蛋白水平升高到对照组的3.7倍。钙蛋白酶由催化亚基与调节亚基构成。除了细胞内的钙离子水平外,钙蛋白酶活性还受到细胞内固有的钙蛋白酶抑制剂的调控[13]。
为了明确钙蛋白酶蛋白水平增高是否会导致其活性增高,我们直接使用钙蛋白酶的荧光底物检测了钙蛋白酶的活性水平,发现MPP+处理后钙蛋白酶活性呈时间依赖性增高。
为了明确钙蛋白酶活性增高是神经元损伤的原因还是其结果,我们使用两种不同的钙蛋白酶抑制剂ALLN和MDL28170处理PC12细胞,发现两者均能有效抑制钙蛋白酶活性,同时ALLN和MDL281780都能够明显抑制MPP+诱导的PC12细胞损伤,提示钙蛋白酶活性增高在多巴胺能神经元损伤中发挥关键作用,而不是神经元损伤的后续结果,阻断钙蛋白酶通路可能具有神经保护作用。
鉴于钙蛋白酶底物众多,目前尚不明确它通过切割那些底物参与多巴胺能神经元损伤,但有研究发现α-突触核蛋白是钙蛋白酶的底物[14]。α-突触核蛋白是帕金森病患者路易体的主要成分,经钙蛋白酶切割后α-突触核蛋白片段更容易形成聚集体[15],因此本研究推测钙蛋白酶可能是通过切割α-突触核蛋白发挥神经损伤作用的。另外,钙蛋白酶还可以切割tau蛋白,而tau蛋白可与α-突触核蛋白相互作用,促进包涵体的产生[16]。钙蛋白酶还作用于突触相关蛋白,影响神经元功能[17]。有研究发现,在α-突触核蛋白转基因小鼠中过表达钙蛋白酶特异性抑制剂能够抑制α-突触核蛋白聚集,保护突触功能,减轻胶质细胞活性[18]。在肌萎缩侧索硬化模型小鼠中抑制蛋白酶功能也能够改善小鼠的病理学改变[12]。结合本研究的发现,我们认为钙蛋白酶在帕金森病的发病中可能起到重要的作用,并有可能成为帕金森病的治疗靶点。由于钙蛋白酶有其生理作用,广泛抑制钙蛋白酶可能会产生全身副作用,但如果能够明确帕金森病多巴胺能神经元损伤过程中钙蛋白酶的主要底物,就可以采取某些策略选择性抑制钙蛋白酶对其底物的病理性切割,这对帕金森病的治疗可能具有重要的意义。
1 Lee BI,Heo K. Movement disorders:new insights into disease mechanisms and treatment. Lancet Neurol,2014,13(1):9-11.
2 Samantaray S,Ray SK,Banik NL. Calpain as a Potential Therapeutic Target in Parkinsons Disease. CNS & Neurological Disorders-Drug Targets,2008,7(3):305-312.
3 Onyango IG. Mitochondrial dysfunction and oxidative stress in Parkinson' s disease. Neurochem Res,2008,33(3):589-597.
4 Adlard P,Finkelstein D,Doble P,et al. Metallobiology of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine neurotoxicity. Metallomics,3,5(2):91-109.
5 Zhang YW,Chen Y,Liu Y,et al. APP regulates NGF receptor trafficking and NGF-mediated neuronal differentiation and survival. PLos One,2013,8(11):e80571.
6 Sun X,Liu J,Crary JF,et al. ATF4 protects against neuronal death in cellular Parkinson's disease models by maintaining levels of parkin. J Neurosci,2013,33(6):2398-2407.
7 Liu HM,Yang SZ,Sun FY. 1-Methyl-4-phenyl-phridinium time-dependently alters expressions of oxoguanine glycosylase 1 and xeroderma pigmentosum group F protein in PC12 cells. Neurosci Bull,2010,26(1):1-7.
8 Ono Y,Sorimachi H. Calpains-An elaborate proteolytic system. Biochim Biophys Acta,2012,1824(1):224-236.
9 Storr SJ,Carragher NO,Frame MC,et al. The calpain system and cancer. Nat Rev Cancer,2011,11(5):364-374.
10 Yamashima T. Reconsider Alzheimer's disease by the calpain cathepsin hypothesis '-A perspective review. Prog Neurobiol,2013 ,105 :1-23.
11 Garg S,Timm T,Mandelkow E-M,et al. Cleavage of Tau by calpain in Alzheimer's disease:the quest for the toxic 17 kD fragment. Neurobiol Aging,2011,32(1):1-14.
12 Yamashita T,Hideyama T,Hachiga K,et al. A role for calpain-dependent cleavage of TDP-43 in amyotrophic lateral sclerosis pathology.Nature communications,2012,3:1307.
13 Torr SJ,Carragher NO,Frame MC,et al. The calpain system and cancer. Nat Rev Cancer,2011,11(5):364-374.
14 Dufty BM,Warner LR,Hou ST,et al. Calpain-cleavage of α-synuclein: connecting proteolytic processing to disease-linked aggregation. Am J Pathol,2007,170(5):1725-1738.
15 Steiner J,Angot E,Brundin P. A deadly spread: cellular mechanisms of α-synuclein transfer. Cell Death Differ,2011 ,18 ( 9 ) :1425-1433.
16 Guo JL,Covell DJ,Daniels JP,et al. Distinct α-synuclein strains differentially promote tau inclusions in neurons. Cell,2013,154 ( 1 ):103-117.
17 Baudry M,Chou MM,Bi X. Targeting calpain in synaptic plasticity.Expert Opin Ther Targets,2013,17(5):579-592.
18 Iepenbroek M,Casadei N,Esmer H,et al. Overexpression of the calpain-specific inhibitor calpastatin reduces human alpha-Synuclein processing,aggregation and synaptic impairment in [A30P] α Syn transgenic mice. Hum Mol Genet,2014,23(15):3975-3989.

