IQ基序突变对AtIQM1的钙调素结合活性的影响
黄章科 张艺能 莫忠蓁 周玉萍 黄小玲 田长恩
(广州大学生命科学学院 植物抗逆基因功能研究广州市重点实验室,广州 510006)
IQ基序突变对AtIQM1的钙调素结合活性的影响
黄章科 张艺能 莫忠蓁 周玉萍 黄小玲 田长恩
(广州大学生命科学学院 植物抗逆基因功能研究广州市重点实验室,广州 510006)
旨在确定IQ基序中关键氨基酸残基突变对IQM1的CaM结合活性的影响,利用基因体外定点突变技术将LQ缺失或将L突变成S,并通过酵母双杂交分析突变蛋白iqm1的CaM结合活性。结果显示,用重组质粒pGADT7-IQM1CDS、pGADT7-IQM1Del113-114、pGADT7-IQM1L113S或pGBKT7-CaM5分别转化酵母AH109,未出现自激活现象;用pGADT7-IQM1CDS和 pGBKT7-CaM5共转化酵母能在选择性培养基(SD/-Ade/-His/-Leu/-Trp/X-α-Gal)上形成蓝色菌落;而用pGADT7-IQM1Del113-114和pGBKT7-CaM5或pGADT7-IQM1L113S和pGBKT7-CaM5共转化酵母则不能在选择性培养基(SD/-Ade/-His/-Leu/-Trp)上形成菌落。结果表明,IQ基序中LQ或者L是IQM1与CaM5结合的关键氨基酸残基。
AtIQM1 IQ基序突变 酵母双杂交 CaM结合
植物的生命过程受体内外各种信号的调控。Ca2+是细胞内1个非常重要的第二信使,它可以调控多种生理反应。钙调素(calmodulin,CaM)作为细胞内Ca2+受体,绝大多数无酶活性,也无转录因子活性,更不是结构蛋白,只有通过其下游的钙调素结合蛋白(calmodulin-binding protein,CaMBP)来调节细胞的生理功能[1-4]。CaMBP与CaM的结合可分为Ca2+依赖、不依赖和抑制3种类型[3],IQ基序是第一个被发现的Ca2+不依赖性CaM结合结构域(calmodulin-binding domain,CaMBD),其氨基酸序列为IQXXXRGXXXR,其中的I可变为L、V或M,第6位和11位的R可变为K或H,第7位的G同样缺乏保守性,因此,IQ基序的完整序列可概括为[I,L,V]QXXXRXXXX[R,K][5]。但是,个别含IQ基序的蛋白质与CaM的结合也依赖Ca2+[6,7]。在植物中已经发现了5个含有IQ基序的蛋白质家
族[8]:myosin家族[9-11]、CAMTA家族[12,13]、CNGC家族[14,15]、IQD家族[6,16,17]和 IQM 家族[18-20],分别由17个、6个、20个、33个和6个成员组成。IQM家族成员的N-端与豌豆重金属诱导蛋白6A(该蛋白的编码基因受重金属诱导而表达,但其功能未知)、C-端与天花粉素(一类使核糖体失活、具有RNA结合活性的小分子蛋白)具有较高的同源性[18]。IQM1(IQ motif containing 1)是IQM家族的1个成员,由At4g33050编码,只含1个IQ基序,通过酵母双杂交和双分子荧光互补试验证明IQM1在体内、外都能与CaM结合,并通过蛋白截短试验证明IQ基序是其钙调素结合所必需的结构域[20]。为了确证IQM1介导的CaM信号参与植物细胞生理或生长发育的调控,需要构建IQ基序中关键氨基酸残基突变的突变互补载体,转入IQM1基因的突变体中,观察突变表型的恢复情况。若突变表型不能恢复,则说明通过IQ基序与CaM的结合,即IQM1介导的CaM信号参与了相关调控;否则相反。当然,在构建植物表达载体前,需要先证实IQ基序中关键氨基酸残基点突变或缺失后iqm1的CaM结合活性。为此,本研究利用基因体外定点突变技术将IQM1的IQ基序中的关键氨基酸残基LQ缺失或者将L突变成S,然后利用酵母双杂交分析突变蛋白iqm1与CaM的结合活性,旨在确定IQ基序中关键氨基酸残基突变对IQM1的CaM结合活性的影响。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)为Columbia(Col)生态型、大肠杆菌菌株为DH5α、重组质粒pUC19-P35S:eGFP:IQM1、pUC19-P35S:eGFP:CaM5为实验室构建,酵母双杂交系统(Matchmaker Gal4 Two-Hybrid System3)由中国科学院华南植物园张明永教授友好转赠,Pfu DNA Polymerase购自Fermentas公司,Carrier DNA购自Sigma公司,pMD18-T Simple、胶回收试剂盒、限制性内切酶、Ex Taq DNA 聚合酶及PCR相关试剂均为TaKaRa公司产品。
1.2 方法
1.2.1 IQM1基因的CDS全长序列获取 以pUC19-P35S:eGFP:IQM1为模板,利用IQM1基因引物(F1:5'-TACCCGGGTATGGGTCTTGAAGTTGGGTC-3',下划线部分为Sma I酶切位点;R1:5'-CCATCGATTT AACACTTTACAGCCCTAGGGC-3',下划线部分为Cla I酶切位点)进行PCR扩增,反应程序为:94℃预变性4 min;94℃变性30 s,64℃退火30 s,72℃延伸90 s,共35个循环;72℃再延伸5 min。反应结束后电泳,并用凝胶成像系统观察、拍照。
1.2.2 pGADT7-IQM1CDS猎物载体的构建 切取目的片段所在的凝胶,用胶回收试剂盒回收IQM1 CDS。将回收产物与 pMD18-T连接,转化E.coli DH5α,挑取氨苄青霉素抗性菌落,进行PCR 鉴定。取阳性克隆摇菌,提取质粒并用Sma I和Cla I进行双酶切鉴定后送华大基因公司测序。然后,将经测序证实的pMD18-IQM1CDS和pGADT7用Sma I和Cla I双酶切,电泳后割胶回收目的片段并连接,转化E.coli DH5α,进行菌落PCR鉴定,并进一步提取质粒进行酶切鉴定,得到用于酵母双杂交的猎物载体pGADT7-IQM1CDS。
1.2.3 IQ基序中LQ缺失和L突变成S的PCR扩增及其猎物载体的构建 用Pfu DNA Polymerase,以测序证实过的pMD18-IQM1CDS为模板,分别用LQ缺失 引物(F2:5'-GATGCAGCTGCAACTACGAAGGTGTACAAGAGTTAC-3',Leu113和Gln114缺失;R2:5'-GTAACTCTTGTACACCTTCGTAGTTGCAGCTGCATC-3',Leu113和Gln114缺失)和点突变引物(F3:5'-TTGATGCAGCTGCAACTACGTCACAAAAGGTGTACAAG-3',Leu113突变成Ser;R3:5'-CTTGTACACCTTTTGTGACGTAGTTGCAGCTGCATCAA-3',Leu113突变成Ser)进行PCR扩增,程序为:95℃ 2 min;95℃ 30 s,62℃/65℃ 30 s,72℃ 4 min,18个循环;72℃延伸5 min。扩增完成后用Dpn I消化有甲基化修饰的模板,体外扩增产物因无甲基化修饰而不被消化。模板消化后灭活Dpn I,转化E.coli DH5α,经菌落PCR鉴定后摇菌提取质粒并经酶切鉴定后送华大基因公司测序。然后用Sma I和Cla I对测序验证过的缺失突变质粒pMD18-IQM1Del113-114、点突变质粒pMD18-IQM1L113S及质粒pGADT7,进行双酶切,割胶回收目的片段并连接转化,经菌落PCR和质粒酶切鉴定,得到酵母双杂交猎物载体pGADT7-
IQM1Del113-114和pGADT7-IQM1L113S。
1.2.4 CaM5的 PCR 扩增及其诱饵载体的构建 以pUC19-P35S:eGFP:CaM5为模板,用加有酶切位点的CaM5基因引物(5'-TTGAATTCATGGCAGATCAGCTCACCGATGATC-3',下划线部分为EcoR I酶切位点;5'-TGGTCGACTCACTTTGCCATCATAACTTTGAC-3',下划线部分为Sal I酶切位点)进行PCR扩增,程序为:94℃ 4 min;94℃ 30 s,61℃ 30 s,72℃ 30 s,共35个循环;72℃延伸 5 min。此后的载体构建方法同1.2.2。用卡那霉素进行筛选,EcoR I和Sal I双酶切鉴定,得到酵母双杂交诱饵载体pGBKT7-CaM5。
1.2.5 酵母感受态制备和转化 参考 Clontech 公司Matchmaker Gal4 Two-Hybrid System3的操作方法制备AH109感受态细胞,取150 μL分装于1.5 mL离心管,加入10 mg/mL 单链Carrier DNA 5 μL和各种质粒(图3),混匀,再加入600 μL PEG/LiAc溶液(现配现用),涡旋混匀,于30℃、220 r/min培养30 min,加入70 μL DMSO,颠倒混匀,42℃水浴热激15 min(每5 min轻混1次),冰上放置2 min后,室温、12 000 r/min离心5 s,弃上清,用400 μL TE重悬细胞,涂布于SD/-Leu/-Trp培养基上,30℃培养3-5 d至菌落形成。
1.2.6 酵母双杂交分析 从上述的SD/-Leu/-Trp培养基上挑取阳性克隆,涂于SD/-Ade/-His/-Leu/-Trp培养基上,30℃培养3-5 d,观察菌落形成情况;再将其上长出的菌落转涂于SD/-Ade/-His/-Leu/-Trp/X-α-Gal培养基上,30℃培养3-5 d,观察菌落颜色变化情况。
2 结果
2.1 相关载体的构建与鉴定
IQM1基因由AT4G33050编码,本试验所用的CDS为AT4G33050.3,全长1 467 bp,其中IQ基序位于第二个外显子末端(图1)。尽管已通过Invitrogen的酵母双杂交系统证实,IQM1能与CaM结合[20],但因本研究采用Clontech的酵母双杂交系统,所以必须在IQM1的CDS的上下游分别加入合适的酶切位点。用分别添加Sma I和Cla I酶切位点的引物F1+R1,对pUC19-P35S:eGFP: IQM1进行PCR扩增,以克隆IQM1 CDS,并将其构建到pMD18-T,经过鉴定,IQM1 CDS未发生突变(图2-A)。然后根据QuikChange®XL Site-Directed Mutagenesis Kit(Stratagene)的说明,将IQ基序中的关键氨基酸残基进行突变,构建到pMD18-T中,测序结果显示,点突变的IQM1的第338位碱基T突变成C,即第113位L(TTA)突变为S(TCA)(图2-B);缺失突变的IQM1的第337-342位碱基(TTACAA)缺失,即第113、114位氨基酸(L、Q)缺失(图2-C)。其它部分均不存在突变。最后把构建的pMD18-IQM1CDS、pMD18-IQM1Del113-114和pMD18-IQM1L113S通过Sma I和Cla I特异位点定向克隆到pGADT7,构建成pGADT7-IQM1CDS、pGADT7-IQM1Del113-114和 pGADT7-IQM1L113S,并经Sma I和Cla I双酶切鉴定。同时,先将PCR扩增的CaM5 CDS克隆到pMD18-T,测序证实后再通过EcoR I和Sal I定向插入pGBKT7,得到pGBKT7-CaM5,并经EcoR I和Sal I双酶切鉴定。
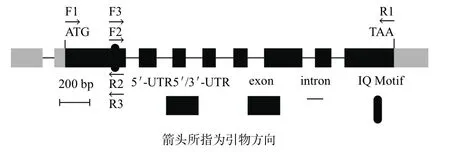
图1 IQM1基因的结构及扩增引物示意图

图2 IQ基序中关键氨基酸残基点突变或缺失
2.2 关键氨基酸突变对相互作用的影响分析
分别用图3所示的1-9号质粒组合共转化酵母AH109,涂布于培养基SD/-Trp/-Lue,30℃培养4 d,长出菌落(图3-A),说明质粒共转化成功。将所得转化子分别转涂于SD/-Trp/-Leu/-His/-Ade培养基培养,只有1号(阳性对照)和2号(IQM1×CaM5)组合的转化子长出菌落,其他组合的转化子均没有生长(图3-B);进而将1号、2号菌落转移到SD/-Trp/-Leu/-His/-Ade/X-α-Gal培养基培养,二者均能生长且显蓝色(图3-C)。以上结果说明,IQM1 和CaM5能在酵母细胞内结合,使转录因子GAL4的功能恢复,激活报告基因表达;而3号、4号组合的转化子不能在SD/-Trp/-Leu/-His/-Ade培养基上生长,说明IQ基序中LQ缺失或L突变成S后的突变蛋白iqm1不能与CaM5结合,从而证实了IQ基序的LQ或L是IQM1与CaM5结合的关键氨基酸残基,且L更为重要。

图3 酵母双杂交分析
3 讨论
CaM作为细胞的Ca2+受体,在Ca2+/CaM信号转导中需通过其靶标——CaMBP发挥作用。当前,研究蛋白质之间相互作用的技术方法主要有酵母双杂交、免疫共沉淀、pull-down、双分子荧光互补以及串联亲和纯化等方法[21]。Fields 和Song[22]首先发明酵母双杂交技术,由最初研究蛋白间的相互作用扩展到研究蛋白和DNA、RNA及其他小分子配体间的相互作用,现已衍生出许多试验系统[23]。IQM1与CaM的结合活性已被本研究组先后利用Invitrogen[20]和Clontech的酵母双杂交系统所证实。并通过蛋白截短试验证明IQ基序是其CaM结合所必需的结构域[20];通过基因体外定点突变技术将其中的LQ缺失或L突变为S后所获得的突变蛋白iqm1都不能与CaM结合。这说明IQ 基序是IQM1和CaM结合的关键结构域,其中的LQ尤其是L是决定结合活性的关键氨基酸残基。本研究结果为构建IQ基序中关键氨基酸残基点突变或缺失的突变互补载体,转入iqm1突变体,观察突变体表型恢复情况,以确证IQM1介导的CaM信号是否参与有关的生理或生长发育调控提供了支撑。相关思路可资其它CaMBP的功能研究者借鉴。
4 结论
利用酵母双杂交系统分析了IQ基序中LQ缺失和L突变成S对于IQM1与CaM5结合活性的影响,试验结果说明了无论是LQ缺失或L突变成S后,突变蛋白IQM1都不能与CaM5相互结合,从而确定了IQ基序的LQ或L是IQM1与CaM5结合的关键氨基酸残基。
[1]McAinsh RM, Pittman JK. Shaping the calcium signature[J]. New Phytologist, 2009, 181(2):275-294.
[2]毛国红, 宋林霞, 孙大业.植物钙调素结合蛋白研究进展[J].植物生理与分子生物学报, 2004, 30(5):481-488.
[3]O’Day DH. CaMBOT:profiling and characterizing calmodulinbinding protein[J]. Cellular Signalling, 2003, 15(4):347-354.
[4]Sanders D, Pelloux J, Brownlee C, et al. Calcium at the crossroads of signaling[J]. Plant Cell, 2002, 14(Suppl.):S401-S417.
[5]Bähler M, Rhoads A. Calmodulin signaling via the IQ motif[J]. FEBS Letters, 2002, 513(1):107-113.
[6]Abel S, Savchenko T, Levy M. Genome-wide comparative analysis of the IQD gene families in Arabbidopsis thaliana and Oryza sativa[J]. BMC Evol Biol, 2005, 5:72-89.
[7]韦慧彦, 郭振清, 崔素娟.钙不依赖性钙调素结合蛋白的研究进展[J].生物化学与生物物理进展, 2007, 34(2):124-131.
[8]田长恩, 周玉萍.植物具IQ基序的钙调素结合蛋白的研究进展[J].植物学报, 2013, 48(4):447-480.
[9]Reddy AS, Day IS. Analysis of the myosins encoded in the recently
completed Arabidopsis thaliana genome sequence[J]. Genome Biol, 2001, 2(7):research0024.1-research0024.17.
[10]Holweg C, Nick P. Arabidopsis myosin XI mutant is defective inorganelle movement and polar auxin transport[J]. Proc Natl Acad Sci USA, 2004, 101:10488-10493.
[11]Ojangu EL, Järve K, Paves H, et al. Arabidopsis thaliana myosin XIK is involved in root hair as well as trichome morphogenesis on stems and leaves[J]. Protoplasma, 2007, 230(3-4):193-202.
[12]Bouché N, Scharlat A, Snedden W, et al. A novel family of calmodulin-binding transcription activators in multicellular organisms[J]. J Biol Chem, 2002, 277(24):21851-21861.
[13]Bouché N, Yellin A, Snedden WA, et al. Plant-specific calmodulinbinding proteins[J]. Annu Rev Plant Biol, 2005, 56:435-466.
[14]Köhler C, Merkle T, Neuhaus G. Characterisation of a novel gene family of putative cyclic nucleotide and calmodulin-regulated ion channels in Arabidopsis thaliana[J]. Plant J, 1999, 18(1):97-104.
[15]Talke IN, Blaudez D, Maathuis FJ, et al. CNGCs:prime targets of plant cyclic nucleotide signaling?[J]. Trends Plant Sci, 2003, 8(6):286-293.
[16]Levy M, Wang Q, Kaspi R, et al. Arabidopsis IQD1, a novel calmodulin-binding nuclear protein, stimulates glucosinolate accumulation and plant defense[J]. Plant J, 2005, 43(1):79-96.
[17]韦慧彦, 郭振清, 崔素娟.拟南芥钙调素结合蛋白AtIQD26的分离鉴定[J].生物化学与生物物理进展, 2008, 35(6):703-711.
[18]Zhou Y, Fujibe T, Wang XL, et al. Initial characterization of Arabidopsis T-DNA insertion mutants of the iqm1 gene that encodes an IQ motif-containing protein[J]. Plant Cell Physiol, 2007, 48(Suppl.):s197.
[19]Zhou YP, Chen YZ, Duan J, et al. Sequence and expression analysis of the Arabidopsis IQM family[J]. Acta Physiol Plant, 2010, 32(1):191-198.
[20]Zhou YP, Duan J, Yamamoto KT, et al. AtIQM1, a novel calmodulin-binding protein, is involved in stomatal movement in Arabidopsis[J]. Plant Mol Biol, 2012, 79(4-5):333-346.
[21]陈谋通, 刘建军.蛋白相互作用的研究方法[J].生物技术通报, 2009(1):50-68.
[22]Fields S, Song O. A novel genetic system to detect protein- protein interactions[J]. Nature, 1989, 340(6230):245-246.
[23]黄欣媛, 范红波.酵母双杂交及其衍生系统[J].生物技术通报, 2014(1):75-82.
(责任编辑 马鑫)
Effects of Mutations in IQ Motif of AtIQM1 on Its Calmodulin Binding
Huang Zhangke Zhang Yi’neng Mo Zhongzhen Zhou Yuping Huang Xiaoling Tian Chang’en
(Guangzhou Key Laboratory for Functional Study on Stress-Resistant Genes in Plants,School of Life Sciences,Guangzhou University,Guangzhou 510006)
To confirm the effects of mutation of key amino acid residues in IQ motif of AtIQM1 on its calmodulin binding, the LQ was deleted or L was mutated to S through the mutagenesis technology in vitro. Then calmodulin binding of the mutant protein iqm1 was analyzed via yeast two-hybrid assay. The self-activation was not observed when the recombinant plasmid pGADT7-IQM1CDS, pGADT7-IQM1Del113-114, pGBKT7-CaM5 or pGADT7-IQM1L113Swas transformed into the yeast AH109 strain, respectively. Blue colonies were achieved on the selective agar plates(SD/-Ade/-His/-Leu/-Trp/X-α-Gal)when pGADT7-IQM1CDSand pGBKT7-CaM5 were co-transformed into AH109 yeast strain. However, the yeasts which were co-transformed with pGADT7-IQM1Del113-114and pGBKT7-CaM5 or pGADT7-IQM1L113Sand pGBKT7-CaM5 were not able to grow on the selective medium(SD/-Ade/-His/-Leu/-Trp). The results suggest that the LQ or L in IQ motif is required for AtIQM1 to combine with CaM5.
AtIQM1 Mutantion in IQ motif Yeast two hybrid Calmodulin binding
10.13560/j.cnki.biotech.bull.1985.2014.12.021
2014-05-26
国家自然科学基金项目(31170204),羊城学者科研项目(12A001G)
黄章科,男,硕士研究生,研究方向:植物分子遗传学;E-mail:huang.zhangke@163.com
田长恩,男,博士,教授,研究方向:植物分子遗传学;E-mail:changentian@aliyun.com

