闪式提取辣椒渣黄酮及总酚的工艺研究
, ,*, , ,聂登,
(1.贵州大学化学与化工学院,贵州贵阳 550000;2.贵州省建材产品质量监督检验院,贵州贵阳 550002;3.贵州省冶金化工研究所,贵州贵阳 550002)
从植物中提取的天然黄酮及总酚类化合物安全无毒,且具有较强的自由基清除能力,能帮助人类防治衰老、癌症、动脉粥样硬化等疾病,现已获得医药食品界越来越多的青睐[1]。
辣椒渣为干红辣椒经色素和辣椒碱类物质提取后的残余物,其中含有大量黄酮及总酚类化合物,具有较高的经济价值,目前已有一些研究对辣椒渣中该类成分进行了分离提取,并验证了其生理活性[2-5]。闪式提取是根据组织破碎原理设计而成的一种新型辅助提取技术[6],其高速转动的刀头可产生机械剪切力、涡流负压及相当于超声波1/60的振动力,能够迅速实现植物组织的破碎和有效成分的溶出,具有短时高效、条件温和及操作简便等优点[7],现已广泛地应用于天然有效成分的提取,如三七芦头皂苷、黄芪多糖、甘草叶黄酮及茶叶儿茶素等[8-12]。本实验首次采用闪式提取技术从辣椒渣中提取黄酮及总酚类化合物,以正交实验优化得出最佳工艺条件,并采用HPLC法对提取物进行了分析。
1 材料与方法
1.1 材料与仪器
辣椒渣 干红辣椒以闪式提取技术提尽色素和辣椒碱类物质后的残余物;石油醚、甲醇、乙醇、丙酮及乙酸乙酯 分析纯,国药集团化学试剂有限公司;槲皮素标品、咖啡酸标品 贵州迪大生物科技有限责任公司。
闪式提取控制器JHBE-20A 河南金鼐科技发展有限公司;旋转蒸发仪RE-3000 上海亚荣生化仪器厂;722紫外可见分光光度计 上海佑科仪器仪表有限公司;高效液相色谱仪L3000 北京普源精电科技有限公司。
1.2 实验方法
1.2.1 黄酮及总酚的闪式提取工艺流程 辣椒渣→脱脂→干燥→过筛(40目)→按料液比1∶15加入有机溶剂→闪式提取→减压回收溶剂→黄酮及总酚提取物
1.2.2 最佳提取工艺参数的确定 在单因素实验中,依次改变闪提过程的提取溶剂、甲醇浓度、闪提转速和闪提时间,以黄酮及总酚的得率作为考察指标进行分析研究。并选取甲醇浓度,闪提转速和闪提时间三个因素为研究对象。采用L9(34)正交实验,以综合评分法优化辣椒残渣中黄酮及总酚的提取工艺条件。实验设计见表1。
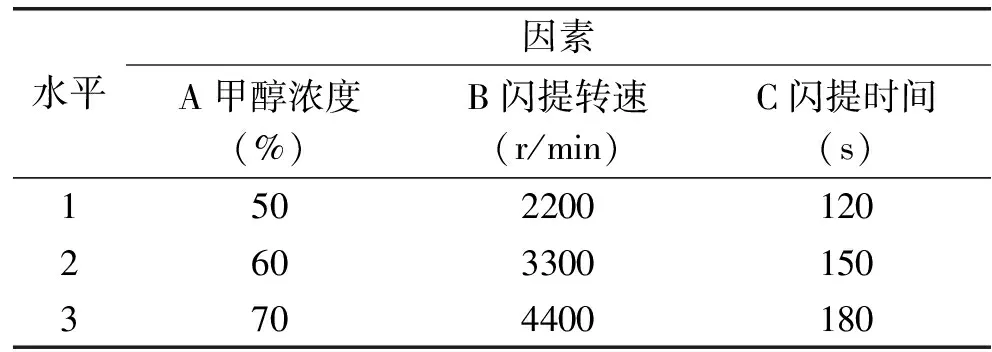
表1 正交实验因素水平表Table 1 Factors and Levels of orthogonal experiment
1.2.3 黄酮及总酚得率的测定 采用分光光度法测定目标物质含量,其中黄酮得率:以芦丁当量(Rutin Equivalent,RE/g)表示,采用AlCl3-HAC-NaAC比色法测定[13-14];总酚得率:以没食子酸当量(Gallic Acid Equivalent,GAE/g)表示,采用Folin-Cioealteu比色法测定[15]。
1.2.4 辣椒渣甲醇提取物的HPLC分析 以甲醇为溶剂在闪提转速4400r/min,闪提时间150s下对辣椒渣进行提取,得到的提取物按0.002g/mL的比例稀释于甲醇中,过0.45μm的微孔,4℃下冷藏备用。色谱条件:Agilent TC-C18(250mm×4.6mm,5μm);流动相A-乙腈,流动相B-0.1%磷酸水溶液;流速1.0mL/min;梯度洗脱条件:0~20min,流动相A 10%~15%,20~30min,流动相A 15%~25%,30~42min,流动相A 25%~40%,42~45min,流动相A 40%~10%;检测波长327nm;进样量20μL;柱温30℃。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 提取溶剂对黄酮及总酚得率的影响 闪提过程中控制闪提转速3300r/min,闪提时间180s,设置不同的提取溶剂。提取溶剂对黄酮及总酚的得率影响见表2。由表2知,黄酮及总酚的得率均随提取溶剂的极性增大而增大,当以甲醇为溶剂时,二者得率均达到最大值,说明辣椒渣中黄酮及总酚类物质的极性较大。因此,本实验条件下,最适宜的提取溶剂为甲醇。
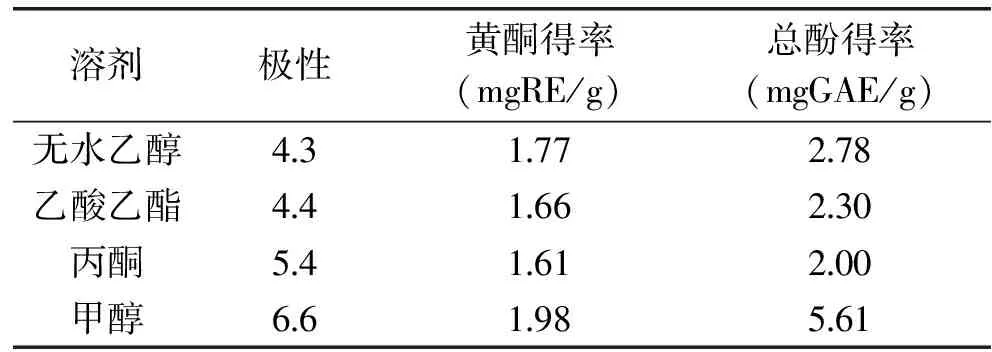
表2 不同溶剂对黄酮及总酚得率的影响Table 2 Influence of solvents on extraction yield of flavonoid and total phenol
2.1.2 甲醇浓度对黄酮及总酚得率的影响 闪提过程中控制闪提转速3300r/min,闪提时间180s,设置不同浓度的甲醇溶液为提取溶剂。不同甲醇浓度对黄酮及总酚的得率影响见图1。由图1知,黄酮及总酚的得率随甲醇浓度升高都呈先增大后减小的趋势,当甲醇浓度为60%时二者得率均达到最大值。辣椒主要含黄酮醇、槲皮素等黄酮和咖啡酸、绿原酸等多酚[16],它们属于极性物质。当甲醇浓度较低时,溶液极性较大,易溶解辣椒渣中糖苷类物质,对黄酮及总酚的溶解度不高。逐步提高甲醇浓度能使溶液极性与目标产物的极性接近,有利于其溶解,但在浓度过高的甲醇溶液中,一些色素类杂质会与其竞争同甲醇-水分子的结合,降低黄酮及总酚的得率。因此,本实验条件下,最适宜的甲醇浓度为60%。
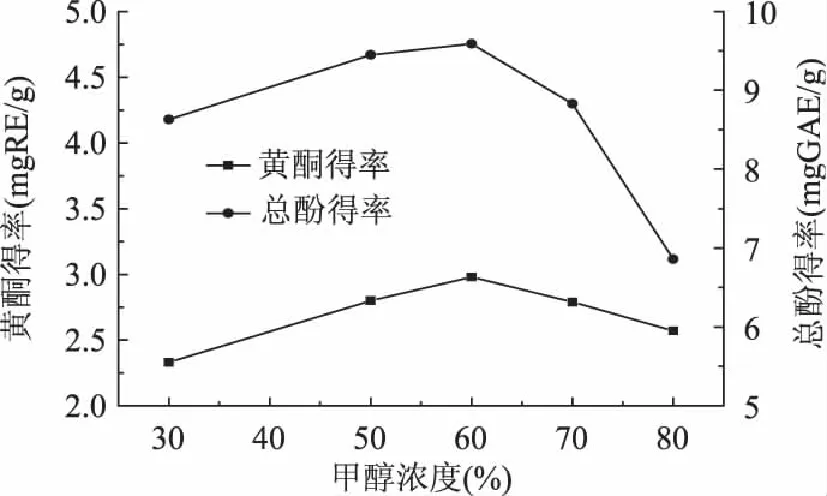
图1 甲醇浓度对黄酮及总酚得率的影响 Fig.1 Influence of methanol concentration on extraction yield of flavonoid and total phenol
2.1.3 闪提转速对黄酮及总酚得率的影响 闪提过程中控制甲醇浓度60%,闪提时间180s,设置不同的闪提转速。不同闪提转速对黄酮及总酚的得率影响见图2。由图2知,随着闪提转速的增加,黄酮及总酚得率都先增大后减小。其他条件不变,适当提高闪提转速,可促进有效成分的溶出与扩散。当闪提转速达到3300r/min后,再继续提高闪提转速,黄酮及总酚的得率却逐渐减小,可能的原因为:在过高的闪提转速下,刀头剧烈搅拌粉碎,使辣椒渣中有效成分的粒径减小,一方面会引起表面能的增大而被吸附在固体表面不易溶解;另一方面细微粒子会互相粘结,无法分离,两方面原因都会导致黄酮及总酚的得率降低。因此,本实验条件下,最适宜的闪提转速为3300r/min。
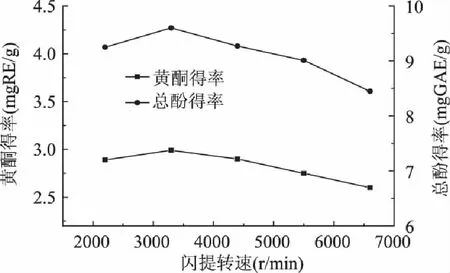
图2 闪提转速对黄酮及总酚得率的影响 Fig.2 Influence of rotation on extraction yield of flavonoid and total phenol
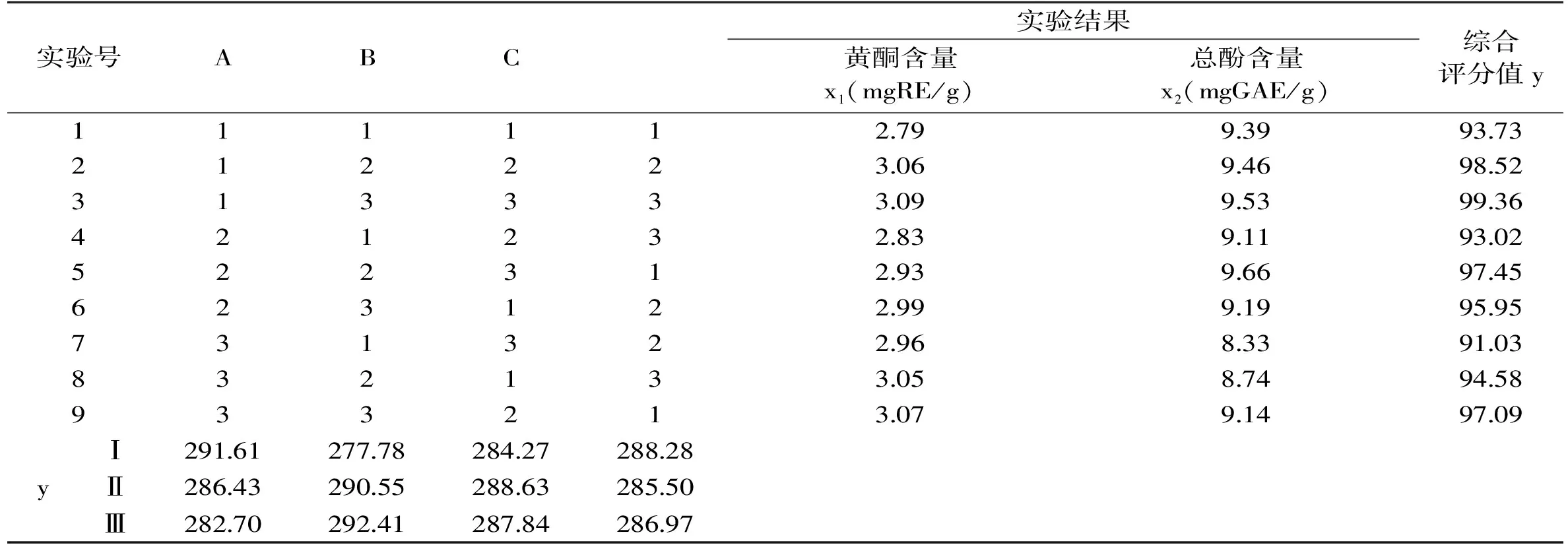
表3 正交实验结果Table 3 Result of orthogonal test
2.1.4 闪提时间对黄酮及总酚得率的影响 闪提过程中控制甲醇浓度60%,闪提转速3300r/min,设置不同的闪提时间。不同闪提时间对黄酮及总酚的得率影响见图3。由图3知,黄酮及总酚的得率随闪提时间的延长先增大后缓慢减小。其他条件不变,延长闪提时间有利于目标产物的充分溶出,提高得率。但提取时间过长会造成刀头高速转动的热量囤积,体系温度升高,一方面会引起溶剂挥发,传质浓度梯度减小;另一方面会破坏一部分热敏性的有效成分。因此,本实验条件下,最适宜的闪提时间为180s。

图3 闪提时间对黄酮及总酚得率的影响 Fig.3 Influence of extraction time on extraction yield of flavonoids and total phenol
2.2 闪式提取辣椒渣黄酮及总酚的正交实验
2.2.1 正交实验结果 以黄酮及总酚得率的综合评分值y作为考察指标,设定黄酮及总酚的权重系数均为0.5,则各号实验的综合评分值y=(100x1/3.09)×0.5+(100x2/9.66)×0.5[17]。正交实验结果见表3,实验结果方差分析见表4。
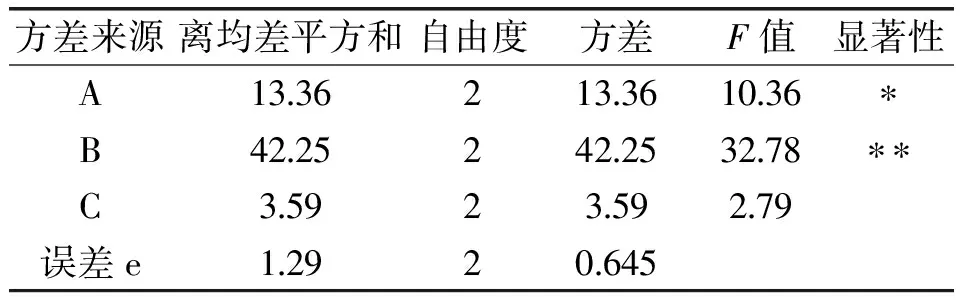
表4 正交实验方差分析表Table 4 Variance analysis chart of orthogonal test
注:F0.10(2,2)=9;F0.05(2,2)=19。当F>F0.05时,因素影响极显著(表示为**);当F>F0.10时,因素影响显著(表示为*);当F0.10>F时,因素影响不显著。
由表4知,闪提转速对辣椒渣中黄酮及总酚的得率影响极为显著,甲醇浓度对得率影响显著,闪提时间对得率影响不显著,各因素对得率影响的主次顺序为:闪提转速>甲醇浓度>闪提时间。取各因素最高水平组合,得到辣椒渣中黄酮及总酚的最佳闪式提取工艺组合为A1B3C2,即最佳工艺条件为:甲醇浓度50%,闪提转速4400r/min,闪提时间150s。
2.2.2 验证实验 正交实验得到的最佳提取工艺为A1B3C2,正交表中没有此组合,故补做验证实验,取等量原料,进行三次平行实验,得到黄酮及总酚的得率分别为(3.07±0.05)mgRE/g和(9.61±0.12)mgGAE/g。
2.3 HPLC分析结果
采用HPLC法分别对咖啡酸和槲皮素的混合物对照品及辣椒渣甲醇提取物进行分析,结果如图4:
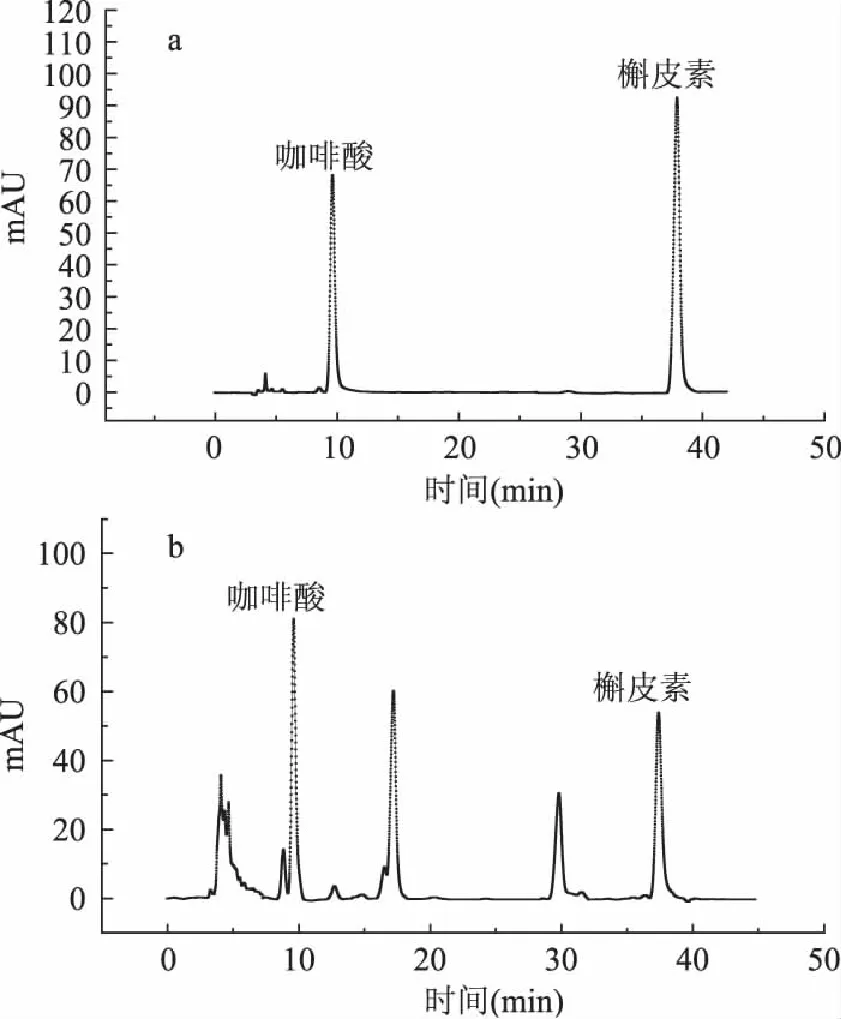
图4 对照品及辣椒渣甲醇提取物的HPLC色谱图 Fig.4 HPLC chromatogram of standard and methanol extracts of capsicum residual
3 结论
闪式提取辣椒渣中黄酮及总酚的最佳工艺条件为:50%甲醇溶液、闪提转速4400r/min及闪提时间150s,在此最佳工艺条件下,黄酮及总酚的得率分别为(3.07±0.05)mgRE/g和(9.61±0.12)mgGAE/g。采用HPLC法对提取物进行分析,鉴定出其中含槲皮素和咖啡酸。
本实验采用闪式提取技术从经色素和辣椒碱类物质深加工后的辣椒渣中提取高附加值的黄酮及总酚,提取过程成本低、能耗低且短时高效、简便易行,有利于促进整个辣椒深加工过程的环保化和资源高效化利用,实现辣椒原料的综合开发利用。
[1]太志刚.四种花卉的化学成分及其抗氧化活性研究[D].昆明:云南大学,2011.
[2]黄利勇,焦利卫,魏占姣.一种用辣椒渣提取抗氧化物质的方法[P].中国专利:102127448A,2011-07-21.
[3]高彦祥,辛晓艳,袁芳.一种从辣椒渣中提取黄酮类化合物和总酚的方法[P].中国专利:102492007A,2012-06-13.
[4]李湘洲,周雯雯,杨军君,等.辣椒籽的超临界提取物对辣椒红色素抗氧化作用的研究[J].林产业化学与工业,2007,27(10):51-54.
[5]刘彩丽.辣椒籽中抗氧化剂的提取及抗氧化性能和抗氧化动力学研究[D].郑州:河南工业大学,2006.
[6]刘延泽,袁珂,冀春茹.中草药化学成分提取新方法:植物组织破碎提取法[J].河南科学,1993,4(11):265-268.
[7]刘延泽.植物组织破碎提取法及闪式提取器的创制与实践[J].中国天然药物,2007,5(6):401-407.
[8]吴冬梅.闪式提取器在中药研究中的应用[J].中国实验方剂学杂志,2006,7(12):34,37.
[9]周湛.三七芦头皂苷的闪式提取与分离及活性皂苷的生物转化研究[D].沈阳:辽宁中医药大学,2009.
[10]陈艳蕊.黄芪多糖、皂苷、黄酮、枸杞多糖和黄精多糖的闪式提取工艺及指纹图谱的研究[D].武汉:华中科技大学,2011.
[11]邓引梅,崔永明,李唯,等.响应面法优化闪式提取甘草叶总黄酮工艺研究[J].化学与生物工程,2008,25(9):44-47.
[12]朱兴一,杨军辉,谢捷,等.响应面法优化闪式提取茶叶中儿茶素类物质的工艺研究[J].林产化学与工业,2011,3(31):105-109.
[13]吴立军.天然药物化学[M].北京:人民卫生出版社,2008:31-33.
[14]Elija Khatiwora,Vaishali B Adsul,Manik M Kulkarni,etal. Spectroscopic determination of total phenol and flavonoid contents of Ipomoea carnea[J]. Int J Chem Tech Res,2010,2(3):1698-1701.
[15]Lei Chen,Ji-Eun Hwang,Kang Mo Gu,etal. Comparative study of antioxidant effects of five korean varieties red pepper(capsicum annuum L)extracts from various parts including placenta,stalk,and pericarp[J]. Food Sci Biotechnol,2012,21(3):715-721.
[16]詹沛鑫. 辣椒的抗氧化活性[J]. 中国调味品,1998(6):6-8.
[17]何雁,马志庆.医药数理统计[M].北京:科学出版社,2009:169-171.

