单宁酸与胰α-淀粉酶作用特性研究
,
(四川大学轻纺与食品学院,四川成都 610065)
近年来,随着人们生活水平不断提高,糖尿病、高血压、肥胖等已成为常见的高发病,严重危害了人类健康[1]。众多研究表明,某些植物成分(如存在于多种果蔬中的多酚类化合物)可有效影响消化酶活性,据此有望建立糖尿病和肥胖等疾病新的预防和控制方法[2]。单宁酸又称鞣酸,广泛存在于茶叶及多种中草药和果蔬食品中[3]。文献表明,单宁酸具有抗炎、抗氧化、降血糖、调整脂代谢等多种功效[4],如Tikoo[5]发现单宁酸可改善糖尿病大鼠的一般状况及肾功能,而沈忠明[4]证明虎杖单宁酸对小鼠具有明显的降血糖作用。胰α-淀粉酶是一种糖类代谢酶,对动物体内淀粉和肝糖的降解起重要作用[6]。单宁酸可影响胰α-淀粉酶活性,但对于单宁酸与胰α-淀粉酶相互作用机制国内外尚未见报道。基于此,本文首先研究了单宁酸对胰α-淀粉酶的抑制作用,并借助紫外和荧光光谱手段探讨了作用机理,拟为单宁酸在相关功能性食品和药品中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
猪胰α-淀粉酶(PPA,分子量50ku)、芦丁、槲皮素 美国Sigma公司。单宁酸(TA)、没食子酸、茶多酚 成都市长征化玻有限公司;其他试剂均为分析纯。
2501PC紫外分光光度仪 日本岛津公司;F-4000荧光光谱仪 日本日立公司。
1.2 实验方法
1.2.1 单宁酸对PPA的抑制作用 采用改进的分光光度法[7]研究了单宁酸对PPA的抑制作用。首先将2.5g可溶性淀粉溶于磷酸盐缓冲液(pH6.9),煮沸,冷却后定容至250mL,作为底物溶液备用。以磷酸盐缓冲液配制不同浓度PPA溶液,避光冷藏。将0.5mL底物溶液于310K水浴1min后,依次加入0.25mL单宁酸溶液(单宁酸最终浓度为0.05、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2mg/mL)、0.25mL酶溶液。310K下震荡反应5min后,加入1mL DNS显色液[8],置于沸水浴中8min。取出,冷至室温,加蒸馏水10mL稀释,于540nm测定吸光值。实验中以空白液为参比,计算单宁酸对PPA的抑制率,并基于单宁酸浓度与抑制率的回归方程计算其半抑制浓度IC50。实验中对比研究了芦丁、茶多酚、槲皮素、没食子酸(最终浓度2mg/mL)对PPA的抑制率。
抑制率(%)=[(T1-T2)/T1]×100
式(1)
式(1)中T1和T2分别代表无抑制剂和有抑制剂时的酶活。
研究中固定酶浓度(0.08mg/mL)和单宁酸浓度(0.05mg/mL),在不同底物浓度下(0.25%、0.5%、0.75%、1%)进行酶活分析,方法同上[7],通过双倒数作图法判断单宁酸对PPA的抑制类型。
1.2.2 单宁酸与PPA作用的紫外差谱分析 于3.0mL PPA溶液(0.5mg/mL)中,加入0.2mL单宁酸溶液,于室温震荡反应一定时间后,在200~300nm范围内扫描,以相同浓度的PPA溶液作空白,记录PPA溶液的紫外吸收差谱。实验中改变单宁酸浓度(0.025、0.05、0.1、0.2、0.4、0.8mg/mL)和作用时间(2、10、30min、1、2h),通过PPA紫外吸收差谱研究单宁酸与PPA的作用特性。
1.2.3 单宁酸与PPA作用的荧光光谱分析 取3.0mL浓度为0.5mg/mL的PPA溶液,将其与0.2mL单宁酸溶液于荧光比色皿中混匀(单宁酸最终浓度为0.025、0.05、0.1、0.2、0.4、0.8mg/mL),在不同温度下(293、303、310K)静置作用5min后测试。荧光激发波长278nm和295nm,荧光发射扫描范围300~400nm。在上述实验条件下,以同步波长Δλ=15nm及Δλ=60nm分别进行同步荧光扫描。
1.2.4 数据处理 每次测定均平行测定三次,采用Excel和SPSS16.0软件进行数据处理,测定结果以平均值±标准偏差(mean±SD)表示,显著性临界值α=0.05。采用Origin8.0软件对采集的紫外和荧光数据进行分析和作图。
2 结果与讨论
2.1 单宁酸对胰α-淀粉酶的抑制特性
单宁酸对PPA的抑制如图1A所示,随着单宁酸浓度升高,其对PPA的抑制率逐渐增大,当单宁酸浓度达2mg/mL时,94.8%的PPA酶活受到抑制,基于数据拟合求解可知单宁酸对PPA的半抑制浓度IC50为0.87mg/mL。实验中将单宁酸与几种典型植物多酚进行比较,发现在2mg/mL时,芦丁、茶多酚、槲皮素、没食子酸对PPA的抑制率分别为40.2%、67.4%、41.5%和13.9%,单宁酸表现了相对更强的PPA抑制能力。
1.3.4 福山区政府政策优势。福山区政府确立了以特色樱桃产业带动经济发展、以优秀电商模式推动特色樱桃产业的双驱动模式,不断提升樱桃特色产业的水平,使大樱桃的电商模式驶入“快车道”。自2006年以来,在面对其他大樱桃地区的快速发展时,福山政府推动了樱桃品牌的创立,大樱桃产业发展需要品牌意识,以实现利益与品牌价值的捆绑提升,在提高水果质量的同时,也提升了品牌认证的力度,不断地巩固福山区大樱桃的优势地位[1]。
由Lineweaver-Burk图可见,当单宁酸存在时,酶反应米氏常数(Km)不变,但最大反应速率(Vmax)减小(图1B),单宁酸对PPA的作用表现为非竞争性抑制。说明单宁酸能与PPA活性中心外的必需基团结合,与酶-底物结合互不影响,但酶-底物-抑制剂三元复合物不能进一步分解为产物[9]。
2.2 单宁酸对胰α-淀粉酶紫外光谱的影响
单宁酸与胰α-淀粉酶(PPA)作用后,可使得酶的空间结构发生一定程度变化,如导致酶二级结构改变,这种改变可通过PPA的紫外吸收差谱得以反映[10]。不同浓度单宁酸与PPA作用后,其紫外吸收变化如图2A所示。可见,PPA在270nm附近的吸收变化随单宁酸浓度增大而逐渐增大,并且发生红移,当单宁酸浓度增至0.4mg/mL时,红移近10nm。随着单宁酸浓度进一步增大(>0.8mg/mL),PPA吸收差谱无明显变化(图略),这可能源于单宁酸与PPA作用趋于稳定,PPA空间结构不再改变所致。实验中考察了不同作用时间后,单宁酸对PPA紫外吸收的影响,结果发现PPA的紫外差谱无本质变化(图2B),说明单宁酸与PPA结合迅速,短时间可达到一个稳定的状态。
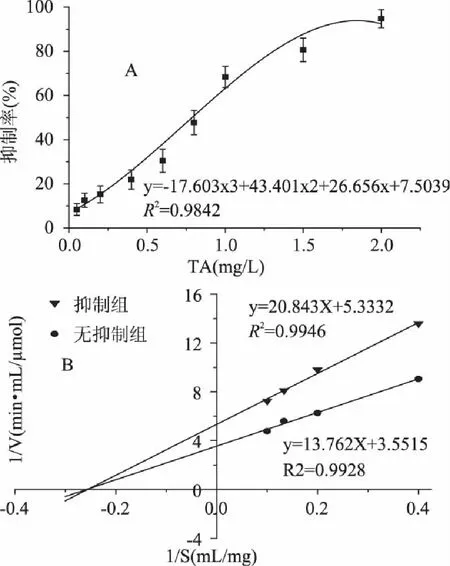
图1 单宁酸对PPA的抑制特性 Fig.1 Inhibition characteristics of tannic acid on PPA
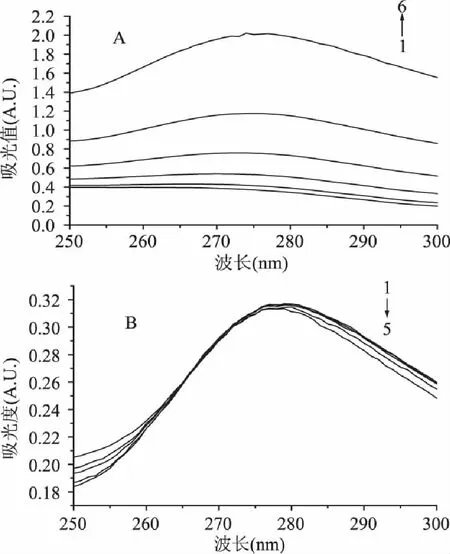
图2 单宁酸作用后PPA紫外吸收差谱 Fig.2 The UV differential spectra of PPA in the presence of tannic acid at pH 6.9 and 310
2.3 单宁酸对胰α-淀粉酶荧光光谱的影响
蛋白质分子中有多种氨基酸具有荧光特性,其所需激发波长不同。278nm可激发色氨酸(Trp)和酪氨酸(Tyr)残基,而295nm只可激发Trp残基[11]。由图3可见,随着单宁酸浓度增大,PPA的内源荧光强度有规律降低。在不同激发波长下,PPA激发峰的峰位与峰形略有改变,但都随单宁酸浓度增大发生了一定程度红移。单宁酸与PPA结合后PPA肽链发生伸展,可能使得Trp和Tyr残基暴露于极性环境中,从而导致最大荧光发射峰红移[12]。
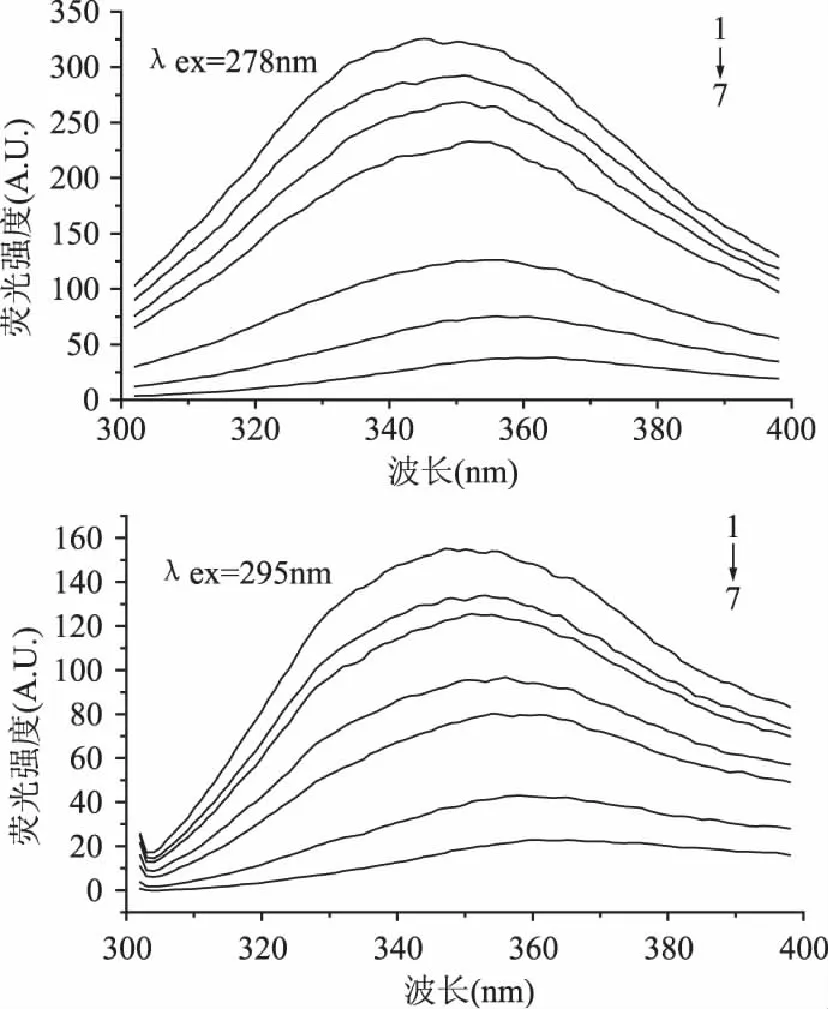
图3 单宁酸对PPA荧光光谱的影响 Fig.3 Effect of tannic acid on fluorescence spectrum of PPA at pH 6.9 and 310K
2.4 胰α-淀粉酶的同步荧光光谱
同步荧光可以提供发色基团微环境的变化信息,在同步荧光波长Δλ=15nm和Δλ=60nm所测得的光谱可分别反映酪氨酸(Tyr)和色氨酸(Trp)残基的光谱特性[13],判断其微环境的改变,进而推断蛋白质构象的变化。研究发现,增加单宁酸浓度,酪氨酸残基的最大发射波长没有明显移动(图4A),表明在单宁酸和PPA结合过程中Tyr残基附近的微环境没有明显改变,而Trp残基的最大发射波长发生了明显的红移(移动了7nm,图4B),说明单宁酸与PPA的结合使得Trp残基附近微环境的极性增大、疏水性降低。
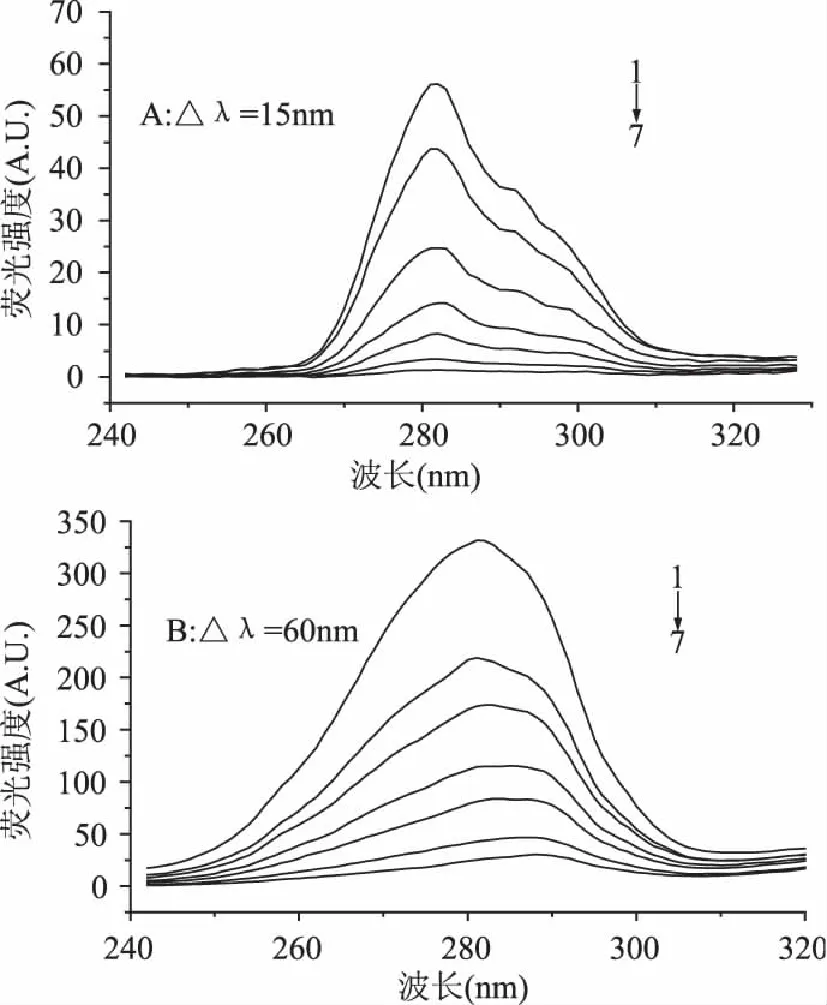
图4 PPA的同步荧光光谱 Fig.4 Synchronous fluorescence spectra of TA-PPA system at pH 6.9 and 310K
2.5 单宁酸对胰α-淀粉酶的荧光猝灭特性
蛋白质荧光猝灭通常分为静态和动态过程,动态猝灭是因分子热运动碰撞引起,其作用过程遵循Stern-Volmer方程[14]:F0/F=1+Kqτ0[Q]=1+Ksv[Q]。式中F0和F分别为加入猝灭剂前后的荧光强度,Kq为猝灭常数(该值越大猝灭效应越明显),τ0为荧光分子的初始平均寿命(生物大分子约为10-8s),K是动态猝灭常数,[Q]为猝灭剂浓度。
在单宁酸浓度小于0.12×10-3mol/L(0.2mg/mL)时,F0/F与[Q]具有良好的线性关系。由Stern-Volmer方程可知在293、303、310K条件下单宁酸对PPA的猝灭常数Ksv分别为1.44×104L/mol(F0/F=14.4[Q]+0.9829,R2=0.9813)、1.38×104L/mol(F0/F=13.8[Q]+1.0221,R2=0.9886)和1.24×104L/mol(F0/F=12.4[Q]+0.9814,R2=0.9962),进一步可求得猝灭常数Kq分别为1.44×1012、1.38×1012、1.24×1012L·mol-1·s-1。文献[15]表明各类猝灭剂对生物大分子的最大动态猝灭常数约2.0×1010L·mol-1·s-1,显然本实验所得Kq远高于该值,这表明在低浓度时,单宁酸对PPA的荧光猝灭不是因碰撞造成的,而是静态猝灭,即单宁酸与PPL结合生成了不发射光子的配合物。动态猝灭中,温度升高将增加有效碰撞和加剧电子转移过程,使得猝灭常数增大,但在静态猝灭中,温度升高将降低配合物的稳定性,减小猝灭常数[16]。本实验中猝灭常数Kq随着温度的升高而降低,这也进一步说明动态碰撞不是单宁酸引起PPA荧光猝灭的主要原因。实验发现随着单宁酸浓度继续增大,F0/F-[Q]曲线向上弯曲(图5),这可能因为单宁酸对PPA同时产生了静态和动态猝灭效应[17]。
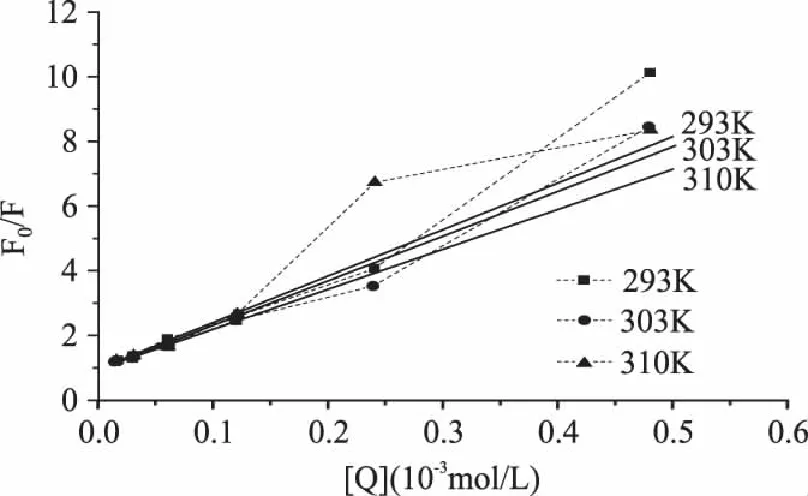
图5 单宁酸对PPA的荧光猝灭Stern-Volmer曲线(λex=278nm) Fig.5 Stem-Volmer curves for the fluorescence quenching of PPA by tannic acid(λex=278nm)
2.6 单宁酸与胰α-淀粉酶作用力类型
ΔG=ΔH-TΔS=-RT lnK
式(2)
式(3)
式中,ΔG为吉布斯自由能,R是气体常数,K1和K2分别是温度T1和T2下的结合常数。
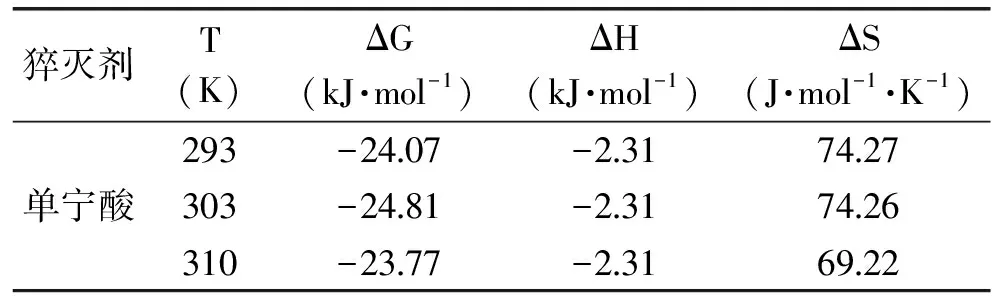
表1 单宁酸与PPA结合的热力学参数Table 1 Thermodynamic parameters of interaction between PPA and TA
计算发现在不同温度下反应的ΔH值相近,研究中取其均值作为后续计算的依据。单宁酸与PPA结合反应的热力学参数ΔS>0,ΔG<0,表明二者的结合不但能发生,而且可以自发进行,其主要结合力应源于疏水作用[19]。考虑到蛋白质结构的复杂性,小分子和酶蛋白之间往往同时存在几种作用力。基于分子结构分析,单宁酸为多羟基化合物,羟基与蛋白分子氨基酸残基之间有可能形成氢键,因此推断单宁酸与PPA之间还可能存在氢键作用力。
3 结论
单宁酸对胰α-淀粉酶(PPA)显示了明显的抑制作用,其抑制类型为非竞争性抑制。紫外光谱表明单宁酸可引起PPA构象变化,使酶的吸收峰发生红移。荧光光谱表明单宁酸与PPA之间能自发进行反应,通过疏水作用形成单宁酸-PPA复合物,并引起PPA内源荧光猝灭。同步荧光光谱显示单宁酸与PPA的结合位点靠近其色氨酸残基区域。对单宁酸-PPA作用特性的认识,可为单宁酸在相关功能性食品和药品中的应用提供参考。
[1]张冬英,余霜,黄业伟,等.普洱茶对α-淀粉酶抑制作用的影响研究[J].食品工业科技,2009,30(2):77-79.
[2]King-Thom Chung,Tit Yee Wong,etal.Tannins and Human Health:A Review[J].Critical Reviews in Food Science and Nutrition,1998,38(6):421-464.
[3]魏海峰,李才,魏雁虹,等.单宁酸对高糖及AGES引起肾小球系膜细胞增殖和W型胶原生成的影响[J].中国实验诊断学,2010,14(4):496-498.
[4]沈忠明,殷建伟,袁海波,等.虎杖鞣质的降血糖作用研究[J].天然产物研究与开发,2004,16(3):220.
[5]Chandak PG,Gaikwad AB,Tikoo K,etal.Gallotannin ameliorates the development of streptozotocin induced diabetic nephropathy by preventing the Activation of PARP[J].Phytother Res,2009,23(1):72.
[6]裘晓丹,刘雯,雷芳,等.可可碱对胰α-淀粉酶的抑制类型及光谱性质的影响[J].天然产物研究与开发,2008,20:99-102.
[7]B.施特尔巴赫著,钱喜渊译.酶的测定方法[M].中国轻工业出版社,1992:37-41.
[8]张永军,黄惠华.茶多酚对胰α-淀粉酶的抑制动力学研究[J].食品工业,2010,1:7-9.
[9]石碧,狄莹.植物多酚[M].北京:科学出版社,2000:115-116.
[10]杨频,高飞,马贵斌.生物无机化学导论[M].西安:西安交通大学出版社,1991:163.
[11]王守业,徐小龙,刘清亮,等.荧光光谱在蛋白质分子构象研究中的应用[J].化学进展,2001,13(4):1887-1891.
[12]Burstein E A,Vedenkina N S,Ivkova M N.Fluorescene and the location of tryptophan residues in protein molecules[J]. Photochem Photobiol,1973,18:267-279.
[13]Lakowicz J R,Weber G.Quenching of protein fluorescence by oxygen,detection of structural fluctuations in proteins on the nanosecond time scale[J].Biochemistry,1973,12:4171-4179.
[14]Lakowicz J R.Principles of Fluorescence Spectroscopy(Seconded.)[M].New York:Plenum Press,1999,237.
[15]范志飞,戴吉领,何强,等.表没食子儿茶素没食子酸酯与猪胰脂肪酶的相互作用[J].食品科学,2013,34(7):20-23.
[16]童俊,韩凤梅,陈勇.荧光猝灭法研究马钱子碱、士的宁与人血清白蛋白的相互作用[J].中草药,2010,41(9):1453-1456.
[17]林锋,姚江武,陶涛.红茶和绿茶多酚与猪胰腺α-淀粉酶的荧光猝灭反应[J].口腔医学研究,2009,25(2):156-160.
[18]Keishi Yamasaki,Toru Maruyama,Otagiri M,etal.Interactive binding to the two principal ligand binding sites of human serum albumin:effect of the neutral-to-base transition[J].Bioch Biophys Acta,1999,1432:313-323.
[19]杨冉,屈凌波,陈晓岚,等.柚皮素、柚皮苷与溶菌酶相互作用的荧光光谱法研究[J].化学学报,2005,64(13):1349-1354.

