负载丝裂霉素C的明胶多孔支架制备及释放*
朱继翔,陈晓明,彭晔,阳范文,田秀梅,何福坡
(广州医科大学基础学院生物医学工程系,广东广州510182)
明胶是一种生物相容性良好的天然高分子材料,广泛应用于组织工程支架的制备[1-3]。它含有类似于精氨酸-甘氨酸-天冬氨酸(RGD)的序列,能够促进细胞的粘附与生长。然而,生物机体中的许多组织受损后,在修复和愈合过程中,会产生不同程度的瘢痕组织,它在一定程度上保护了受损组织,但是,瘢痕组织的过度生长会带来不良影响。比如,中枢神经受损后,胶质瘢痕产生,阻碍脊髓中再生神经形成通路,导致瘫痪[4];而在包括尿道重建等泌尿系统疾病的临床治疗以及术后恢复过程中,往往会出现瘢痕引起的泌尿系统狭窄[5]。因此,利用组织工程支架进行组织再生修复时,不仅需要促进细胞在支架中的生长与迁移,而且需要抑制支架中瘢痕细胞与组织的过度增生。
丝裂霉素C(MMC)是一种广谱抗肿瘤抗生素,它提取自头撞链霉菌产生的抗生素混合物,可以破坏细胞DNA的结构与功能,抑制增殖期DNA的复制以及RNA的合成,从而有效抑制细胞的过度增殖[6]。目前,MMC已经应用于临床,如在膀胱癌疗中,减少术后肿瘤细胞的增生[7];在青光眼手术治疗中,减少术后滤过泡的瘢痕化,提高手术成功率[8]。近年来,以生物可吸收类聚酯为载体的载药微球研究备受关注,它可以维持药物稳定性,延长药物缓释时间,降低药物毒副作用,为药物的负载与缓释提供了重要参考。
本研究采用生物可吸收类聚酯PLGA微球作为载体,制备负载MMC的PLGA微球。利用冷冻干燥法制备含有载药微球的明胶多孔支架,并对其性能及药物缓释进行研究。
1 实验部分
1.1 主要试剂和原料
明胶(180g Bloom),聚乙烯醇(PVA),Sigma;PLGA,分子量5万,惠州华阳医疗器械有限公司;丝裂霉素C,京尼平,上海阿拉丁试剂。
1.2 PLGA/MMC微球的制备
称取200mg的PLGA与20mg的MMC溶解于8mL二氯甲烷与2mL丙酮的混合溶剂中。将上述溶液缓慢注入100mL的PVA水溶液(2%,w/v),乳化10分钟后,倒入1L蒸馏水中,溶剂挥发12小时。离心分离所得微球,蒸馏水清洗3次,除去微球表面残留的PVA,冷冻干燥3天,于干燥器中存储备用。
1.3 明胶多孔支架的制备
称取800mg的明胶,溶解于10mL超纯水中后,加入200mg的PLGA/MMC微球;然后,加入100mg的京尼平粉末,搅拌均匀,交联24小时。-20℃预冻1小时,冷冻干燥3天,室温下,于干燥器中保存。测量支架的孔隙率、溶胀率与压缩模量[9]。
1.4 明胶多孔支架中MMC的体外释放
称取50mg明胶多孔支架装入10mL磷酸盐缓冲溶液(pH=7.4)的试管中;37℃,45r/min恒温振荡器中释放;间隔一段时间取出2mL释放液样本,同时补充2mL新鲜磷酸盐缓冲溶液;测定358nm处紫外吸收,并结合MMC标准曲线计算释放液中MMC的含量。时间间隔为:3天,1周,2周,3周,4周,5周。
2 结果与讨论
2.1 微球与支架的微观形貌
通过扫描电镜观察载药微球的微观形貌,结果如图1(a)所示。PLGA/MMC微球表面光滑,微观呈规整的球状,粒径大约为35 μm,分布较均匀。微球的粒径大小、载药量以及成球率等性能受到众多制备参数的影响[10]。一般情况下,乳化剂的浓度高,乳化效果好,微球粒径小,分布也相对集中。但是,过高浓度的乳化剂影响微球的表面形貌与实际应用。载药聚合物的浓度对微球的制备效果影响也较大,如果聚合物浓度过高,使得溶液粘度较大,在相同剪切力下,不易分散,成球效果不佳;如果聚合物浓度过低,微球在制备过程中容易出现塌陷现象。经过预实验,我们优选乳化剂浓度为2%,聚合物浓度为20mg/mL。另外,油相溶剂的选择也影响微球的制备,在二氯甲烷中加入适量的丙酮,一方面增加了MMC在油相中的溶解度,另一方面,也达到了改善微球形貌的目的。利用冷冻干燥法制备明胶支架,在制备过程中加入载药微球,所得支架的微观形貌如图1(b)所示。支架的微观呈多孔结构,微孔之间的连通性较高,平均孔径约为150 μm。支架的孔壁中,嵌入了PLGA/MMC微球,载药微球分布相对较均匀。

图1 (a)负载MMC的聚合物微球及(b)含有载药微球的明胶支架Fig.1 SEM picture of(a)PLGA/MMC microsphere and(b)gelatin scaffold with microsphere
2.2 明胶支架的性能
对比含有载药微球的明胶支架的性能与相同条件下制备得到的未含载药微球明胶支架的性能,结果如表1所示。两者在孔隙率、溶胀率以及压缩模量参数上性能相似。可见,在明胶多孔支架内部植入载药微球,并不会较大地改变支架本身的相关性能。含有载药微球的明胶多孔支架,孔隙率达到90.2%;对支架进行化学交联,使得支架的溶胀率维持在20%左右,在生理环境下,支架的结构稳定。明胶微球支架的压缩模量为52.1kPa,可以保证支架具有一定的力学强度与弹性,在组织修复过程中,承受来自周围组织的压迫,以及机体运动产生的张力,保持支架结构的完整,为组织再生与修复提供有利条件。
2.3 体外释放研究
模拟体内环境,对PLGA/MMC载药微球与明胶微球支架的药物缓释行为进行研究,结果如图2所示。体外释放实验结果表明,载药微球在释放初期无明显暴释现象,微球累计释放药物5周,累积释放量达到77.3%。释放过程大致可分为三个阶段,第1周内,微球的释药速率相对较快,累计释放量为44.7%;在第2周至第4周内,释药速率均匀,达到稳定;第5周时,释药速率较缓慢,整个释放体系达到平衡状态。支架中MMC的释放相对纯载药微球组有一段时间的延迟,5周累积释放MMC为65.2%。在释放开始的1周内,仅有少量的药物释放,累计释放量仅为12.2%;在第1周至第3周内,释药速率有所增加,平均每周约释放17.2%的MMC;在第3周至第5周内,释药速率均匀,达到平衡。支架中MMC的释放受微球性能与支架性能的共同影响。少量的MMC可以通过扩散作用,经过微球壁与支架管壁,释放到周围体系中,而多数MMC的释放需要经历支架与微球结构的降解。因此,支架中MMC的释放趋势相对载药微球有一定的延迟。载药微球需要在支架结构发生一定程度的降解后,才能有效进行药物缓释。这一结果也表明,可以通过控制支架的降解时间,调控支架中药物缓释的发生时间,使得支架中的药物在合适的时间点控制释放。
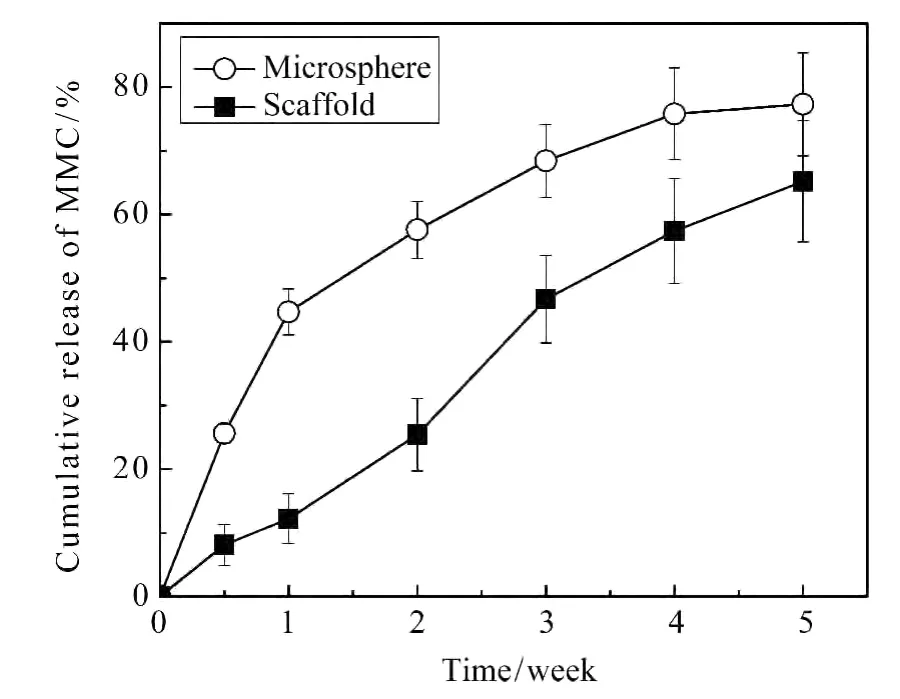
图2 微球与支架的累计释放曲线Fig.2 The MMC cumulative release of microsphere and gelatin scaffold
3 结论
(1)采用单乳化溶剂挥发法制备负载MMC的PLGA微球,通过相分离与冷冻干燥,制备含有载药微球的明胶多孔支架。支架的孔隙率达到90.2%,溶胀率为22.7%,压缩模量为52.1kPa。
(2)体外释放实验表明,载药微球中,MMC在5周的累计释放量为77.3%;支架中MMC的释放相对较缓,5周累积释放量为65.2%。这种含有载药微球的明胶多孔支架具有潜在的抗瘢痕应用前景。
[1]Nakamura S,Kubo T,Ijima H.Heparin-conjugated gelatin as a growth factor immobilization scaffold[J].Journal of Bioscience and Bioengineering,2013,115(5):562-567.
[2]Jaiswal A K,Chhabra H,Soni V P,et al.Enhanced mechanical strength and biocompatibility of electrospun polycaprolactone-gelatin scaffold with surface deposited nano-hydroxyapatite[J].Materials Science and Engineering:C,2013,33(4):2376-2385.
[3]张恒,纪秀丽.可生物降解纳米胶囊的囊材、化学制备和表征[J].合成材料老化与应用,2008,37(3):44-48.
[4]Liu R,Chen X P,Tao L Y.Regulation of axonal regeneration of following the central nervous system injury in adult mammalian[J].Neurosci Bull,2008,24:396-400.
[5]Chapple C,Osman N,MacNeil S.Developing Tissue-Engineered Solutions for the Treatment of Extensive Urethral Strictures[J].European Urology,2013,63:539-541.
[6]Paul A H,Margaret A B,Johannes R.DNA adduct formation of mitomycin C[J].Computational and Theoretical Chemistry,2013,1055:9-1.
[7]Hamid M,Iraj M,Fatemeh G.Effect of Mitomycin C on Anterior Urethral Stricture Recurrence after Internal Urethrotomy[J].European Urology,2007,51:1089-1092.
[8]Miguel A T,Laura B L,Jorge L A.Mitomycin C in Corneal Refractive Surgery[J].Survey of Ophthalmology,2009,54(4):487-502.
[9]Zhu J X,Xiong Y,Zeng C G,et al.Elastic chitosan conduits with multiple channels and well defined microstructure[J].International Journal of Biological Macromolecules,2012,51:105-112.
[10]Han B,Wang H T,Liu H Y,et al.Preparation of pingyangmycin PLGA microspheres and related in vitro/in vivo studies[J].International Journal of Pharmaceutics,2010,398:130-136.

