一种新型壳聚糖/聚乙二醇丙烯酸酯复合水凝胶制备与性能研究*
肖春宏,杨波,李善吉,李文超
(1临沧师范高等专科学校数理系,云南临沧677000;2嘉应学院化学与环境学院,广东梅州514015)
可注射型生物材料通过注射的方法植入体内,具有微创性的特点,在组织工程和外科整形方面有着广泛的应用前景[1-7]。水凝胶前驱物为溶液状态,极易注射,在体内可快速成型,因此水凝胶体系被广泛用于可注射型支架。作为可注射型水凝胶支架,水凝胶前驱物要求有好的生物相容性和生物降解性,并且能在温和的条件下快速凝胶[8-13]。壳聚糖具有生物降解性和良好的生物相容性,但是酸溶性和凝胶方法限制了壳聚糖作为可注射水凝胶在体内组织修复中的应用[14-19]。本研究过程中,依次将聚乙二醇单甲醚(MPEG)和丙烯酰氯(AC)接枝到壳聚糖链上,制备了可共价交联的水溶性壳聚糖(CS-PEG-AC)。在本研究中用细胞毒性较小的光引发剂(Irgacure2959)在特定波长(365nm)的紫外光作用下引发CS-PEG-AC聚合。由于光引发聚合有着可控的聚合反应动力学以及聚合反应中放热少等优点,光引发聚合在骨关节修复、牙科、眼科以及生物医药等领域有着广泛的应用。此外,光引发聚合的可控性还满足了水凝胶支架的可注射型要求,便于手术操作。
1 实验部分
1.1 原料与试剂
MPEG-2000,西格玛,用甲苯共沸干燥除水;环氧氯丙烷,阿拉丁,使用前用CaO干燥24h;NaOH,广州试剂厂;壳聚(Chitosan,CS):M=100000,浙江金桥生物化学有限公司;三乙胺,西格玛;二氯甲烷,天津富余化学试剂厂;丙酮,广州化学试剂厂;N、N二甲基乙酰胺,广州化学试剂厂;甲苯,广州化学试剂厂;四氢呋喃,广州化学试剂厂;光引发剂2959。
1.2 Exypo-PEG合成
mPEG(10g,5mmol)60℃真空干燥48h,环氧氯丙烷epichlorohydrin(30mL),NaOH(10g,250mmol)加入到装有磁子的100mL单口圆底烧瓶中,体系用干燥管保护,室温下,电磁搅拌反应24h,反应结束后,减压抽滤,滤去不溶物,过滤去NaCl及其他副产物,将滤液加入到过量(10倍溶液体积)的乙醚中,至溶液无色,进行沉淀,沉淀产品经过滤后,室温下真空干燥24h。得产物7.2g,产率72%。
1.3 壳聚糖-mPEG的合成
2g壳聚糖溶解在300mL含量为0.4%(w/v)的乙酸溶液中。10g环氧氯丙烷-聚乙二醇单甲醚溶解在适量水20mL中,缓慢滴加到壳聚糖溶液中,混合液在80℃下,磁力搅拌反应24h。先用0.05mol/L的NaOH溶液中和至pH在6.2附近,反应液装入截留分子质量为Mn=14000透析袋,用去离子水透析除去未反应的mPEG和小分子杂质,透析72h,中间换水5~6次。然后冷冻干燥。得到PEG-chiosan然后用过量丙酮洗涤,去除没反应Exypo-PEG.样品在室温下真空干燥24h。
1.4 mPEG-Chitosan-Ac的合成
1g PEG-Chitosan(1.74mmol氨基重复单元,溶于50mL DMAC中,在氮气保护下,然后混合液冷却至0~5℃,加等HCl产生化学计量的三乙胺,量取0.15倍壳聚糖氨基摩尔量的丙烯酰氯(溶于10mL无水二氯甲烷)缓慢滴加到上述混合液中。0~5℃反应4h。室温反应20h,反应结束后,溶液过滤后缓慢倒入过量(10倍)丙酮中沉淀,过滤后真空干燥,溶于200倍去离子水中,得到的溶液装入透析膜(截留分子量140kDa,透析膜,纤维素膜,Sigma),在去离子水中透析3d除去未反应的小分子,透析后得到的冷冻干燥。
1.5 水凝胶的溶胀比
水凝胶冻干后称重为W0,干的水凝胶浸入37℃的水中一定时间,称水凝胶重量为W1,平衡溶胀比定义为(W1-W0)/W0。
1.6 水凝胶的失重
200μL的水凝胶置于37℃的4mL 1mg/mL溶菌酶的PBS中。称量不同时间下水凝胶的重量为Wt,水凝胶失重定义为(W0-Wt)×100%/W0,W0为水凝胶的起始的重量。
1.7 水凝胶的粘弹性
将大分子单体溶于PBS中,加入引发剂使其最终浓度为0.05%。将上述溶液注射到圆形透明的模具(直径25mm,高度5rnrn)中,然后将模具放在紫外灯下照射,10min后形成水凝胶。将水凝胶取出后放在PBS溶液中24小时使其溶胀。用流变仪(ARES,Advaneed助eometrieE却ansionSystem)的应力控制的动态摆动模式测定溶胀后的样品的储能模量和损耗模量。所有的测试都是在37℃进行的,应变设定在1%。
1.8 统计学分析
数据用完全随机因素方差分析(one–way ANOVA)。结果用平均值和标准差表示。当p<0.05时,有显著性差异。
2 结果与讨论
2.1 大分子单体的制备
Epoxy-PEG的核磁共振谱图(300MHz,CDCl3)如图1所示。

图1 Epoxy-PEG的核磁谱图Fig.1 1H NMR Sprectum of Epoxy-PEG
从图1可知,化学位移(δ)在3.2、2.8和2.6ppm处的信号为Epoxy-PEG的环氧端基的特征峰。c峰与d峰的积分面积之比1∶3,说明PEG的端基几乎完全转化为环氧基团。
将壳聚糖接枝到环氧-PEG上,用透析袋透析除去未接枝上壳聚糖的环氧PEG及其他小分子杂质,所得产物为mPEG-CS。其核磁谱图(300MHz,CDCl3)如图2所示。

图2 mPEG-CS的核磁谱图Fig.2 1H NMR Sprectum of mPEG-CS
从图2中可以看出,,化学位移(δ)1.7-1.8为(NHAc)特征峰,2.6-4.4为(H-2,H-3,H-4,H-5,H-6,N-CH2-PEG)吸收峰,3.2为-OCH3吸收峰。
同时,可以根据核磁计算出mPEG的取代度(degree of substitution,DS),即mPEG分子的摩尔数占壳聚糖链节摩尔数的百分比为:DS=(I3.0ppm/3I2.8ppm)×100=20%。式中的3.0是PEG上CH3的H,2.8ppm是chitosan H2。
通过酰化反应将丙烯酰氯接枝到mPEG-CS制备mPEG-CS-Ac,所得产物核磁谱如图3所示。

图3 PEG-CS-Ac的核磁谱图Fig.3 1H NMR Sprectum of PEG-CS-Ac
从图3可知,5.8-6.4为双键CH2、CH的峰,说明双键已接枝到大分子单体上,接枝率可以用双键/氨基来计算,DS=(I5.8ppm/I3.3ppm)×100=13%。
2.2 聚合反应
将5%的PEG-Chitosn-Ac水溶液加入0.05%引发剂的离心管中。充分搅拌均匀混合后,离心管在置于强度为10Mw/cm2的365nm的紫外灯下进行聚合反应。
2.3 溶胀行为
37℃下,水凝胶CS-PEG-AC/PEGDA在pH=7.2的缓冲液PBS中溶胀24后的溶胀率如图4所示。由图4可知,随着PEGDA的含量的增加,溶胀性能逐渐减小,从22.3倍减少到13.6倍,这主要是随着PEGDA的量增加,交联密度增加,溶胀性能受到抑制。这一点从溶胀后冻干的水凝胶的SEM(如图6所示)也可以看出,随着PEGDA的量增加,水凝胶的孔密度是逐渐增加的。这和溶胀率相一致。

图4 水凝胶CS-PEG-AC/PEGDA在缓冲液PBS中溶胀后的溶胀率Fig.4 The degree of swelling of the CSPEG-AC/PEGDA hydrogels in PBS
2.4 降解行为
用2%的大分子单体聚乙烯醇-壳聚糖-丙烯酰氯(PEG-CS-Ac)分别和4%、6%、8%及10%的聚乙二醇双丙烯酸酯(PEGDA)合成四种水凝胶,并在37℃时,在1mg/mL溶菌酶的PBS中,对2%~4%,2%~6%,2%~8%和2%~10%四种水凝胶在溶菌酶中的降解速率进行了测试,结果如图5所示。
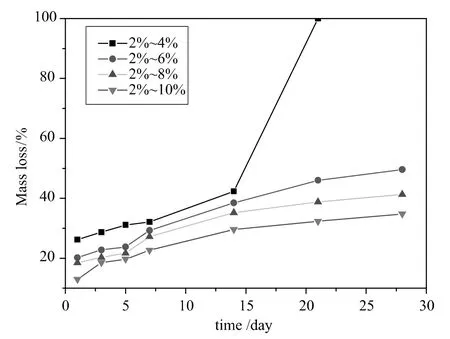
图5 2%~4%、2%~6%、2%~8%和2%~10%水凝胶在1mg/mL溶菌酶的PBS中的降解速率Fig.5 degradation rate of 2%~4%,2%~6%,2%~8%,2%~10%hydrogels in 1mg/mL lysozyme/PBS
由图5可知,随着PEGDA的量增加,降解速率是逐渐减小的。第一天到第14天,降解速率相对比较稳定,但是和其他的水凝胶相比,2%~4%降解的速率较快点,在第21天完全分散,而其他的水凝胶还是好的,降解速率相对比较平缓。这和降解后的水凝胶的SEM相一致(如图6所示)。

图6 2%~6%and 2%~10%水凝胶在1mg/mL溶菌酶PBS(37℃)中降解SEM图(A1,A2为7天,B1,B2为14天,C1,C2为21天)Fig.6 SEM image of degradation of 2%~6%and 2%~10%hydrogels in 1mg/mL lysozyme/PBS at 37℃(A1,A2 with 7d,B1,B2 with 14d,C1,C2 with 21d)
2.5 粘弹性
壳聚糖类水凝胶的储能模量和损耗模量如图7所示。

图7 2%~4%、2%~6%、2%~8%、2%~10%CS-PEG-AC/PEGDA水凝胶随相应频率作用时的储能模量(A)和损耗模量(B)(应变和温度分别为1%和37℃)Fig 7 Storage modulus(A)and loss modulu(B)of 2%~4%,2%~6%,2%~8%,2%~10%CS-PEG-AC/PEGDA hydrogels as a function of compressing frequency(Strain and temperature were set as 1%and 37℃,respectively)
由图7可知,随着PEGDA的量增加,降储能模量和损耗模量缓慢增加,随着频率的增加,同一种水凝胶的降储能模量和损耗模量缓慢增加。降储能模量较之于损耗模量是其十几倍,这说明所制备的水凝胶是弹性体,这和损耗因子(Eta)随着频率的增大表现出的非牛顿流体行为相一致(如图8所示)。

图8 2%~4%、2%~6%、2%~8%、2%~10%CSPEG-AC/PEGDA水凝胶随相应频率作用下的损耗因子(应变和温度分别为1%和37℃)Fig.8 Eta of 2%~4%,2%~6%,2%~8%,2%~10%CS-PEG-AC/PEGDA hydrogels as a function of compressing frequency(Strain and temperature were set as 1%and 37℃,respectively)
3 结论
(1)合成了mPEG接枝率为16%、丙烯酰氯接枝10%的可交联聚合的水溶性壳聚糖(CS-PEGAC)。CS-PEG-AC在光引发剂(Irgacure2959)的引发下聚合,形成水凝胶,反应条件温和。
(2)水凝胶吸收水分后可以溶胀至原重量13.2倍到22.6倍。当PEGDA含量增加时,交联密度较高、水凝胶的平衡溶胀比较低。水凝胶的粘弹性实验表明水凝胶的储能模量在0.8kPa~1kPa,损耗模量在0.2Pa~100Pa。交联密度较高的水凝胶,储能模量和损耗模量也相对较高。在含溶菌酶的PBS中降解相对较慢。
[1]E Marsano,E Bianchi,S Vicini,L Compagnino,A Sionkowska,J Skopińska,M Wis'niewski.Stimuli responsive gels based on interpenetrating network of chitosan and poly(vinylpyrrolidone)[J].Polymer,2005,46(5):1595-1600.
[2]Allan S Hoffman.Hydrogels for biomedical applications[J].Advanced drug delivery reviews,2002,54(1):3-12.
[3]Langer R and Vacanti J P.Tissue engineering[J].Science,1993,260,920.
[4]Wang D A,Williams C G,Li Q,Sharma B,Elisseeff J H.Synthesis and characterization of a novel degradable phosphate-containing hydrogel[J].Biomaterials,2003,24(22):3969-80.
[5]Gong Y,He L,Li J,Zhou Q,Ma Z,Gao C,Shen J.Hydrogel-filled polylactide porous scaffolds for cartilage tissue engineering[J].J Biomed Mater Res B Appl Biomater,2007,82(1):192-204.
[6]G M Cruise,D S Scharp,J A Hubbell.Characterization of permeability and network structure of interfacially photopolymerized poly(ethylene glycol)diacrylate hydrogels[J].Canadian Metallurgical Quarterly,1998,19(14):1287-1294.
[7]Wang D A,Williams C G,Yang F,Cher N,Lee H,Elisseeff J H.Bioresponsive phosphoester hydrogels for bone tissue engineering[J].Tissue Eng,2005,11(1-2):201-13.
[8]Hong Y,Song H,Gong Y,Mao Z,Gao C,Shen J.Covalently crosslinked chitosan hydrogel:properties of in vitro degradation and chondrocyte encapsulation[J].Acta Biomater,2007,3(1):23-31.
[9]Wang Dong-An,Varghese Shyni,Sharma Blanka,Strehin Iossif,Fermanian Sara,Gorham Justin,Fairbrother D Howard,Cascio Brett,Elisseeff Jennifer H.Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration[J].Nature materials,2007,6(5):385-392.
[10]Shu X Z,Liu Y,Palumbo F,Prestwich G D.Disulfide-crosslinkedhyaluronan-gelatinhydrogel films:a covalent mimic of the extracellular matrix for in vitro cell growth[J].Biomaterials,2003,24(21):3825-34.
[11]Yihong Gong,Chunming Wang,Ruenn Chai Lai,Kai Su,Feng Zhanga and Dong-an Wang.An improvedinjectablepolysaccharidehydrogel:modified gellan gum for long-term cartilage regenerationin vitro[J].J.Mater.Chem,2009,19:1968-1977.
[12]Yan-ming Dong,Wei Mao,Hui-wu Wang,Ya-qing Zhao,Dan-xia Bi,Liu-lin Yang,Qiang Ge,Zi-qi Ou.Electron microscopic studies on planar texture and disclination of cholesteric mesophases in acyloyl chitosan/acrylic acid composite films[J].Carbohydrate Polymers,2006,65(1):42-48.
[13]Karakeçili A G,Satriano C,Gümüşderelioˇglu M,Marletta G.Enhancement of fibroblastic proliferation on chitosan surfaces by immobilized epidermal growth factor[J].Acta biomaterialia,2008,4(4):989-996.
[14]Aksungur P,Sungur A,Unal S,Iskit A B,Squier C A,Senel S.Chitosan delivery systems for the treatment of oral mucositis:in vitro and in vivo studies[J].J Control Release,2004,98(2):269-79.
[15]I M El-Sherbiny,E M Abdel-Bary,D R K Harding.Preparation and in vitro evaluation of new pH‐sensitive hydrogel beads for oral delivery of protein drugs[J].Journal of Applied Polymer Science,2009,115(5):2828-2837.
[16]Liu Zonghua,Jiao Yanpeng,Zhang Ziyong.Calcium-carboxymethyl Chitosan Hydrogel Base for Protein Drug Delivery System[J].J.Appl.Polym.Sci,2007,103:3164-3168.
[17]Francesco M Veronese,J Milton Harris.Introduction and overview of peptide and protein pegylation[J].Advanced Drug Delivery Reviews,2002,54(4):453-456.
[18]Jian Li,Wei-Dong He,Ning He,Shou-Chen Han,Xiao-Li Sun,Li-Ying Li,Bo-Yu Zhang.Synthesis of PEG-PNIPAM-PLys hetero-arm star polymer and its variation of thermo-responsibility after the formation of polyelectrolyte complex micelles with PAA[J].Journal of Polymer Science Part A:Polymer Chemistry,2009,47(5):1450-1462.
[19]Hiroki Kiuchi,Weihua Kai,Yoshio Inoue Preparation and characterization of poly(ethylene glycol)crosslinked chitosan films.Journal of Applied Polymer Science,2007,107(6):3823-3830.

