酰亚胺二羧酸的合成研究
王玲珑,潘鹤林,李盛玉,高婷,曹正国,任伟
(1华东理工大学化工学院,上海200237;2江苏正丹化学工业股份有限公司,江苏镇江212132)
聚酰胺酰亚胺(PAI)是一种热塑性树脂,其分子主链中同时含有酰胺基团和酰亚胺基团。PAI凭借优良的耐热性、机械性能和化学稳定性,在诸多领域尤其是电器行业得到广泛的应用。以偏苯三酸酐(TMA)为原料合成PAI,经典方法是酰氯路线和二异氰酸酯路线[1-3]。酰氯路线是先由TMA制备偏苯三酸酐酰氯,再与二元胺缩聚得到PAI。二异氰酸酯路线采用二异氰酸酯与TMA进行聚合,通常可以细分为直接法、预聚体法和整合法。工业生产多采用酰氯路线,但合成中产生氯化氢气体使得该方法环保性欠佳;二异氰酸酯路线合成PAI,存在操作繁杂、反应不易控制等缺点。
目前,Yamazaki磷酸化反应[4-5]广泛用于PAI的合成。此方法是利用酰亚胺二羧酸(DIDA)与二元胺,以亚磷酸三苯酯为缩合试剂,在含有金属盐氯化钙的N-甲基吡咯烷酮/吡啶混合溶剂中直接缩聚得到PAI。使用该方法时,DIDA是重要的单体。本文以TMA为原料,分别与4,4'-二氨基二苯醚、4,4'-二氨基二苯甲烷、1,6-己二胺,通过甲苯共沸脱水得到三种酰亚胺二羧酸,并对其结构进行表征。采用单因素法,具体考察了溶剂用量、酰亚胺化阶段的反应时间和反应温度、反应物摩尔比对产率的影响,由此确定优化的合成条件。
1 实验部分
1.1 原料与试剂
TMA,纯度≥99.5%,江苏正丹化学工业股份有限公司;4,4'-二氨基二苯醚,纯度≥98.0%,上海馨晟试化工科技有限公司;4,4'-二氨基二苯甲烷,纯度≥98.5%,上海馨晟试化工科技有限公司;1,6-己二胺,纯度≥99.0%,上海凌峰化学试剂有限公司;N-甲基吡咯烷酮(NMP),分析纯AR,上海天莲精细化工有限公司;甲苯,分析纯AR,上海凌峰化学试剂有限公司。
1.2 实验仪器
Nicolet Magna-IR 550型红外光谱仪,KBr压片;Bruker Vance 500MHz型核磁共振仪,核磁试剂为DMSO-d6。
1.3 酰亚胺二羧酸的合成
以4,4'-双(N-偏苯三酰亚胺基)二苯醚(DIDA-a)的合成为例:在装有机械搅拌装置、温度计、氮气导入管、分水及冷凝装置的250mL四口烧瓶中,依次加入19.2g(0.1mol)偏苯三酸酐、10.0g(0.05mol)4,4'-二氨基二苯醚、90mL N-甲基吡咯烷酮,于60℃~70℃反应2h,加入35mL甲苯,升温至140℃回流脱水反应6h,反应最后阶段蒸出甲苯,冷却,将产物倾入冷水中,析出黄色固体,抽滤,用去离子水反复洗涤,用NMP/水混合液重结晶,烘箱中干燥,称重26.7g,产率为97.4%。
按类似方法合成4,4'-双(N-偏苯三酰亚胺基)二苯基甲烷(DIDA-b)、1,6-双(N-偏苯三酰亚胺基)己烷(DIDA-c)。具体合成路线如图1所示。

图1 酰亚胺二羧酸的合成路线Figure 1Synthesis routine of diimide diacid
2 结果与讨论
2.1 酰亚胺二羧酸的结构表征
4,4'-双(N-偏苯三酰亚胺基)二苯醚(DIDA-a)的结构表征。
FT-IR:3482.7cm-1,羧基中羟基的振动峰;1780.2cm-1,酰亚胺环中羰基的非对称伸缩振动峰;1722.3cm-1,酰亚胺环中羰基的对称伸缩振动峰和羧基中羰基的伸缩振动峰;1390.9cm-1,酰亚胺环中碳氮键的振动峰;1098.9cm-1、722.2cm-1,酰亚胺环的弯曲振动峰。

图2 DIDA-a的红外光谱图Figure 2IR spectrum of DIDA-a
1H NMR(DMSO-d6),δ:13.76(2Ha,s);8.33(2Hb,s);8.42~8.44(2Hc,d);8.09~8.11(2Hd,d);7.52~7.54(4He,d);7.26~7.28(4Hf,d)。
4,4'-双(N-偏苯三酰亚胺基)二苯基甲烷(DIDA-b)的结构表征。

图3 DIDA-b的红外光谱图Figure 3IR spectrum of DIDA-b
FT-IR:3476.9cm-1,羧基中羟基的振动峰;1777.4cm-1,酰亚胺环中羰基的非对称伸缩振动峰;1719.4cm-1,酰亚胺环中羰基的对称伸缩振动峰和羧基中羰基的伸缩振动峰;1386.6cm-1,酰亚胺环中碳氮键的振动峰;1100.8cm-1、725.8cm-1,酰亚胺环的弯曲振动峰。
1H NMR(DMSO-d6),δ:13.72(2Ha,s);8.31(2Hb,s);8.41~8.43(2Hc,d);8.08~8.09(2Hd,d);7.41~7.47(8He,f,d);4.11(2Hg,s)。
1,6-双(N-偏苯三酰亚胺基)己烷(DIDA-c)的结构表征。

图4 DIDA-c的红外光谱图Figure 4IR spectrum of DIDA-c
FT-IR:3461.1cm-1,羧基中羟基的振动峰;1775.0cm-1,酰亚胺环中羰基的非对称伸缩振动峰;1697.0cm-1,酰亚胺环中羰基的对称伸缩振动峰和羧基中羰基的伸缩振动峰;1405.2cm-1,酰亚胺环中碳氮键的振动峰;1085.0cm-1、731.0cm-1,酰亚胺环的弯曲振动峰。

2.2 酰亚胺化反应脱水剂及溶剂选择
合成酰亚胺二羧酸时,反应分为两个阶段:(1)偏苯三酸酐的酸酐基团与二元胺的氨基发生开环反应,得到酰胺酸中间体;(2)酰胺酸中间体在较高温度(120℃以上)时脱水环化得到二酸。亚胺化反应阶段可以采用甲苯共沸脱水进行环化,也可以采用乙酸酐[6]、乙酸/吡啶[7-8]、乙酸酐/吡啶[9]、冰醋酸[10-11]等反应体系进行环化,其中共沸脱水环化具有亚胺化程度高的特点。反应中选择的溶剂必须不含活泼氢,以避免与酸酐基团发生反应,同时要对反应物和产物具有良好的溶解能力。综合上述考虑,常选用极性非质子溶剂,具体包括N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基吡咯烷酮、环丁砜等。
2.3 反应影响因素考察
2.3.1溶剂用量
合成酰亚胺二羧酸时,溶剂的用量对反应有明显影响,具体如图5所示。溶剂用量过少时,反应物局部浓度过高,不利于反应物在溶剂中分散形成均相条件,从而导致最终二酸产率偏低;溶剂用量过多时,反应物起始浓度过低,不同反应物分子之间碰撞机率减少,会导致反应速率下降。

图5 溶剂用量对二酸产率的影响Figure 5Effect of solvent amount on the yield of diacid
2.3.2酰亚胺化反应时间
本实验在4h~7h的时间范围内考察酰亚胺化反应时间对二酸产率的影响。由图6可知,二酸产率最初随着反应时间的增加而提高,这说明适当延长反应时间有利于酰亚胺化反应的进行;但反应时间过长,会导致发生的副反应增多,最终导致二酸产率下降。
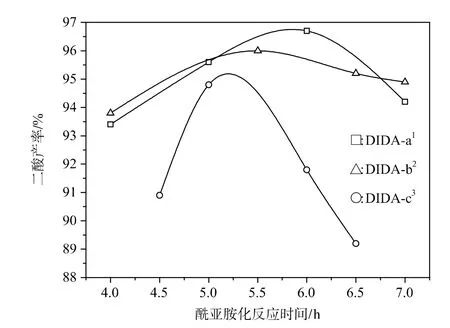
图6 酰亚胺化反应时间对二酸产率的影响Figure 6Effect of imidization reaction time on the yield of diacid
2.3.3酰亚胺化反应温度
酰胺酸中间体脱水环化是一个吸热反应,通常需要在高于120℃的条件下才能顺利进行。由图7可知,在125℃~160℃的温度范围内,适当升高反应温度可以增加酰亚胺化反应活性,提高二酸产率;但反应温度过高,也会促进副反应发生,导致二酸产率下降。此外,N-甲基吡咯烷酮溶剂在较高温度下也容易发生分解,对二酸合成产生不利影响。
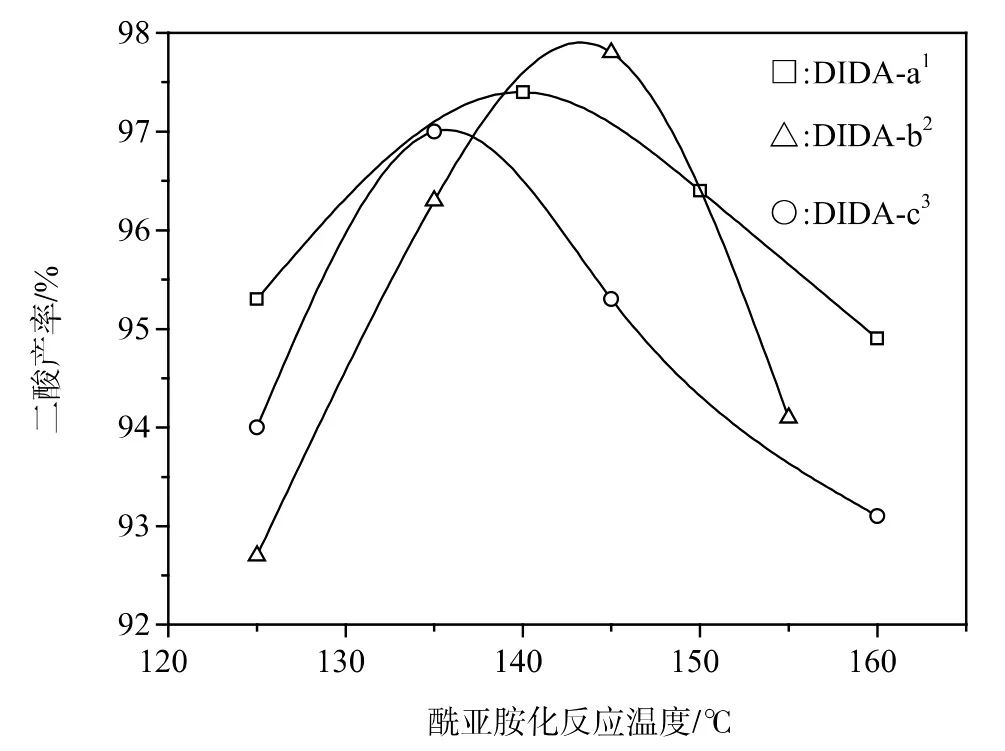
图7 酰亚胺化反应温度对二酸产率的影响Figure 7Effect of imidization reaction temperature on the yield of diacid
2.3.4反应物摩尔比
偏酐与二胺合成酰亚胺二羧酸,理论上二者摩尔比为2∶1。实际反应中若摩尔比小于2,则过量的二胺可能与酰亚胺二羧酸生成低分子量的预聚物,导致二酸产率偏低;同时过量的二胺在高温条件下也容易被氧化生成副产物。因此实际投料中常使偏酐稍过量,由图8可知,偏酐与二胺的摩尔比在2.02~2.05之间较适宜。过量的偏酐可以在重结晶过程中水解为偏苯三甲酸而除去。

图8 反应物摩尔比对二酸产率的影响Figure 8Effect of reactant mole ratio on the yield of diacid
3 结论
偏苯三酸酐在N-甲基吡咯烷酮溶剂中,分别与4,4'-二氨基二苯醚、4,4'-二氨基二苯甲烷、1,6-己二胺,通过共沸脱水反应得到三种酰亚胺二羧酸——DIDA-a、DIDA-b和DIDA-c。三种二酸的结构通过FT-IR和1H NMR进行表征确认。通过单因素考察,得到DIDA-a的优化合成条件:偏酐起始浓度1.11mol/L,反应时间6h,反应温度140℃,偏酐和二胺摩尔比2.05;DIDA-b的优化合成条件:偏酐起始浓度1.05mol/L,反应时间5.5h,反应温度145℃,偏酐和二胺摩尔比2.02;DIDA-c的优化合成条件:偏酐起始浓度0.95mol/L,反应时间5h,反应温度135℃,偏酐和二胺摩尔比2.03。
[1]陈立军,等.聚酰胺酰亚胺的制备及其应用[J].绝缘材料,2005,(5):61-64.
[2]潘鹤林,等.偏苯三酸酐与聚酰胺酰亚胺材料[J].合成材料老化与应用,2013,42(1):21-27.
[3]李生柱.第一个工业化可注射模塑的聚酰亚胺—聚酰胺酰亚胺[J].化工新型材料,2006,34(12):63-66、69.
[4]Yamazaki N,Higashi F,Kawabata J.Studies on reactions of the N-phosphonium salts of pyridines.XI.preparation of polypeptides and polyamides by means of triarylphosphites in pyridine[J].Journal of Polymer Science:Polymer Chemistry E-dition,1974,12:2149-2154.
[5]Yamazaki N,Matsumoto M,Higashi F.J.Studies on reactions of the N-phosphonium salts of pyridines.XIV.Wholly aromatic polyamides by the direct polycondensation reaction by using phosphites in the presence of metal salts[J].Journal of Polymer Science:Polymer Chemistry Edition,1975,13:1373-1380.
[6]Jonquieres A,Vicherat A,Lochon P.Synthesis and characterization of new polyamideimides with a highly flexible soft block[J].Journal of Polymer Science:Part A:Polymer Chemistry,1999,37:2873-2889.
[7]Faghihi K,Hajibeygi M.Synthesis and properties of new poly(amide imide)s containing trimellitic rings and hydantoin moieties in the main chain under microwave irradiation[J].Journal of Applied Polymer Science,2004,92:3447-3453.
[8]Faghihi K,Naghavi H.New poly(amide imide)s containing bis(4-trimellitimidophe-nyl)sulfone and hydantoin moieties in the main chain:synthesis and properties[J].Journal of Applied Polymer Science,2005,96:1776-1782.
[9]Liaw D J,Liaw B Y,Tseng J M.Synthesis and characterization of novel poly(amide-imide)s containing hexafluoroisopropylidene linkage[J].Journal of Polymer Science:Part A:Polymer Chemistry,1999,37:2629-2635.
[10]Behniafar H,Banihashemi A.Synthesis and characterization of new soluble and thermally stable aromatic poly(amide-imide)s based on N-[3,5-bis(N-trimellitoyl)phe-nyl]phthalimide[J].European Polymer Journal,2004,40:1409-1415.
[11]Ebrahim A L,Abbas S,Ali J.Heat-resistant and soluble fluorinated poly(amide-imide)s based on non-coplanar ortho-linkeddiimide-dicarboxylic acid[J].Polymer Degradation and Stability,2011,96:1022-102.

