新型骨科植入物镁合金材料抗菌性能的体外实验研究
王湛,杨军,李建军
(中国医科大学盛京医院骨科,沈阳110004)
新型骨科植入物镁合金材料抗菌性能的体外实验研究
王湛,杨军,李建军
(中国医科大学盛京医院骨科,沈阳110004)
In vitro ExperimentalStudy on the AntibacterialPropertiesof New Orthopedic Implant Material-magnesium Alloy
采用金黄色葡萄球菌/大肠杆菌与金属材料共培养的体外实验方法,探讨骨科内植入金属材料——新型镁合金的抗菌性能。采用分光光度计检测不同培养时间混合培养液中的细菌含量。结果显示:随着培养时间的延长,镁及镁合金材料均呈现金黄色葡萄球菌/大肠杆菌生长抑制的现象,而与之相对照的目前在临床上常用的骨科植入物——钛合金未见细菌生长抑制的效果。
镁合金;生物材料;骨折;骨内置物;抗菌性
临床上,固定是骨折治疗的核心部分。20世纪60年代,由AO/ASIF组织提出的绝对稳定以及坚强固定治疗理念被广为接受。近年来,随着材料科学的进步,内固定材料的选择受到广泛关注,而理想的内固定材料应具有良好的生物相容性、良好的机械强度、合适的硬度、适当的可降解性及较少的并发症。
目前,在骨缺损及骨折的临床治疗中广泛应用的内固定材料主要有不锈钢、钛合金以及钴合金等金属生物材料。自2l世纪初以来,以新型镁合金为主要代表的具有生物可降解特性的新一代医用金属材料被人们所认识。镁合金的优势在于其密度及弹性模量均与人体接近,可以有效缓解应力屏蔽效应对骨组织生长的不良影响,其降解产物镁离子也是人体必需的常量元素之一[1]。此外,研究表明,镁离子还具有促进成骨细胞增殖的特性,可以缩短骨折愈合的时间。由此可见,可降解的镁合金成为了一种潜力巨大的新型植入物材料,被誉为“革命性的金属生物材料”。
目前,国内外关于镁合金的研究主要集中于体内降解的过程和机制、生物安全性、生物相容性等方面,关于镁合金抗菌性能的研究较少。研究显示,金黄色葡萄球菌与大肠杆菌是骨折内固定术后感染与骨髓炎最常见的致病菌[2]。本研究拟采用金黄色葡萄球菌/大肠杆菌与金属材料共培养的体外实验方法,探讨新型镁合金的抗菌性能,旨在促进镁合金材料在骨折等疾病治疗中的有效利用。
1 材料与方法
1.1 材料
镁及镁合金材料分别为:Mg、Mg3Zn、Mg3Zn1Ag、 Mg3Zn3Ag,钛合金(Ti6Al4V)(东北大学材料各向异性与织构教育部重点实验室提供)。金黄色葡萄球菌、大肠杆菌(中国医科大学病原生物教研室提供)。
1.2 方法
1.2.1 实验分组:(1)金黄色葡萄球菌与金属材料共培养实验:将样品分为单纯金葡菌(S.aureus)组、金葡菌+Mg(S.aureus+Mg)组、金葡菌+Mg3Zn(S.aureus+Mg3Zn)组、金葡菌+ Mg3Zn1Ag(S.aureus+Mg3Zn1Ag)组、金葡菌+Mg3Zn3Ag(S. aureus+Mg3Zn3Ag)组、金葡菌+Ti6Al4V(S.aureus+Ti6Al4V)组,共6组,每组5份样品。(2)大肠杆菌与金属材料共培养实验:将样品分为单纯大肠杆菌(E.coli)组、大肠杆菌+Mg((E. coli+Mg)组、大肠杆菌+Mg3Zn(E.coli+Mg3Zn)组、大肠杆菌+ Mg3Zn1Ag(E.coli+Mg3Zn1Ag)组、大肠杆菌+Mg3Zn3Ag(E. coli+Mg3Zn3Ag)组、大肠杆菌+Ti6Al4V(E.coli+Ti6Al4V)组,共6组,每组5份样品。
1.2.2 细菌培养基制备及细菌培养:称取牛肉膏3.0 g、蛋白胨10.0 g、氯化钠5.0 g,在石棉网上加热溶于600 mL蒸馏水中,利用HCl及NaOH调节溶液pH至7.4,加入蒸馏水定容至1 L。分装入三角烧瓶内,包扎,加塞后,以0.1 MPa、121℃高压蒸汽灭菌15 min,待用。
利用细菌比浊仪,分别将金黄色葡萄球菌和大肠杆菌菌株以制备好的肉汤培养基调节浓度至0.5麦氏单位(菌量约为1×108/mL),分别取1 mL接种至100 mL肉汤培养基内,放入37℃二氧化碳恒温培养箱内培养20 h,作为细菌原液。
1.2.3 金属合金材料处理:将钛合金块及4种镁合金块用砂纸打磨光滑,去除表面氧化层。在无水乙醇中超声波震荡清洗15 min,然后在蒸馏水中超声波震荡清洗15 min,分装后以0.1 MPa、121℃高压蒸汽灭菌15 min。
1.2.4 细菌与金属合金材料混合培养:在10 mL PE离心管内放入1个直径1 cm、高1 cm的圆柱形合金块。每毫升浸提液体积对标准表面积比例参照GBP16886.12-2000[3],浸提比例为1.25 cm2/mL,每个管内加入3 mL肉汤培养基,再按照实验分组,分别加入0.3 mL已制备好的相应的细菌原液,做好标记。对照组加入3 mL肉汤培养基,及0.3 mL已制备好的相应的细菌原液。将离心管置于37℃、200 r/min条件下震荡培养。
在混合培养的第0、2、4、8、24、48、72 h取出,采用分光光度法测定细菌含量。将培养液加入96孔板中,在490 nm波长下,测定OD值。
1.3 统计学分析
采用SPSS 13.0统计软件进行统计学分析,所有实验数据采用表示,各组均数间差异的比较应用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 金黄色葡萄球菌与金属合金材料共培养实验结果
如表1所示:单纯金葡菌组随着培养时间的延长菌量逐渐增多,24 h达到峰值,约为基础菌量(0 h)的5.28倍,并持续保持近似水平至72 h。金葡菌+Ti6Al4V组菌量的变化趋势与单纯金葡菌组相似,24 h时明显增多,48 h达到峰值,约为基础菌量(0 h)的5.24倍。而金黄色葡萄球菌与镁及镁合金共培养组则显示出明显的抑菌效果,金葡菌+Mg组菌量峰值出现在24 h,金葡菌+Mg3Zn、金葡菌+Mg3Zn1Ag及金葡菌+Mg3Zn3Ag组均出现在8 h,各组分别为基础菌量的1.83、2.16、2.17和2.13倍,明显低于单纯金葡菌组和金葡菌+ Ti6Al4V组,特别是24~72 h期间的长期抑菌效果尤为明显。金葡菌+Mg组也显示出较强的抑菌效果。说明在此培养条件下镁具备抑菌能力。在镁合金材料中,随着合金材料中银(Ag)含量增多,抑菌效果也出现增强的趋势。
2.2 大肠杆菌与金属合金材料共培养实验结果
表1 不同时间点金黄色葡萄球菌与金属合金块混合培养液OD490nm值
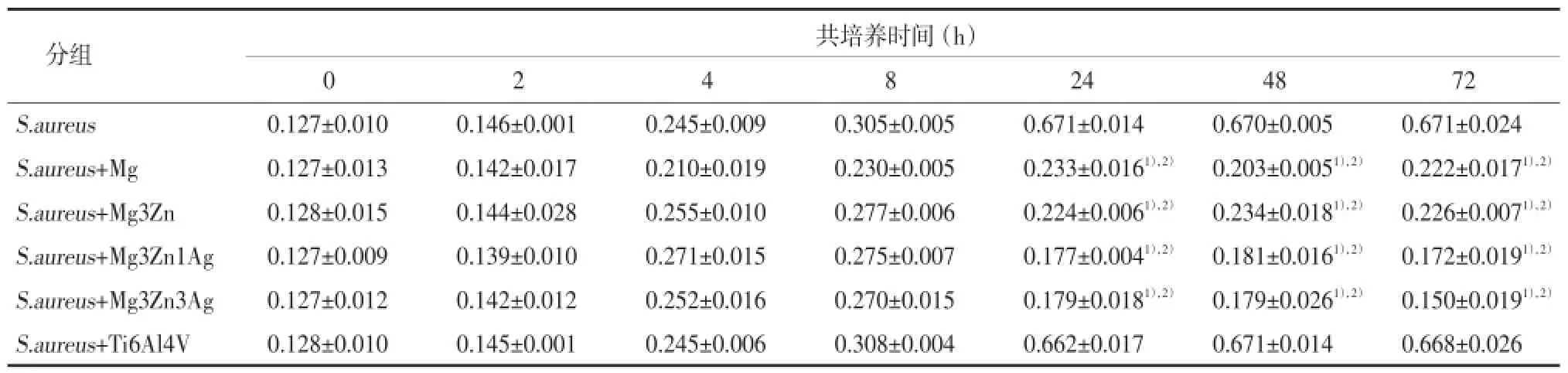
表1 不同时间点金黄色葡萄球菌与金属合金块混合培养液OD490nm值
注:1)与单纯金葡菌组比较,P<0.01;2)与金葡菌+Ti6Al4V组比较,P<0.01.
如表2所示:随着培养时间的延长,单纯大肠杆菌组菌量逐渐增多,24 h开始明显增多,72 h达到峰值,约为基础菌量(0 h)的4.71倍。大肠杆菌与钛合金共培养组菌量的变化趋势与单纯大肠杆菌组相似,24 h达到峰值,约为基础菌量(0 h)的4.63倍,并持续保持高水平。相反,大肠杆菌与镁及镁合金共培养则显示出明显的抑菌效果,大肠杆菌+Mg组、大肠杆菌+Mg3Zn组、大肠杆菌+Mg3Zn1Ag组及大肠杆菌+ Mg3Zn3Ag组菌量峰值均出现在8 h,分别为基础菌量的1.89、1.87、1.79和1.71倍,明显低于单纯大肠杆菌组和大肠杆菌+Ti6Al4V组。同样,24~72 h的长期抑菌效果更为明显。提示了镁的抑菌效果,而且也同样表现出随着合金中银(Ag)含量增多,对大肠杆菌的抑菌效果也逐渐增强的效应。
表2 不同时间点大肠杆菌与金属合金块混合培养液OD490nm值

表2 不同时间点大肠杆菌与金属合金块混合培养液OD490nm值
注:1)与单纯大肠杆菌组比较,P<0.01;2)与大肠杆菌+Ti6Al4V组比较,P<0.01.
3 讨论
一般情况下具有抗菌效果的金属元素主要以其离子形式发挥作用,在高浓度金属离子的局部环境中,通过各种机制影响细菌的生长。镁在液体环境中能够通过电化学反应降解,产生氢氧化镁及氢气,反应式如下:
阳极反应:Mg→Mg2++2e
阴极反应:2H2O+2e→2H2+2OH-
产物生成反应:Mg2++2OH-→Mg(OH)2
总反应:Mg+2H2O→Mg(OH)2+H2
在液体环境中,Mg(OH)2会不断积聚在镁的表面形成保护层,能够减慢镁的降解速率[4],这是镁合金适合应用于体内内固定材料所需的特质。
细菌正常生长所需环境的最适pH值为7.4~7.6[5]。根据上述反应式,镁在降解时会产生大量的OH-,造成局部的pH值升高。这种局部的碱性环境会对细菌的正常生长产生影响,从而可以达到抗菌的目的。此外,镁作为二价金属离子抑菌的机制还可能涉及以下方面:当细菌胞膜外存在高浓度的金属阳离子时,会使正常细胞内外极化状态发生改变,造成新的离子浓度差,从而阻碍一些细胞生长所必需的物质的转运。研究表明,某些金属离子可以使细胞内部分酶失活,影响细胞正常的生化反应,导致细胞的能量与物质代谢紊乱,进而抑制细菌的生长。金属离子使细胞内的酶失活的原理目前还不清楚,有学者认为可能是正价金属离子与巯基结合,置换出酶本身的离子,使其正常结构遭到破坏而失活[3]。另外,进入细胞内的金属离子也可以破坏细胞的核酸结构,影响细胞的正常分裂[6]。
镁合金常见的构成元素有锌、铝、锰、钙、银以及稀土元素等,这些元素可以影响镁的物理性能和机械性能。当这些金属元素与镁结合时,可以有效的提高其机械强度和韧性。Witte等[7]报道了4种镁合金(AZ31、AZ91、WE43、LAE442)和聚乳酸材料(SR-PLA96)在动物体内的降解情况。通过实验发现,镁与添加的适量合金元素能有效改善材料的机械强度及在体内的降解速率,其中含有锌的2种合金AZ31(3%Al+ 1%Zn)及AZ91(9%Al+1%Zn)具有相对较快的降解速率。由于锌离子是人体的一种基本微量元素,与一系列人体正常生理活动密切相关,在维持内环境稳态中也起着重要的作用。因此,本研究选择金属锌作为镁合金的一种重要组成部分。而加入金属元素银可以更好地提高镁合金的机械性能,且银离子也具有一定的抗菌性,可以增强镁合金的抑菌效果。关于Ag+的抗菌性原理,有研究认为Ag+能够从溶液中降解出来,直接与细菌接触,抑制及杀灭细菌[8],Ag+结合蛋白酶巯基的能力很强,能够破坏细胞内蛋白酶的功能,使细菌的正常生长繁殖受到抑制[9]。
镁合金与目前骨科常用的具有抗菌素涂层的钛合金植入物相比,具有更好的生物安全性、机械性能以及生物相容性。Castellani等[10]将镁合金短棒植入大鼠股骨,与钛合金相对比,24周后镁合金组的拔出力明显高于钛合金组,提示镁合金比钛合金具有更好的植入物-骨界面强度,且镁合金组未出现炎性反应及血细胞数量、比例变化,肝、肾功能及血中电解质浓度亦无异常。此外,镁合金的可降解特性可避免骨折愈合后行二次植入物取出手术,不仅可以减轻患者的痛苦,也可减少临床的风险和负担。
目前的研究已经证实,镁合金具有可降解性、良好的生物相容性和一定的机械强度,是一种非常有潜在应用价值的新型金属植入物材料。本研究结果亦发现镁及镁合金与革兰阳性菌——金黄色葡萄球菌及革兰阴性菌——大肠杆菌共培养时均显示出明显的抗菌作用,这将有利于防止骨折内置物感染以及骨髓炎的发生。然而,目前尚无镁合金抗菌性体内实验的完善资料,此外,还需对镁合金的非细胞毒性以及体内组织的生物学反应进行深入系统的研究,以期将其尽早、安全、有效地应用于临床。
[1]Moravej M,Mantovani D.Biodegradable metals for cardiovascular stent application:interests and new opportunities[J].Int J Mol Sci,2011,12(7):4250-4270.
[2]Murray CK,Obremskey WT,Hsu JR,et al.Prevention of infections associated with combat-related extremity injuries[J].J Trauma,2011,71(2):235-257.
[3]Mwaanga P,Carraway ER,van den Hurk P.The induction of biochemical changes in Daphnia magna by CuO and ZnO nanoparticles[J].Aquat Toxicol,2014,150:201-209.
[4]Mistry D,Powles N.The relative hydrolytic reactivities of pyrophosphates and pyrophosphates[J].Org Biomol Chem,2013,11(34):5727-5733.
[5]Mukherjee S,Barman S,Mandal NC,et al.Anti-bacterial activity of Achatina CRP and its mechanism of action[J].Indian J Exp Biol,2014,52(7):692-704.
[6]Li H,Huang XX,Cai Y,et al.Label-free detection of Cu2+and Hg2+ions using reconstructed Cu2+-specific DNAzyme and G-quadruplex DNAzyme[J].PLoS One,2013,8(9):e73012.
[7]Witte F,Fischer J,Nellesen J,et al.In vitro and in vivo corrosion measurements of magnesium alloys[J].Biomaterials,2006,27(7):1013-1018.
[8]Bondarenko O,Ivask A,Käkinen A,et al.Particle-cell contact enhances antibacterial activity of silver nanoparticles[J].PLoS One,2013,8(5):e64060.
[9]Lim PN,Chang L,Tay BY,et al.Proposed mechanism of antibacterial action of chemically modified apatite for reduced bone infection[J].Appl Mater Interfaces,2014,6(19):17082-17092.
[10]Castellani C,Lindtner RA,Hausbrandt P,et al.Bone-implant interface strength and osseointegration:biodegradable magnesium alloy versus standard titanium control[J].Acta Biomater,2011,7(1):432-440.
(编辑 王又冬)
R318
A
0258-4646(2014)12-1142-03
王湛(1990-),男,硕士研究生.
杨军,E-mail:yangj1@sj-hospital.org
2014-10-10
网络出版时间:

