百草枯对巨噬细胞的毒性作用及ROS、IL⁃6和TNF⁃α产生的影响
陈瑶,崇巍,王丹娜,赵倩雯,邓云蕾
(中国医科大学附属第一医院急诊科,沈阳110001)
百草枯对巨噬细胞的毒性作用及ROS、IL⁃6和TNF⁃α产生的影响
陈瑶,崇巍,王丹娜,赵倩雯,邓云蕾
(中国医科大学附属第一医院急诊科,沈阳110001)
目的研究百草枯对巨噬细胞的毒性作用及对活性氧(ROS)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)产生的影响。方法不同浓度百草枯作用小鼠巨噬细胞RAW264.7,分别在1,2,8 h收取细胞和细胞培养液,检测细胞生存率及细胞内ROS(化学荧光法),细胞培养液IL-6、TNF-α(ELISA法)。结果在实验观察的8 h内,0.001、0.01、0.1 mmol/L百草枯作用的RAW264.7存活率没有明显变化,10 mmol/L和1 mmol/L百草枯作用其存活率分别在2 h和8 h开始下降。1 h时,随着百草枯浓度增加,细胞内ROS荧光强度递增;从2 h开始,1 mmol/L和10 mmol/L百草枯细胞内ROS荧光强度下降。随着百草枯浓度从0.001 mmol/L增加到1 mmol/L,细胞培养液中的IL-6的浓度递增;当百草枯浓度增加到10 mmol/L时,细胞培养液中的IL-6浓度下降。细胞培养液中的TNF-α浓度随着百草枯浓度增加和作用时间的延长而增加(除外10 mmol/L百草枯作用8 h)。结论高浓度的百草枯对巨噬细胞产生毒性作用,适当浓度的百草枯使巨噬细胞ROS、IL-6及TNF-α的产生增加。
百草枯;巨噬细胞;活性氧;白细胞介素6;肿瘤坏死因子α
百草枯(paraquat,PQ),化学名为1,1′-二甲基-4,4′-联吡啶阳离子盐,是一种常见的快速灭生性除草剂,广泛应用于很多国家,特别是一些亚洲国家[1]。随着PQ在农业中广泛应用,国内急性中毒日趋增多。PQ对人畜毒性很高,目前仍缺乏有效的解毒剂,临床死亡率高达60%~80%[2]。氧化应激诱导的全身炎性反应综合征是其公认的致病机制,肺是主要的靶器官。越来越多的证据表明PQ产生的活性氧(reactive oxygen species,ROS)可通过作用于肺泡巨噬细胞导致肺部的严重损伤[3,4]。急性肺损伤可诱发多脏器功能不全综合征(multiple organ dysfunction syndrome,MODS)。即便患者能渡过急性期,晚期多死于肺间质纤维化所致的呼吸衰竭[5]。已有的地塞米松、强的松、环磷酰胺、血液灌洗、血液透析、肺移植,包括中医中药等治疗方法疗效均不确切,且常规的治疗措施对患者的长期生活质量和预后没有明显的改善作用[6~12]。巨噬细胞属于先天免疫系统,是防御病原体入侵的第一道防线,在炎症与修复、获得性免疫反应的协调以及组织稳态的维持过程中起着至关重要的作用。巨噬细胞作为炎性反应的重要启动者和调节者,ROS是其炎性活化的因子之一。本研究以小鼠巨噬细胞RAW264.7为研究对象,观察不同浓度PQ对巨噬细胞的毒性以及ROS、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)产生的影响。
1 材料与方法
1.1 材料
小鼠巨噬细胞RAW264.7(ATCC公司)在含有10%胎牛血清(Invitrogen公司)细胞培养液中及细胞培养箱中生长,细胞操作主要在超净操作台上完成。选择PQ(Sigma公司)的浓度梯度为0.001、0.01、0.1、1、10 mmol/L[1]。
1.2 方法
1.2.1 不同浓度PQ下RAW264.7细胞存活率检测:待75 cm2培养瓶(Corning公司)生长达到80%左右的接触率时,将细胞平均加入18个25 m2培养瓶(Corning公司)中,待瓶中的细胞生长达到80%左右接触率时,吸出上清,更换为0.5%胎牛血清细胞培养液,放回细胞培养箱过夜。次日取出25 m2培养瓶,每3个培养瓶为1个PQ浓度处理组,分别加入预先配制好的浓度分别为0.001、0.01、0.1、1、10 mmol/L PQ处理液,对照组为不含PQ的0.5%胎牛血清细胞培养液,将所有25 m2培养瓶放回细胞培养箱。分别在处理1 h、2 h和8 h时每组各取出1个培养瓶。吸出上清,离心后冻存待测。用台盼蓝溶液检测活细胞比率。
1.2.2 不同浓度PQ下RAW264.7内ROS的化学荧光法检测:将细胞悬液加入96孔黑色底透细胞培养板(Greiner公司)中,待细胞培养板中的细胞生长达到80%左右接触率时,吸出上清,更换为0.5%胎牛血清细胞培养液,放回细胞培养箱过夜。次日取出96孔细胞培养板,每3个细胞培养孔为1个PQ处理组,分别加入预先配制好的浓度分别为0.001、0.01、0.1、1和10 mmol/L PQ处理液,对照组加不含PQ的0.5%胎牛血清细胞培养液,将96孔细胞培养板放回细胞培养箱。分别在1 h、2 h和8 h后取出细胞培养板,PBS清洗2次后,加入DCFH-DA(Sigma公司),放回细胞培养箱。25 min后取出细胞培养板,置于CISBIO公司TECAN F200PRO Microplate Reader上检测ROS的荧光强度,激发波长为485 nm,发射波长为525 nm。
1.2.3 不同浓度PQ下RAW264.7细胞IL-6和TNF-α的ELISA法检测:细胞上清中IL-6和TNF-α使用R&D公司ELISA试剂盒检测,严格按试剂盒说明书步骤进行。
1.3 统计学分析
2 结果
2.1 PQ对RAW264.7细胞存活率的作用
不同浓度PQ作用RAW264.7细胞1 h时,RAW264.7细胞存活率未有明显改变。10 mmol/L PQ使RAW264.7细胞存活率在2 h时开始下降。1 mmol/L PQ和10 mmol/L PQ使RAW264.7细胞存活率在8 h时开始下降,10 mmol/L PQ的作用更为显著。见表1。
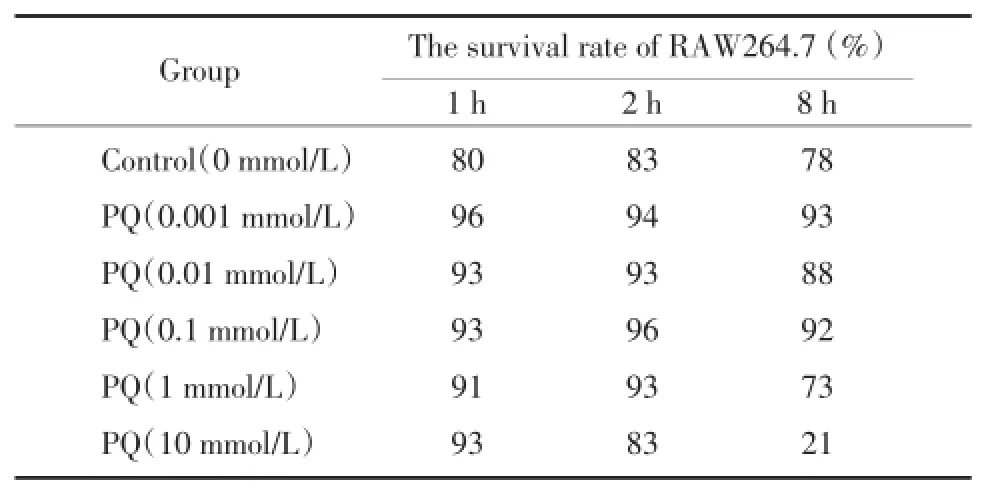
表1 不同浓度的PQ对RAW264.7生存率的作用Tab.1 Effect of PQ on the survival rate of RAW264.7
2.2 PQ对RAW264.7细胞内ROS的作用
不同浓度PQ作用RAW264.7细胞1 h时,细胞内ROS荧光强度随着PQ浓度的增加而加强。在2 h和8 h时,随PQ浓度从0.001 mmol/L增加到0.1 mmol/L,RAW264.7细胞内ROS荧光强度逐渐增强;当PQ浓度提高到1 mmol/L和10 mmol/L时,细胞内ROS荧光强度减弱。0.01 mmol/L PQ作用2 h和0.1 mmol/L PQ作用8 h,细胞内ROS荧光强度较同时间对照组显著增强(P<0.05)。见表2。
2.3 PQ对RAW264.7产生IL-6的作用
在实验观察的8 h之内,随着作用时间增加,同PQ浓度作用组细胞培养液中IL-6的浓度递增。不同浓度PQ作用RAW264.7细胞1 h时,0.001 mmol/L到0.1 mmol/L PQ使细胞培养液中IL-6的浓度较对照组显著增加(P<0.05)。不同浓度PQ作用RAW264.7细胞2 h时,0.001~10 mmol/L PQ使细胞培养液中IL-6的浓度较对照组显著增加(P<0.05)。不同浓度PQ作用RAW264.7细胞8 h时,0.001~1 mmol/L PQ使细胞培养液中IL-6的浓度较对照组显著增加(P<0.05)。见表3。
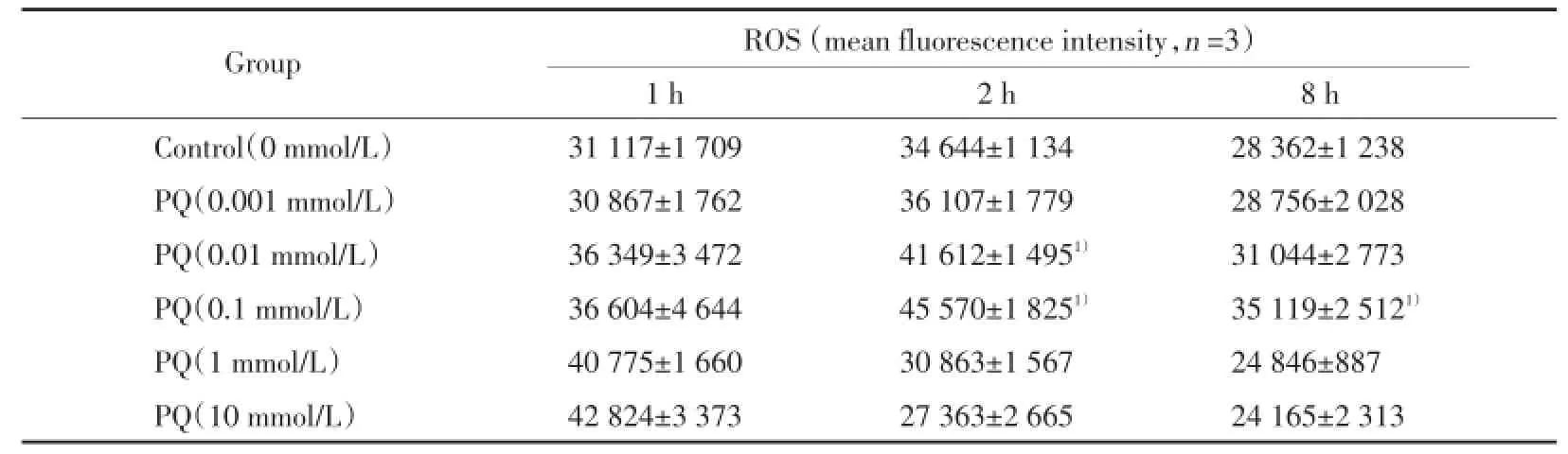
表2 不同浓度PQ对RAW264.7内ROS的作用Tab.2 Effect of PQ on ROS production of RAW264.7
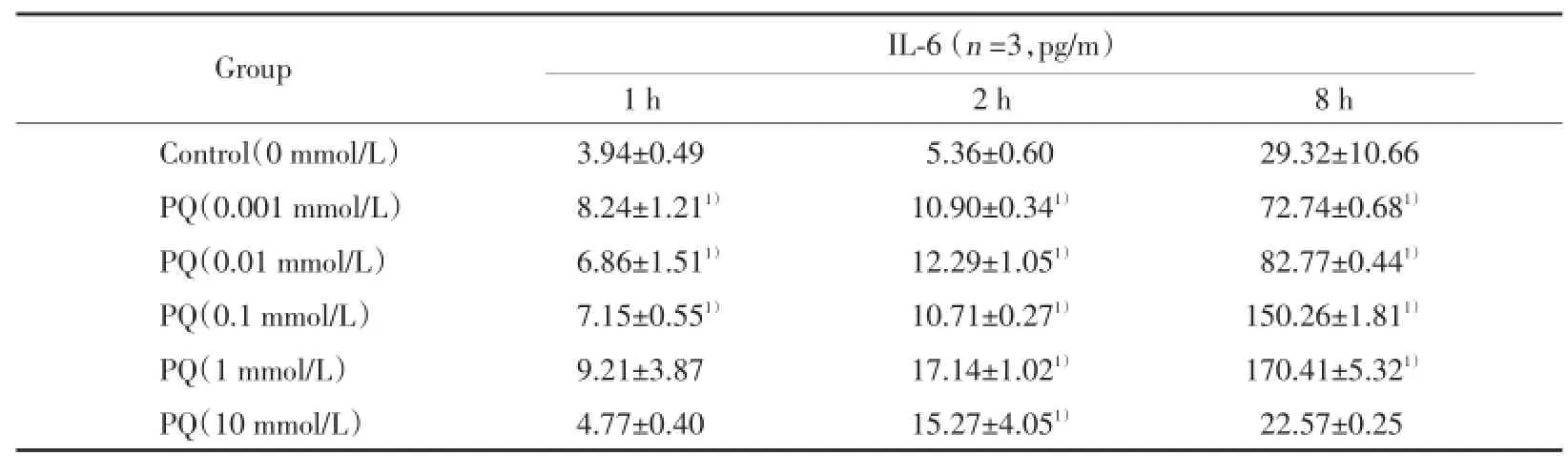
表3 不同浓度PQ对RAW264.7产生IL⁃6的作用Tab.3 Effect of PQ on IL⁃6 production of RAW264.7
2.4 PQ对RAW264.7产生TNF-α的作用
在1 h、2 h时,随PQ浓度作用从0.001 mmol/L增加到10 mmol/L,细胞培养液中TNF-α的浓度递增,且较对照组显著增加(P<0.05)。8 h的情况与1 h、2 h略有不同,PQ浓度增加10 mmol/L时细胞培养液中TNF-α的浓度下降。见表4。
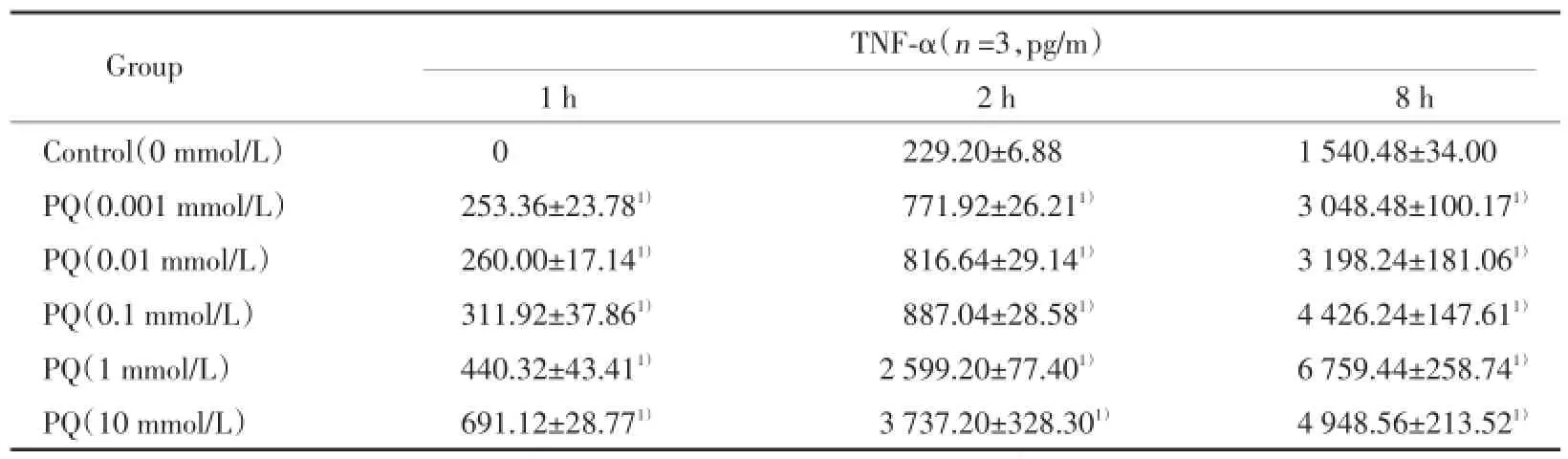
表4 不同浓度PQ对RAW264.7产生TNF⁃α的作用Tab.4 Effect of PQ on TNF⁃α production of RAW264.7
3 讨论
3.1 PQ对巨噬细胞的毒性作用
有关PQ对组织细胞毒性的研究很多,但对巨噬细胞毒性的研究尚未见报道。本研究发现,PQ浓度的增加到1 mmol/L时,对小鼠巨噬细胞RAW264.7毒性作用出现。这与Kim等[1]的报道相似:当PQ的浓度从0.001 mmol/L增加到10 mmol/L时,人肺泡上皮A549细胞的存活率逐渐下降,在浓度为1 mmol/L时明显下降。目前研究公认PQ的毒性作用与氧化还原循环反应有关。进入人体后,PQ可被还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)-细胞色素P450还原酶、还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH):泛醌氧化还原酶、黄嘌呤氧化酶及一氧化氮合酶这4种酶还原,从NADPH或NADH获得电子形成PQ·-和NADP+或NAD+,随后PQ·-在有氧条件下被氧化,将获得的电子传递给O2,形成PQ及O2·-,PQ又继续与NADPH或NADH发生反应。这一过程相当于NADPH或NADH作为电子供体,O2作为电子受体,而PQ起到了催化剂的作用。在超氧化物歧化酶的作用下,O2·-可以转化为其他活性氧自由基,如H2O2和OH-,从而产生一系列的病理生理改变:(1)氧化还原反应大量消耗NADPH及NADH,使许多正常的生化反应无法进行,抑制干扰呼吸链电子传递,影响生物氧化磷酸化,减少能量合成,引起细胞衰竭;(2)氧自由基可将细胞内的还原型谷胱甘肽氧化为氧化型谷胱甘肽,形成混合性二硫化物,影响细胞代谢及功能;(3)大量氧自由基可引发细胞膜脂质过氧化,使膜受损,通透性增高,钙离子通道开放,细胞外钙离子大量内流致细胞内钙超载,破坏细胞功能;可使多种蛋白质交联失活;可直接损伤DNA[13]。
3.2 PQ增加巨噬细胞ROS、IL-6和TNF-α的产生
本研究发现,适当浓度的PQ(如0.1 mmol/L)明显增加巨噬细胞ROS、IL-6和TNF-α的产生。巨噬细胞作为炎性反应的重要启动者和调节者,ROS是其早期主要炎性活化因子之一。故百草枯使巨噬细胞的IL-6和TNF-α的产生增加与可能ROS增加有关。百草枯诱导产生的活性氧活化肺泡巨噬细胞,合成和释放大量具有多种生物活性的细胞因子、前炎性介质、趋化因子及蛋白酶等,在炎症发生发展过程中具有重要意义[13]。ROS可能通过核因子κB(nuclear factor κB,NF-κB)导致巨噬细胞增加上述致炎细胞因子的产生。NF-κB是一种广泛存在于各种细胞、具有多种调节作用的转录因子。它调控的基因编码急性期反应蛋白、细胞因子、细胞黏附分子、免疫调节分子、病毒瘤基因、生长因子、转录和生长调控因子等。通过调控多种基因的表达,NF-κ B参与免疫反应、炎性反应、细胞凋亡、肿瘤发生等多种生物进程。在一般状态下,细胞内大部分NF-κB二聚体通过与细胞质中3个抑制因子(IκBa、IκBβ、IκBε)中的一个结合而以无活性的状态存在。各种信号通过降解IκBs的方式来活化NF-κB,活化的NF -κB然后进入细胞核内与DNA结合。多种作用原,如ROS、紫外辐射、细胞因子(如TNF-α和IL-1),使NF-κB与IκB解离并进入细胞核内,与特定的启动子结合,从而调控各种基因(如细胞因子、炎性因子、黏附分子等[14])的表达。
本研究发现10 mmol/L PQ作用8 h使巨噬细胞ROS、IL-6和TNF-α的产生减少,系高浓度、长时间的PQ暴露使其对巨噬细胞的毒性作用凸显出来,从而削弱其对巨噬细胞的致炎作用。此外,PQ增加巨噬细胞IL-6和TNF-α的产生作用存在时相差异:IL-6增加的较慢而TNF-α增加迅速,提示TNF-α和IL-6可能分别是PQ作用巨噬细胞产生急性和亚急性炎性细胞因子。
[1]Kim H,Lee SW,Baek KM,et al.Continuous hypoxia attenuates paraquat-induced cytotoxicity in the human A549 lung carcinoma cell line[J].Exp Mol Med,2011,43(9):494-500.
[2]Cory-Slecha DA.Studying toxicants as single chemicals:does this strategy adequately identify neurotoxic risk[J].Neurotoxicology,2005,26(4):491-510.
[3]Toygar M,Aydin I,Agilli M,et al.The relation between oxidative stress,inflammation,and neopterin in the paraquat-induced lung toxicity[J].Hum Exp Toxicol,2014,May 12.[Epub ahead of print]
[4]Yu Q,Nie SP,Wang JQ,et al.Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharide-induced tumor necrosis factor-α secretion during macrophage activation[J].Food Chem Toxicol,2014,66:14-22.
[5]Jian XD,Li M,Zhang YJ,et al.Role of growth factors in acute lung injury induced by paraquat in a rat model[J].Hum Exp Toxicol,2011,30(6):460-469.
[6]Lee SK,Ameno K,In SW,et al.Levels of paraquat in fatal intoxications[J].Int J Legal Med,1999,112(3):198-200.
[7]Li LR,Sydenham E,Chaudhary B,et al.Glucocorticoid with cyclophosphamide for paraquat-induced lung fibrosis[J].Cochrane Database Syst Rev,2014,8:CD008084.
[8]Chen CM,Lua AC.Lung toxicity of paraquat in the rat[J].J Toxicol Environ Health A,2000,60(7):477-487.
[9]Nakamura T,Ushiyama C,Shimada N,et al.Changes in concentrations of typeⅣcollagen tissue inhibitor of metalloproteinase-1 in patients with paraquate poisoning[J].J Appl Toxicol,2001,21(6):445-447.
[10]Jones GM,Vale JA.Mechanisms of toxicity clinical features and management of diquat poisoning:a review[J].J Toxicol Clin Toxi-col,2000,38(2):123-128.
[11]Gao Y,Zhang X,Yang Y,et al.Early haemoperfusion with continuous venovenous haemofiltration improves survival of acute paraquat -poisoned patients.[J].J Int Med Res,2014 Nov 12.[Epub ahead of print]
[12]Wu WP,Lai MN,Lin CH,et al.Addition of immunosuppressive treatment to hemoperfusion is associated with improved survival after paraquat poisoning:a nationwide study[J].PLoS One,2014,9(1):1-8.
[13]Dinis-Oliveira RJ,Duarte JA,Sánchez-Navarro A,et al.Paraquat poisonings:mechanisms of lung toxicity,clinical features,and treatment[J].Crit Rev Toxicol,2008,38(1):13-71.
[14]Hwang SY,Hwang JS,Kim SY,et al.Glucosamine inhibits lipopolysaccharide-stimulated inducible nitric oxide synthase induction by inhibiting expression of NF-κB/Rel proteins at the mRNA and protein levels[J].Nitric Oxide,2013,31:1-8.
(编辑 武玉欣)
Toxicity Analysisof Paraquaton Macrophagesand the Effectson Production ofROS,IL-6 and TNF-α
CHENYao,CHONGWei,WANGDan-na,ZHAOQian-wen,DENGYun-lei
(DepartmentofEmergency,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo study the effects of paraquat(PQ)on macrophages,including the toxicity and the induced production of reactive oxygen species(ROS),interleukin-6(IL-6)and tumor necrosis factor-α(TNF-α).MethodsThe RAW264.7 macrophages were treated with different concentrations ofPQfor1 h,2 h and 8 h.The cells and medium were harvested,and the cellviability,intracellular ROS(chemiluminescence method),IL-6 and TNF-α in medium(ELISA)were measured.ResultsThere was no significant difference of the cell viability among 0.001 mmol/L,0.01 mmol/L and 0.1 mmol/L PQ treatment for 8 h,while the decreased cell survival was observed with 1 mmol/L and 10 mmol/L PQ treatment for 2 h and 8 h.The intracellular ROS fluorescent intensity increased at 1 h with a concentration dependent mode of PQ from 0.001 mmol/L to 10 mmol/L. ROS levels decreased with 1 mmol/L and 10 mmol/L PQ treatment for 2 h and 8 h.The IL-6 concentration in the supernatant increased with a concentration dependent mode of PQ from 0.001 mmol/L to 1 mmol/L and decreased when PQ concentration increasing to 10 mmol/L.The TNF-α level in the supernatant increased with the PQ concentration increasing and the treating time extending except for 10 mmol/L PQ at 8 h.ConclusionHigh concentration of PQ shows toxic effect on macrophages,and appropriate concentrations of PQ increases the production of ROS,TNF-α and IL-6 by macrophages.
paraquat;macrophage;reactive oxygen species;interleukin-6;tumor necrosis factor-α
R595.4
A
0258-4646(2014)12-1105-04
辽宁省自然科学基金(201202289)
陈瑶(1982-),女,主治医师,硕士研究生.
崇巍,E-mail:chongweixiena@126.com
2014-10-05
网络出版时间:

