单克隆免疫球蛋白病相关的增生性肾小球肾炎
成水芹 综述 曾彩虹 审校
单克隆免疫球蛋白病(MGP)是B淋巴细胞或浆细胞异常单克隆增殖,在循环中产生大量单克隆免疫球蛋白的疾病[1]。B淋巴细胞的异常增殖常见于B细胞淋巴瘤和白血病,浆细胞的异常增殖常见于多发性骨髓瘤和意义未明的单克隆免疫球蛋白病(MGUS)。异常增生的B淋巴细胞或浆细胞可持续分泌免疫球蛋白,通过直接和间接机制导致增生性肾小球肾炎(图1)。本文就这两种机制所致的增生性肾小球肾炎(图2)作一综述。
MGP直接机制所致的增生性肾小球肾炎
单克隆免疫球蛋白形成的免疫复合物沉积于肾小球系膜区和毛细血管袢,并且激活补体经典途径导致补体在肾脏沉积,最终形成单克隆免疫球蛋白及补体在肾脏的沉积,此为直接机制所致的MGP相关的增生性肾小球肾炎[2,3]。约57%的此类患者由MGUS所致,其他包括慢性淋巴细胞白血病、华氏巨球蛋白血症、低分化的B细胞淋巴瘤和多发性骨髓瘤等[4]。

图1 单克隆免疫球蛋白相关的增生性肾小球肾炎的发病机制

图2 单克隆免疫球蛋白相关的增生性肾小球肾炎的分类
直接机制所致的增生性肾小球肾炎为免疫球蛋白增多导致白细胞趋化,细胞因子及蛋白酶释放损伤毛细血管壁,内皮细胞剥脱、基膜破坏,系膜基质、基膜、内皮细胞修复,新的基膜形成,足突融合,产生蛋白尿及血尿[5]。组织形态学改变包括膜增生性肾小球肾炎、系膜增生性肾小球肾炎、弥漫增生性肾小球肾炎、结节性肾小球肾炎、新月体及坏死性肾小球肾炎、硬化性肾小球肾炎。结合超微结构可诊断为单克隆免疫球蛋白沉积病(MIDD)、纤维性肾小球肾炎、免疫管状肾小球肾炎、Ⅰ型冷球蛋白肾损害(单克隆性)和单克隆IgG沉积的增生性肾小球肾炎(PGNMID)等(表1)。
MIDDMIDD是单克隆免疫球蛋白轻链和(或)重链异常沉积于肾脏所致的疾病,分为轻链沉积病(LCDD)、重链沉积病(HCDD)和轻-重链沉积病(LHCDD)。MIDD中M蛋白阳性率较高,其中LCDD和LHCDD的阳性率为80%~90%,HCDD的阳性率为60%[6]。
纤维性肾小球肾炎纤维性肾小球肾炎约占自体肾活检的0.5%~1%[7]。Nasr等[8]报道了62例纤维性肾小球肾小球肾炎患者中,M蛋白阳性率为17%,其中3例在随访中进展为多发性骨髓瘤,与Rosenstock等[9]报道的15%患者M蛋白阳性率相似。
免疫管状肾小球肾炎免疫管状肾小球肾炎发生率为纤维性肾小球肾炎的1/10[10]。免疫管状肾小球肾炎的浆细胞或淋巴细胞异常较纤维状肾小球肾炎常见。Rosenstock等[9]报道的6例免疫管状肾小球肾炎患者中M蛋白阳性的有4例,明显高于纤维性肾小球肾炎。
Ⅰ型冷球蛋白血症肾损害病因可为多发性骨髓瘤、华氏巨球蛋白血症、慢性淋巴细胞白血病及淋巴瘤等。Néel等[11]观察了36例症状性Ⅰ型冷球蛋白血症患者,M蛋白阳性率为100%,均为IgMκ型,其中8例患者在起病时累及肾脏,另有3例患者在长期随访过程中出现肾脏损害。
PGNMIDPGNMID占南京军区南京总医院肾脏科自体肾活检中的0.14%[12],与Nasr等[2]报道的0.17%相似。绝大多数患者为MGUS,骨髓活检浆细胞<5%,可在随访过程中出现多发性骨髓瘤[2]。Nasr等[2]回顾性分析37例PGNMID患者发现,11例(30%)患者M蛋白阳性,其中1例患者在肾活检时未检测出M蛋白,但在随访第3年时检测出阳性。有长期随访32例患者,平均随访30.3月,38%的患者肾功能完全或部分恢复,22%的患者发展至终末期肾病(ESRD),仅1例患者进展至多发性骨髓瘤。曾彩虹等[12]报道的7例PGNMID患者中仅1例患者M蛋白阳性,提示循环中血清M蛋白低于检测水平仍然可致单克隆免疫球蛋白在肾组织中沉积。另一项研究中4例PGNMID患者肾组织中均有IgG3沉积,所有患者在肾移植时血清M蛋白阴性,但在移植后不久4例患者移植肾均发展为MGP相关的增生性肾炎[13]。
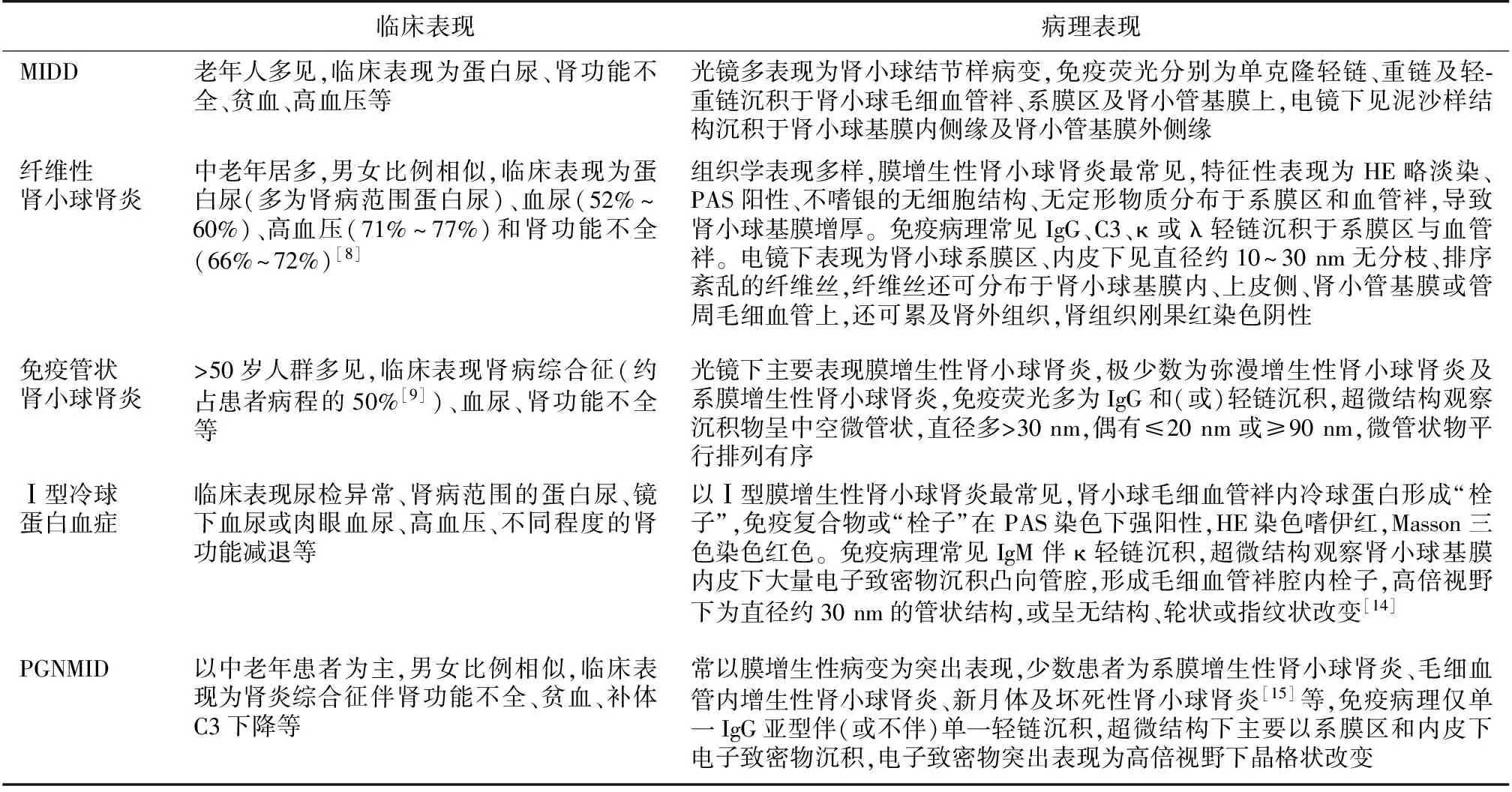
表1 经典途径所致的增生性肾小球肾炎的临床及病理表现
MIDD:单克隆免疫球蛋白沉积病;PGNMID:单克隆IgG沉积的增生性肾小球肾炎
MGP间接机制所致的增生性肾小球肾炎
单克隆免疫球蛋白激活补体旁路途径导致补体C3在肾脏的沉积,而免疫球蛋白阴性,最终形成MGP间接机制所致的增生性肾小球肾炎(C3肾病)。C3肾病中C3转换酶的抗体(C3肾炎因子、H因子)升高,C3肾炎因子可稳定C3转换酶,延长C3转换酶的半衰期,通过补体调节蛋白防止C3转换酶的分解最终导致补体旁路途径的激活[16]。单克隆免疫球蛋白通过干预补体调节蛋白的功能及相关抗体从而阻断补体旁路途径的调节,进而激活补体旁路途径,导致旁路途径的补体成分沉积于肾小球,或者部分单克隆免疫球蛋白模拟补体调节蛋白或C3转化酶抗体,导致该途径的过度激活,形成C3肾病。补体旁路途径异常的发病机制分为获得性和遗传性,最常见的获得性异常为自身抗体的形成,包括C3肾炎因子、H因子及B因子阳性。最常见的遗传异常为H因子H402及V62等位基因的存在,其他的异常包括CFH、CFI和CFHR基因突变[16],大多数属常染色体隐性遗传。
C3肾病包括C3肾小球肾炎和致密物沉积病(DDD),最主要的病理表现是膜增生性肾小球肾炎,少数表现为系膜增生性肾小球肾炎、弥漫增生性肾小球肾炎、新月体及坏死性肾小球肾炎和硬化性肾小球肾炎[17,18]。免疫病理下C3沉积于肾小球系膜区和血管袢,无其他免疫球蛋白沉积。C3肾小球肾炎和DDD的区别主要在电镜下的改变:前者电子致密物沉积在肾小球系膜区、内皮下,偶尔沉积在肾小球的基膜内和上皮层,致密物为无结构的物质,而DDD的电子致密物沉积在肾小球基膜致密层及肾小管基膜。
C3肾小球肾炎临床以肾病综合征、血尿、高血压及肾功能不全为主要表现,多伴有补体下降,光镜下可表现为Ⅰ型膜增生性肾小球肾炎,其次为系膜增生性肾小球肾炎,超微结构下肾小球系膜区及内皮下电子致密物沉积。Zand[19]等分析了32例完善免疫固定电泳检查的C3肾小球肾炎患者,其中高达10例(32%)患者的M蛋白阳性,这10例患者中9例为MGUS(2例C3肾炎因子阳性),1例为慢性淋巴细胞白血病。Hill等[20]报道了3例慢性淋巴细胞白血病所致的膜增生性肾小球肾炎,患者血液及尿液均检测出M蛋白,其中2例患者免疫荧光C3阳性,免疫球蛋白阴性,结合光镜及电镜诊断为MGP相关的C3肾小球肾炎,予泼尼松片及苯丁酸氮芥治疗,尿检及肾功能均得到不同程度的缓解。该病病程进展缓慢,有报道15.8%患者可进展为ESRD[21]。
DDDDDD肾损害表现与C3肾小球肾炎类似,但可伴肾外表现包括眼部脉络膜疣或获得性脂肪营养不良。肾活检病理下荧光染色补体C3沿肾小球毛细血管袢沉积,光镜下主要表现为 Ⅰ 型膜增生性肾小球肾炎,免疫复合物呈线状、短线状或绸带状沉积在肾小球基膜内,电镜下肾小球基膜内电子致密物呈连续线状或非线状沉积。Meri等[22]研究发现免疫球蛋白λ轻链可通过补体旁路途径与H因子相互作用产生DDD。Sethi等[23]研究了14例平均年龄为61.2岁的MGP相关的DDD患者,M蛋白阳性率高达100%,且均为IgG,其中10例为MGUS。14例患者中有6例在随访中进展为ESRD,有1例患者肾移植术后很快出现原发病复发。
MGP相关的增生性肾小球肾炎的诊断
MGP的临床表现多样,恶性程度较高的为多发性骨髓瘤、华氏巨球蛋白血症;恶性程度较低为淀粉样变性和浆细胞非肿瘤性增生的MGUS等[24,25],其中MGUS为最常见。当明确诊断为单克隆免疫球蛋白病相关的上述疾病且合并增生性肾小球肾炎时即可诊断为MGP相关的增生性肾小球肾炎。
MGP相关的增生性肾小球肾炎的诊断必须结合临床和组织形态学证据,且排除感染和自身免疫性疾病,患者血清中单克隆免疫球蛋白升高或正常,骨髓细胞学检查见浆细胞或淋巴细胞的异常增生,但有的患者如MGUS实验室检查未见明显异常,需长期随访并且积极寻找其他检测手段和方法。迄今为止最为敏感的检测手段为血、尿免疫固定电泳和血清游离轻链检测。诊断MGP相关的C3肾病时,尤其是C3肾小球肾炎,并不是所有患者血、尿M蛋白均阳性,这时需要行血、尿游离轻链及骨髓细胞学、骨髓活检支持诊断,以免漏诊。
MGP相关的增生性肾小球肾炎中绝大多数为MGUS所致的肾小球肾炎,恶性程度不高,预后相对较好;而一些患者原发病为多发性骨髓瘤、华氏巨球蛋白血症或者慢性淋巴细胞白血病,这些疾病一般为恶性疾病,预后较差。一些患者中诊断增生性肾小球肾炎可先于浆细胞恶性疾病数月至数年,故需长期随访,寻找继发因素。
组织形态学对于鉴别各类MGP相关的增生性肾炎非常有必要,可从发病机制所致的增生性肾小球肾炎进行比较,经典途径免疫荧光下单克隆免疫球蛋白和补体沉积在肾小球系膜区和毛细血管袢,电镜下电子致密物可为特殊结构(纤维状、微管状、指纹状、晶格状等);旁路途径所致的增生性肾小球肾炎为C3肾病,免疫荧光仅有补体C3沉积,电镜下的致密物为无特殊结构的物质,诊断C3肾病或DDD后,除检查补体旁路调节相关因子上,还需进行血、尿免疫固定电泳和轻链的检查,以排除其他MGP的可能。两者光镜下均为增生性肾小球肾炎(主要为膜增生性肾小球肾炎)。
MGP相关的增生性肾小球肾炎的治疗
因MGP相关的增生性肾小球肾炎近年来才被人们认知,故治疗上没有形成统一的指南。现今对于这类疾病的治疗基于临床经验、治疗反应和药物的毒副作用等,但治疗的目标一致为清除克隆的浆细胞及淋巴细胞,减少免疫球蛋白的产生。
如证实MGP继发于骨髓瘤、淋巴瘤或慢性淋巴细胞白血病,需要积极治疗原发病,清除异常增生的克隆细胞,从而减少M蛋白的生成。非IgM型MGUS,可给予硼替佐米、环磷酰胺和地塞米松(VCD方案)治疗[26,27];Sethi等[5]总结了MGP相关的增生性肾小球肾炎的治疗,经典途径所致的增生性肾小球肾炎患者如IgM阳性,予以利妥昔单抗、环磷酰胺和地塞米松(RCD方案)治疗,如为非IgM阳性,予以VCD治疗;如M蛋白阴性予以利妥昔单抗和(或)环磷酰胺治疗;DDD或C3肾小球肾炎患者,IgM阳性予以RCD治疗,非IgM阳性予以VCD治疗。
在积极治疗原发病的情况下患者需要严密监测病情变化,适时给予对症支持治疗,包括控制高血压、平衡液体出入、透析治疗等。无论何种原因的膜增生性肾小球肾炎患者行肾移植后复发的概率为40%~60%。Lorenz等[28]研究血清单克隆免疫球蛋白升高的肾移植患者复发的概率非常高。复发趋于早期且临床表现较原发病严重。故在肾移植之前积极清除单克隆浆细胞,减少复发的风险。
小结:MGP相关的增生性肾小球肾炎可通过激活经典途径导致单克隆免疫球蛋白和补体的沉积,也可通过旁路途径激活导致补体C3的沉积,最终导致肾脏的损伤、增殖和修复,出现尿检异常和肾功能不全。经肾活检证实为单克隆免疫球蛋白和(或)补体沉积的增生性肾小球肾炎,临床上应检测血、尿免疫固定电泳及游离轻链、骨髓活检等有助于诊断。
1Kyle RA,Rajkumar SV.Criteria for diagnosis,staging,risk stratification and response assessment of multiple myeloma.Leukemia,2009,23(1):3-9.
2Nasr SH,Satoskar A,Markowitz GS,et al.Proliferative Glomerulonephritis with Monoclonal IgG Deposits.J Am Soc Nephrol,2009,20(9):2055-2064.
3Sethi S,Zand L,Leung N,et al.Membranoproliferative Glomerulonephritis Secondary to Monoclonal Gammopathy.Clin J Am Soc Nephrol,2010,5(5):770-782.
4Moulin B1,Ronco PM,Mougenot B,et al.Glomerulonephritis in chronic lymphocytic leukemia and related B-cell lymphomas.Kidney Int,1992,42(1):127-135.
5Sethi S,Rajkumar SV.Monoclonal gammopathy-associated proliferative glomerulonephritis.Mayo Clin Proc,2013,88(11):1284-1293.
6Ronco P,Aucouturier P,Mougenot B.Monoclonal gammopathies:Multiple myeloma,amyloidosis,and related disorders.∥Schrier R.Diseases of the kidney and urinary Tract, 8th ed. Philadelphia:Lippincoff Williams & wilkins 2000:1942-1976.
7Alpers CE,Kowalewska J.Fibrillary glomerulonephritis and immunotactoid glomerulopathy.J Am Soc Nephrol,2008,19(1):34-37.
8Nasr SH,Valeri AM,Cornell LD,et al.Fibrillary glomerulonephritis:a report of 66 cases from a single institution.Clin J Am Soc Nephrol,2011,6(4):775-784.
9Rosenstock JL,Markowitz GS,Valeri AM,et al.Fibrillary and immunotactoid glomerulonephritis:distinct entities with different clinical and pathologic features.Kidney Int,2003,63(4):1450-1461.
10 Iskandar SS,Falk RJ,Jennette JC.Clinical and pathologic features of fibrillary glomerulonephritis.Kidney Int,1992,42(6):1401-1407.
11 Néel A,Perrin F,Decaux O,et al.Long-term outcome of monoclonal(type 1) cryoglobulinemia.Am J Hematol,2014,89(2):156-161.
12 曾彩虹,陈浩,范云,等.单克隆IgG沉积的增生性肾小球肾炎.肾脏病与透析肾移植杂志,2012,21(5):401-407.
13 Nasr SH,Sethi S,Cornell LD,et al.Proliferative Glomerulonephritis with Monoclonal IgG Deposits Recurs in the Allograft.Clin J Am Soc Nephrol,2011,6(1):122-132.
14 陈樱花,胡伟新.冷球蛋白血症的肾脏损害.肾脏病与透析肾移植杂志,2010,19(1):59-65.
15 Nasr SH,Markowitz GS,Stokes MB,et al.Proliferative glomerulonephritis with monoclonal IgG deposits:a distinct entity mimicking immune-complex glomerulonephritis.Kidney Int,2004,65(1):85-96.
16 Sethi S,Fervenza FC,Zhang Y,et al.C3 glomerulonephritis:clinicopathological findings,complement abnormalities,glomerular proteomic profile,treatment,and follow-up.Kidney Int,2012,82(4):465-473.
17 Servais A,Fremeaux-Bacchi V,Lequintrec M,et al.Primary glomerulonephritis with isolated C3 deposits:a new entity which shares common genetic risk factors with haemolytic uraemic syndrome.J Med Genet,2007,44(3):193-199.
18 Walker P D,Ferrario F,Joh K,et al.Dense deposit disease is not a membranoproliferative glomerulonephritis.Modern Pathology,2007,20(6):605-616.
19 Zand L,Kattah A,Fervenza FC,et al.C3 Glomerulonephritis Associated With Monoclonal Gammopathy:A Case Series.Am J Kidney Dis,2013,62(3):506-514.
20 Hill PA,Firkin F,Dwyer KM,et al.Membranoproliferative glomerulonephritis in association with chronic lymphocytic leukaemia:a report of three cases.Pathology,2002,34(2):138-143.
21 Servais A,Frémeaux-Bacchi V,Lequintrec M,et al.Primary glomerulonephritis with isolated C3 deposits:a new entity which shares common genetic risk factors with haemolytic uraemic syndrome.J Med Genet,2007,44(3):193-199.
22 Meri S,Koistinen V,Miettinen A,et al.Activation of the alternative pathway of complement by monoclonal lambda light chains in membranoproliferative glomerulonephritis.J Exp Med,1992,175(4):939-950.
23 Sethi S,Sukov WR,Zhang Y,et al.Dense Deposit Disease Associated With Monoclonal Gammopathy of Undetermined Significance.Am J Kidney Dis,2010,56(5):977-982.
24 Kyle RA,Therneau TM,Rajkumar SV,et al.A long-term study of prognosis in monoclonal gammopathy of undetermined significance.N Engl J Med,2002,346(8):564-569.
25 Rajkumar SV,Dispenzieri A,Kyle RA.Monoclonal gammopathy of undetermined significance,Waldenstrom macroglobulinemia,AL amyloidosis,and related plasma cell disorders:Diagnosis and treatment.Mayo Clin proc,2006,81(5):693-703.
26 Mikhael JR,Dingli D,Roy V,et al.Management of Newly Diagnosed Symptomatic Multiple Myeloma:Updated Mayo Stratification of Myeloma and Risk-Adapted Therapy(mSMART) Consensus Guidelines 2013.Mayo Clin proc,2013,88(4):360-376.
27 Rajkumar SV.Multiple myeloma:2013 update on diagnosis,risk-stratification,and management.Am J Hematol,2013,88(3):226-235.
28 Lorenz EC,Sethi S,Leung N,et al.Recurrent membranoproliferative glomerulonephritis after kidney transplantation.Kidney Int,2010,77(8):721-728.

