两种新型连续性肾脏替代治疗模式对溶质清除的影响
邬步云 徐 斌 邹 华 刘志红 龚德华 季大玺
HVHF的这种细胞因子水平降低及临床症状改善的效果与患者最终预后无改善之间的差异,可能与剂量提高带来的不良影响增加(有学者称为透析创伤[12-14])有关。剂量提高带来细胞因子及炎症介质清除率提高的同时,更是大大提高了对小分子水溶性物质的清除率,这些物质除尿毒症毒素(如尿素、肌酐)外,还包括一些机体有用物质,如氨基酸、水溶性维生素、小分子激素、不饱和脂肪酸,抗菌药物及微量元素。这些有用物质的大量丢失必然对机体产生非常不利的影响(“丢失综合征”),必然减小甚至抵消剂量提高带来的治疗作用。既往有研究[15]设计了动物实验,证明双重血液滤过(DHF)[也称为级联血滤,一级滤过120 ml/(kg·h),二级滤过20 ml/(kg·h)]相比HVHF[45 ml/(kg·h)]改善脓毒性休克猪模型的血流动力学;但未关注其减少有用物质丢失的作用,且在人体中研究DHF并未开展。我们的前期研究证实,CVVH剂量越高,氨基酸的丢失越多[16]。我们假设,若减少HVHF所带来的“丢失综合征”可提高其救治危重症患者的临床效果。
为此我们将DHF在人体中开展,并根据DHF缺点进行改进,设计一种新型CRRT模式——无透析液的血液透析滤过(DF-HDF)。本研究通过前瞻性、随机对照研究,旨在验证DHF、DF-HDF的中分子溶质清除率与HVHF相当,小分子溶质的清除率与标准剂量血液滤过(SVHF)相当。
对象和方法
研究设计
2013年9月至2014年2月期间纳入40例患者,随机分为DHF、DF-HDF、标准剂量的血液滤过(SVHF)和HVHF四组,每组10例。四种治疗模式废液流量分别为 35 ml/(kg·h)、100 ml/(kg·h)、35 ml/(kg·h)、30 ml/(kg·h)。验证两种新型的CRRT模式对不同分子量溶质的清除。本研究经本院医学伦理会委员批准,所有受试者均签署知情同意书。
研究对象
入选标准(1)年龄18~70岁;(2)肾功能不全需行血液净化治疗[血清肌酐(SCr)≥265.2 μmol/L]。排除标准:(1)生命终末期患者,包括晚期肝硬化、失代偿心力衰竭、恶性肿瘤晚期;(2)妊娠期妇女;(3)既往有对体外循环管路及材料过敏史;(4)建立体外循环禁忌;(5)血管通路流量<200 ml/min;(6)低白蛋白血症(血清白蛋白≤25 g/L);(7)临床存在高钾血症、高分解代谢、严重电解质紊乱需高剂量CRRT。
CRRT治疗方案所有患者入选后采用中心静脉导管或内瘘,血流量250 ml/min。高通量滤器为AV600(polysulfone,1.4m2,Fresenius medical care,Germany,分子截留量30 kD,52 ml/h/mmHg/m2), 低通量透析器为15L(Polysulfone,1.5m2,Asahi,Japan,分子截留量<5 kD,8 ml/h/mmHg/m2)。SVHF组和HVHF组使用AV600滤器,DHF组、DF-HDF组使用AV600及15L滤器。抗凝剂常规使用低分子肝素联合枸橼酸抗凝,首量40 IU/kg,追加为4 IU/(kg·h)。不同治疗模式参数见图1。
总是会有不同程度路面路基问题出现在道路桥梁在交付使用后,受到外界环境的影响,会降低道路桥梁使用年限,影响桥梁的质量并加重之前质量问题。所以,要求有关技术人员定期检查破损的路基路面情况,维修排水系统,重视好后期的保养及维护,及时上报并做好相应记录,便于市政工程团队人员的修复。总而言之,需全面提升路基路面施工质量,加强后期维护及保养。
SVHF组治疗模式:滤器采用AV600,前稀释模式,滤过剂量35 ml/(kg·h)。
HVHF组治疗模式:滤器采用AV600,前稀释模式,滤过剂量100 ml/(kg·h)。
DHF组治疗模式:一级滤器采用AV600,滤过速度100 ml/(kg·h);AV600滤过液再通过两个二级滤器15L行二次滤过,二级滤过速度65 ml/(kg·h)回输血液,丢弃废液速度35 ml/(kg·h)。
DF-HDF组治疗模式:一级滤器采用AV600,经一级滤器的透析液再循环速度170 ml/min,透析液再经2个二级滤器15L并联滤过,再回一级滤器透析液入口端,丢弃废液速度30 ml/(kg·h);同时后稀释方式补充置换液速度30 ml/(kg·h)。
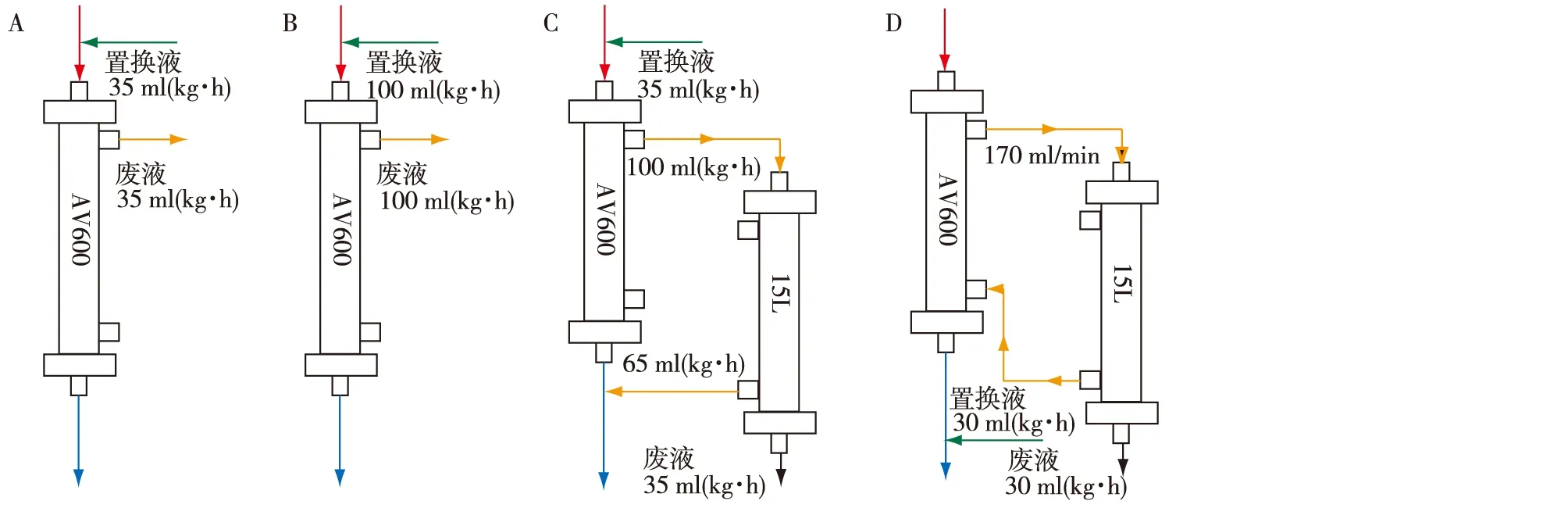
图1 四种连续性肾脏替代治疗模式图
观察指标主要观察指标为体重标准化的β2-微球蛋白(β2-MG)清除率和肌酐清除率(CCr)。次要观察指标为磷、胱抑素C、同型半胱氨酸(HCY,作为氨基酸类似物,代表氨基酸)、叶酸、微量元素(铜、锌)清除率。安全性指标包括出血、凝血、管路漏液、破膜等。
检测方法血液标本待凝集后4 000 r/min离心10 min,后立即将血清和滤液保存在-80℃超低温冰箱。患者入组完成后标本集中检测。β2-MG采用化学发光法(深圳市新产业生物医学工程公司)测定,检测范围为0.03~10.0 μg/ml,部分标本稀释5倍。叶酸采用化学发光法(Beckman Coulter Inc)测定,检测范围为0.5~20 ng/ml。胱抑素C采用免疫比浊法(北京利德曼生化股份公司)测定,线性范围为0.2~8.0 mg/dl。HCY采用酶比色法(北京九强生物技术有限公司)测定,检测范围为2.5~40 μmol/L。铜、锌离子检测采用络合比色法(宁波美康生物科技股份有限公司)测定,检测范围为分别为1~45 μmol/L、0~61.2 μmol/L。
统计学方法采用SAS 9.2软件进行数据分析。计量资料采用均数±标准差表示,多组间比较采用Wilcoxon秩和检验。分类资料以率表示,组间比较采用χ2检验。清除率=废液流量×废液浓度/血清浓度,体重标准化的清除率=清除率×60/体质量。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
入组情况与基线特征从2013年9月至2014年2月我们筛选53例患者,其中41例患者随机分为4组,其中1例行HVHF治疗的患者因治疗半小时发生房颤而中止研究。最终完成并分析了40例。
40例患者平均年龄为44.8±15.4岁,男性21例,女性19例。血液净化治疗前平均尿素氮23.5±7.5 mmol/L,SCr 592.3±300.6 μmol/L,白蛋白32.6±6.5 g/L(表1)。
溶质的清除率SVHF组、HVHF组、DHF组、DF-HDF组CCr分别为30.1±2.0 ml/(kg·h)、69.0±7.2 ml/(kg·h)、32.3±4.2 ml/(kg·h)、32.1±3.4 ml/(kg·h),DHF组及DF-HDF组的CCr明显低于HVHF组清除率(P<0.05),不高于SVHF组。SVHF组、HVHF组、DHF组、DF-HDF组的β2-MG清除率分别为16.1±2.8 ml/(kg·h)、35.0±7.5 ml/(kg·h)、40.8±9.9 ml/(kg·h)、35.8±10.6 ml/(kg·h),DHF组及DF-HDF组的β2-MG清除率不低于HVHF组,但明显高于SVHF组(P<0.01)(表2)。
DHF组、DF-HDF组对磷、叶酸、HCY、铜、锌的清除与SVHF组相当或接近,而远远小于HVHF的清除(P<0.01);而对胱抑素C的清除与HVHF相当,但明显高于SVHF(P<0.01)。
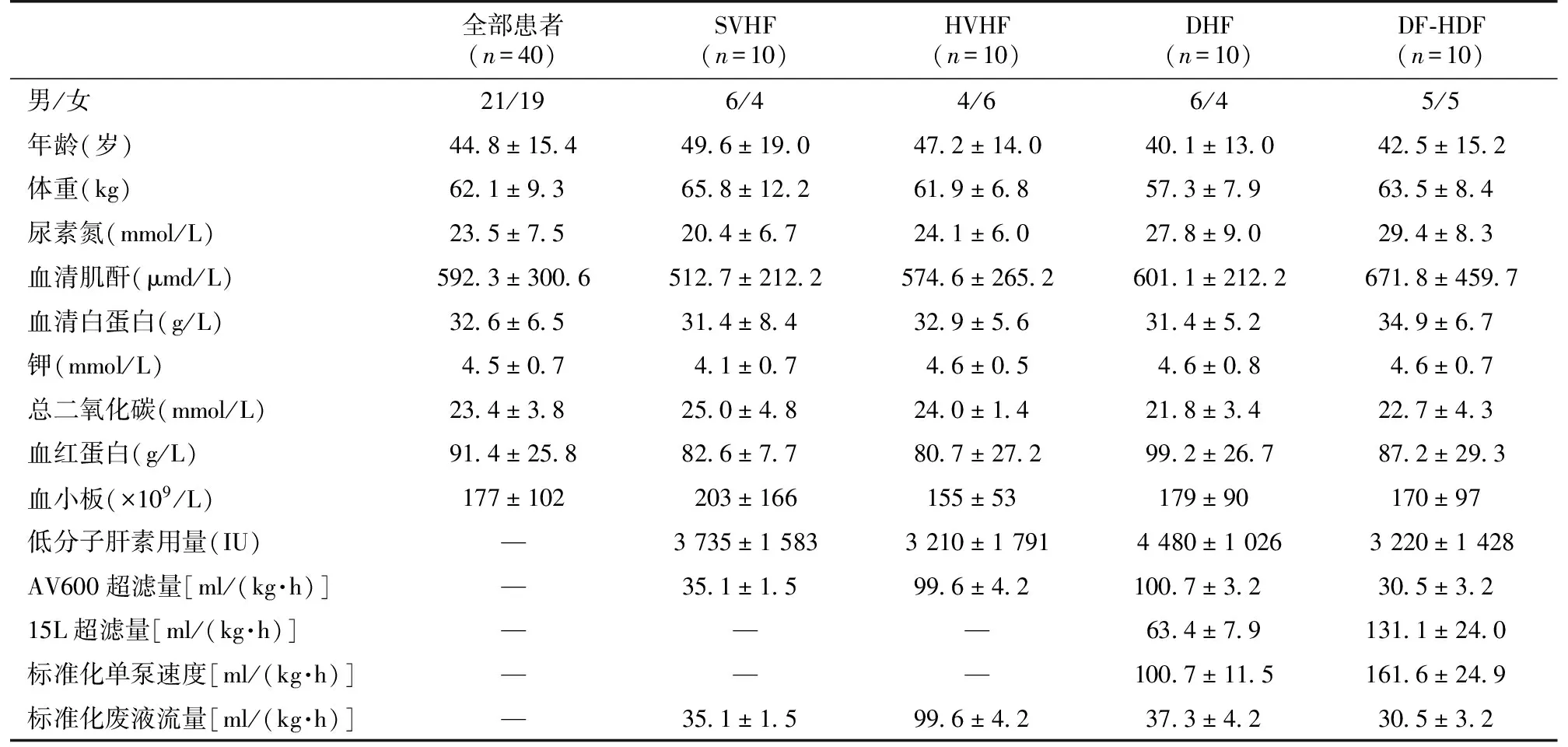
表1 四组患者临床资料、实验室检查及血液净化参数比较
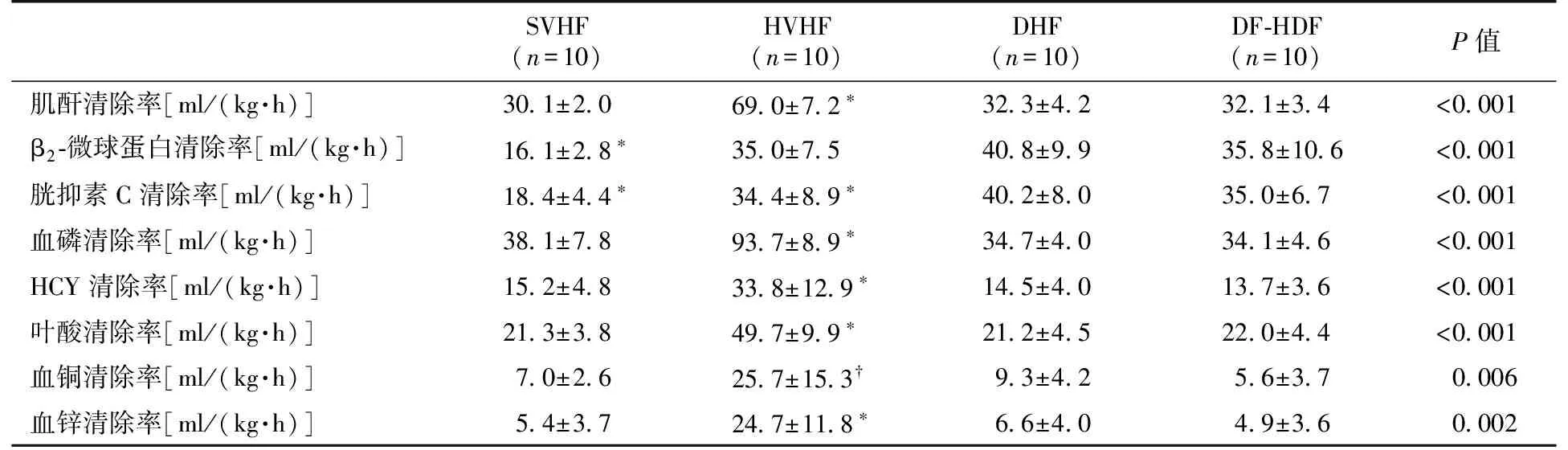
表2 四种CRRT治疗模式对患者不同溶质清除率比较
安全性指标治疗过程中,各组无明显凝血、出血、破膜、管路漏液。DHF、DF-HDF压力监测正常。其中DHF组测量的低通量滤器的跨膜压平均为96±17 mmHg,DF-HDF组测量的低通量滤器的跨膜压平均为215±37 mmHg。
治疗过程中,HVHF组患者一例发生房颤而终止研究,DHF组和SVHF组各1例发生低钙血症,经补钙后好转。其余患者无不良反应。
讨 论
CRRT通过清除不同溶质达到救治危重症患者的目的,清除溶质的速度(主要与CRRT剂量相关)被认为与患者的生存率相关。2000年,Ronco等[17]提出35 ml/(kg·h)和45 ml/(kg·h)在脓毒症患者中优于25 ml/(kg·h),随后多个研究探讨了CRRT剂量与患者的生存率的关系,但争议持续存在。2008年ATN研究[18]和2009年RENAL研究[19]均认为高剂量的CRRT[35 ml/(kg·h)]不优于标准剂量的CRRT[20~25 ml/(kg·h)],而最近的IVOIRE研究[11]认为HVHF[70 ml/(kg·h)]剂量相比标准剂量[35 ml/(kg·h)]未改善患者生存率。理论上通过HVHF可明显清除细胞因子、减少炎症的免疫损伤有益于脓毒症或SIRS患者[5,20-24],基于CRRT在脓毒症或SIRS患者中的免疫调节作用,有理由相信提高CRRT剂量可改善脓毒症患者的生存率。但目前大型的临床研究为阴性结果,其可能原因是提高CRRT剂量的益处与其不良反应(有学者称为透析创伤[12-14],包括氨基酸、维生素及微量元素丢失,抗生素低剂量,临床差错的增加等)抵消。营养物质的丢失将会使患者营养不良,增加患者的死亡率,延长患者摆脱机械通气时间及住院时间;抗生素低剂量将会使抗感染治疗低效,使得患者死亡率增加、住院时间延长。这些都会对危重症患者产生不良结果,从而抵消CRRT提高剂量带来的益处。
笔者认为,若在行高剂量CRRT的同时限制有用物质的丢失,将减少HVHF的透析创伤,可能将提高HVHF的疗效。既往有研究在动物模型中观察DHF相比HVHF改善脓毒性休克猪模型的血流动力学[15];但未关注其减少有用物质丢失的作用。
基于增加中分子溶质清除、同时限制小分子溶质的丢失的理念,我们在动物实验的基础上调整了患者行DHF治疗的参数[一级滤过100 ml/(kg·h),二级滤过35 ml/(kg·h)],并设计DF-HDF这种新型的CRRT模式。两者的区别如下:(1)DHF将高通量滤器分离的滤液(溶质分子量<20 kD)通过低通量滤器再次滤过,将去除中大分子的小分子液体(溶质分子量<5 kD)回输体内,而浓缩的中大分子溶液(主要5~20 kD)则丢弃;而DF-HDF则是将高通量滤器分离的滤液通过低通量滤器再次滤过,将去除中大分子的液体(溶质分子量<5 kD)充当透析液进行透析,增加了内超滤和反超滤,从而增加中大分子的清除(主要5~20 kD)。(2)DHF模式因为高通量滤器超滤率较大[100 ml/(kg·h)],血流量要求高,滤器容易凝血;而DF-HDF模式高通量滤器超滤率较小[30 ml/(kg·h)],血流量可相对较小,滤器相比不易凝血。(3)目前CRRT机器设备和额外的单泵无法联动,当血泵停止后,DHF模式中单泵抽吸导致滤器破膜,因而临床DHF需专人看护;而DF-HDF中回收液充当透析液,当血泵停止后透析液可以循环,无安全隐患,因而在无专门DHF机器时,DF-HDF模式其安全性更高。
我们的研究证实DHF和DF-HDF在微量元素、叶酸、氨基酸类似物丢失及液体消耗量方面与SVHF相当,相比HVHF明显减少。同时两者相比,SVHF可提高β2-MG、胱抑素C的清除,完全可以推断炎症介质及细胞因子等中大分子物质的清除率也将大大增加(图2)。因而DHF和DF-HDF均具有目前CRRT常规剂量和高剂量不能兼备的优势,具有广泛的临床应用前景。有理由相信,凡是需增加中大分子物质清除的疾病,均是DHF或DF-HDF的适应证,包括SIRS、脓毒症、横纹肌溶解等。

图2 四种CRRT模式对不同溶质的清除率
DHF和DF-HDF与高截留量(HCO)透析技术相比也有一定优势。首先,在同等液体消耗量下,但DHF和DF-HDF的β2-MG等中分子的清除率略高于HCO-CRRT。其次,DHF和DF-HDF在蛋白丢失量(可忽略不计)远远低于HCO-CRRT,后者每日需要补充30~50g的蛋白[25]。第三,DHF或DF-HDF相比SVHF仅增加两个低通量滤器和管路,成本仅增加400元/d,远低于HCO-CRRT,后者单个滤器费用高达5 000元并需补充大量白蛋白[26]。
本研究存在以下局限在于:(1)高通量滤器AV600的膜面积为1.4m2,分子截留量约为30 kD,若采用更大截留量和更大膜面积的滤器,相信清除中分子溶质的能力将更为可观。(2)纳入的是非脓毒症的肾功能不全患者,其体内细胞因子浓度相对正常,所以未测定细胞因子浓度。(3)采用络合比色法测定微量元素,未采用电感耦合等离子体质谱测定微量元素,因而微量元素的清除率不够准确。
本文为首篇报道DHF和DF-HDF在人体中的研究,证实了DHF和DF-HDF相比HVHF将减少液体消耗量,将减少护士的工作量和治疗成本,减少小分子物质(包括叶酸、氨基酸类似物、微量元素)的丢失,将改善危重症患者的营养,并减少抗生素的丢失并预防抗生素低剂量;另外DHF和DF-HDF相比SVHF增加了炎症介质、细胞因子等中分子溶质的清除,更能减轻炎症的免疫损伤,提高疗效,但此种效应对脓毒症患者产生的临床效应还需要进一步的临床试验来证实。
小结:DHF及DF-HDF对中分子的清除不低于HVHF,明显高于SVHF;对小分子溶质的清除不高于SVHF,明显低于HVHF。这两种CRRT模式具有广阔的临床应用前景,有望改善危重症患者的预后。
1Rabindranath K,Adams J,Macleod AM,et al.Intermittent versus continuous renal replacement therapy for acute renal failure in adults.Cochrane Database Syst Rev,2007,18(3):CD003773.
2Schneider AG,Bellomo R,Bagshaw SM,et al.Choice of renal replacement therapy modality and dialysis dependence after acute kidney injury:a systematic review and meta-analysis.Intensive Care Med,2013,39(6):987-997.
3Bouchard J,Soroko SB,Chertow GM,et al.Fluid accumulation,survival and recovery of kidney function in critically ill patients with acute kidney injury.Kidney Int,2009,76(4):422-427.
4Joannidis M.Continuous renal replacement therapy in sepsis and multisystem organ failure.Semin Dial,2009,22(2):160-164.
5Ronco C,Tetta C,Mariano F,et al.Interpreting the mechanisms of continuous renal replacement therapy in sepsis:the peak concentration hypothesis.Artif Organs,2003,27(9):792-801.
6Cornejo R,Downey P,Castro R,et al.High-volume hemofiltration as salvage therapy in severe hyperdynamic septic shock.Intensive Care Med,2006,32 (5):713-722.
7Laurent I,Adrie C,Vinsonneau C,et al.High-volume hemofiltration after out-of-hospital cardiac arrest:a randomized study.J Am Coll Cardiol,2005,46 (3):432-437.
8Joannes-Boyau O,Rapaport S,Bazin R,et al.Impact of high volume hemofiltration on hemodynamic disturbance and outcome during septic shock.ASAIO J,2004,50(1):102-109.
9Honore PM,Jamez J,Wauthier M,et al.Prospective evaluation of short-term,high-volume isovolemic hemofiltration on the hemodynamic course and outcome in patients with intractable circulatory failure resulting from septic shock.Crit Care Med,2000,28(11):3581-3587.
10 Jiang HL,Xue WJ,Li DQ,et al.Influence of continuous veno-venous hemofiltration on the course of acute pancreatitis.World J Gastroenterol,2005,11(31):4815-4821.
11 Joannes-Boyau O,Honoré PM,Perez P,et al.High-volume versus standard-volume haemofiltration for septic shock patients with acute kidney injury (IVOIRE study):a multicentre randomized controlled trial.Intensive Care Med,2013,39(9):1535-1546.
12 Kielstein JT,David S.Pro:Renal replacement trauma or Paracelsus 2.0.Nephrol Dial Transplant,2013,28(11):2728-2731.
13 Maynar Moliner J,Honore PM,Sánchez-Izquierdo Riera JA,et al.Handling continuous renal replacement therapy-related adverse effects in intensive care unit patients:the dialytrauma concept.Blood Purif,2012,34(2):177-185.
14 Maynar-Moliner J,Sanchez-Izquierdo-Riera JA,Herrera-Gutierrez M.Renal support in critically ill patients with acute kidney injury.N Engl J Med,2008,359(18):1960; author reply 1961-1962.
15 Rimmelé T,Wey PF,Bernard N,et al.Hemofiltration with the Cascade system in an experimental porcine model of septic shock.Ther Apher Dial,2009,13(1):63-70.
16 张凯悦,龚德华,徐斌,等.不同剂量和模式连续性肾脏替代治疗对氨基酸的清除.肾脏病与透析肾移植杂志,2012,21(3):223-227.
17 Ronco C,Bellomo R,Homel P,et al.Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure:a prospective randomised trial.Lancet,2000,356(9223):26-30.
18 VA/NIH Acute Renal Failure Trial Network,Palevsky PM,Zhang JH,O′Connor TZ,et al.Intensity of renal support in critically ill patients with acute kidney injury.N Engl J Med,2008,359(1):7-20.
19 RENAL Replacement Therapy Study Investigators,Bellomo R,Cass A,Cole L,et al.Intensity of continuous renal-replacement therapy in critically ill patients.N Engl J Med,2009,361(17):1627-1638.
20 Honoré PM,Matson JR.Extracorporeal removal for sepsis:Acting at the tissue level--the beginning of a new era for this treatment modality in septic shock.Crit Care Med,2004,32(3):896-897.
21 Di Carlo JV,Alexander SR.Hemofiltration for cytokine-driven illnesses:the mediator delivery hypothesis.Int J Artif Organs,2005,28(8):777-786.
22 Kalil AC,Florescu MC.Blood purification:can we purify our patients from sepsis? Crit Care Med,2013,41(9):2244-2245.
23 Rimmelé T,Kellum JA.Clinical review:blood purification for sepsis.Crit Care,2011,15(1):205.
24 Peng Z,Singbartl K,Simon P,et al.Blood purification in sepsis:a new paradigm.Contrib Nephrol,2010,165:322-328.
25 Wu B,Gong D,Ji D,et al.Clearance of myoglobin by high cutoff continuous veno-venous hemodialysis in a patient with rhabdomyolysis:A case report.Hemodial Int,2014.
26 Grima DT,Airia P,Attard C,et al.Modelled cost-effectiveness of high cut-off haemodialysis compared to standard haemodialysis in the management of myeloma kidney.Curr Med Res Opin,2011,27 (2):383-391.

