肾小球滤过率估算公式的发展改进及应用
安 玉 综述 刘志红 审校
慢性肾脏病(CKD)发病率在不断增加,已成为全球性的公共卫生问题。据统计,我国CKD发病率已达10.8%[1]。肾小球滤过率(GFR)对于CKD患者的评估、管理和判断预后等方面均具有重要意义。然而,在临床实践中,实际GFR值的获取存在一定难度,往往需要依赖各种公式对GFR进行间接估算。现有的GFR公式种类繁多,如何针对不同人群选用合适的估算公式,是开展临床和科研工作需要考虑的问题。
基于血清肌酐(SCr)的估算公式
2002年肾脏疾病生存质量指导(KDOQI)颁布的“CKD临床实践指南”(以下简称KDOQI指南)[2]和2012年改善全球肾脏病预后组织(KDIGO)颁布的“CKD评估与管理临床实践指南”(以下简称KDIGO指南)[3]均推荐联合SCr及其估算的GFR值(eGFR)进行肾功能的评估。基于SCr的GFR估算公式有很多,其原理均是根据SCr、人口学及临床指标(种族、年龄、性别等)与实际GFR之间的关系进行回归分析推导而来。由于这些公式在推导的过程中纳入的人群、基础GFR状况及SCr检测方法等不同,其准确性也各不相同。
Cockcroft-Gault(CG)公式CG公式是1976年由Cockcroft-Gault等提出的计算内生肌酐清除率(Ccr)的公式[4]。该公式是从236例成人(男性226例)中推导得出的,包括SCr、年龄、体重、性别等4个变量,使用简便,曾一度应用十分广泛,并为2002年的KDOQI指南所推荐[2]。但由于该公式纳入的对象主要是男性(96%),实际肾功能以24 h Ccr[平均72.7±36.6 ml/(min·1.73m2)]作为标准进行推导,且估算结果受体重影响较大,随着人们对肾脏病认识的不断加深及各种临床研究的广泛开展,其准确性已无法满足临床需求。
肾脏病饮食改良(MDRD)公式
原始MDRD公式 为了更准确地评估GFR,1999年MDRD工作组开发出了新的公式。MDRD研究是一项多中心、随机的临床试验,其目的是探讨限制饮食中蛋白质的摄入及严格控制高血压对CKD进展的影响。该研究共纳入1 785例CKD患者,其中1 628例患者在基线进行了实际GFR的检测[平均39.8±21.2 ml/(min·1.73m2)],所有基线SCr均在统一的实验室通过苦味酸法检测,实际GFR值以125Ⅰ标记的碘他拉酸钠肾脏清除率为参考。随机选取1 070例患者进行公式的推导,并在其余558例患者中进行验证,得出原始的MDRD公式(即公式7,7GFR)[5]。该公式共纳入6个与GFR独立相关的变量(SCr、年龄、性别、种族、血清尿素氮和白蛋白),最终结果为经标准体表面积校正后的值。验证试验表明其准确性(R2=0.903)优于CG公式(R2=0.842)及Ccr(R2=0.866)[5]。
2000年,MDRD工作组对该公式进行了简化(aGFR),仅保留了SCr、年龄、性别、种族4个变量[6]。研究表明,简化的MDRD公式(R2=0.892)准确性优于CG公式及Ccr。与原始的MDRD公式相比,其准确性下降不明显,但临床应用更为便捷,因此亦为KDOQI指南所推荐[2]。
新的MDRD公式如前所述,原始的MDRD公式中SCr是通过苦味酸法进行检测的,而苦味酸法特异性较差,检测过程中易受多种内源性及外源性因素的干扰,其结果易对GFR的估算造成系统误差。因此,MDRD研究组在统一的实验室用新的酶标法对1 628 例患者的基线SCr进行的重新检测后,于2005年开发出了新的MDRD公式(rMDRD)[7]。新公式保留的原始公式的各个变量,但对公式中的参数做了调整。验证试验表明,对CKD患者[尤其是GFR<90 ml/(min·1.73m2)者],新公式准确性较CG公式更佳,可对GFR进行较为准确的估算[8]。
2006年美国国家肾病教育项目(NKDEP)实验组通过比较不同的SCr检测方法后提出,以同位素稀释质谱法(IDMS)为标准,SCr检测的误差应控制在10%以内,否则会影响GFR的评估[9]。酶标法因其特异性高,检测偏倚小,成为2012年KDIGO指南推荐的SCr检测方法[3]。随着该方法的普及,rMDRD公式已较原始公式应用更为广泛。
MDRD公式临床应用的评价MDRD公式对GFR估算公式的发展具有深远的影响。其纳入的样本量大,并包含不同种族(黑人和非黑人),所有患者实际GFR均通过同位素法得出,精确度较高,偏倚较小。该公式明确了与GFR相关的独立变量,这些变量也为后来的GFR估算公式所沿用。同时该公式首次用酶标法校准基线SCr后进行GFR的估算,减少了检测方法对GFR估算的影响,至今仍普遍应用于临床一线。
但是,由于MDRD研究纳入的研究对象均为CKD患者,其中CKD 3~5期患者占84.1%,而CKD 1期患者仅占2%,导致该公式在健康人群和CKD早期患者准确性下降。因此,NKDEP在推荐采用MDRD公式进行GFR估算的同时,强调当估算结果>60 ml/(min·1.73m2)时,不宜再报告确切值,而统一以“>60 ml/(min·1.73m2)”表示[9]。
改良的MDRD中国公式由于MDRD研究纳入的对象来自北美和欧洲(主要包括黑人和白人),不同的遗传背景、饮食习惯可影响GFR的估算,2006年全国eGFR课题协作组开发出了适合中国CKD患者的GFR估算公式。该项研究共纳入684例CKD患者,随机选取454例为公式开发组,230例为验证组。所有基线SCr均通过苦味酸法测定,实际GFR值以双血浆法99mTc-DTPA血浆清除率为参考[平均55.1±35.1 ml/(min·1.73m2)],在原始MDRD公式的基础上,推导出了改良的MDRD中国公式(c-7GFR和c-aGFR)[10]。
CKD流行病学协作组(CKD-EPI)公式因为MDRD公式在GFR较高时存在缺陷,2009年CKD-EPI再次进行了多中心、大样本的横断面研究,推出了CKD-EPI公式[11]。该项研究共纳入8 254例患者进行公式的推导,3 896例患者进行验证。所有基线SCr均通过酶标法进行检测,实际GFR值以125Ⅰ标记的碘他拉酸钠肾脏清除率为参考[平均68±40 ml/(min·1.73m2)]。CKD-EPI公式采用了与简化的MDRD公式相同的4个变量,不同的是纳入的样本量更大(其中亚洲人群约占1%),基线平均GFR更高,并根据SCr范围的不同(男性>0.9 mg/dl,女性>0.7 mg/dl)采用不同的估算公式,以期对不同范围的GFR进行更准确的评估。
Levey等[11]验证研究表明,当GFR<60 ml/(min·1.73m2)时,CKD-EPI公式的准确性与rMDRD公式相当,而在GFR>60 ml/(min·1.73m2)时,其准确性优于后者(图1)[11]。对16 032例研究对象采用不同公式计算比较发现,在GFR<45 ml/(min·1.73m2)时,这两个公式估算结果大致相当,但CKD-EPI公式计算的总体平均eGFR值[94.5 ml/(min·1.73m2)]则高于MDRD公式[85.0 ml/(min·1.73m2)],从而使其推导的CKD发病率要低于后者(图2)。Matsushita等[12]研究表明,经aMDRD公式估算eGFR在45~59 ml/(min·1.73m2)(即CKD3a期)的患者,有34.7%在利用CKD-EPI公式重新计算后eGFR在60~89 ml/(min·1.73m2)(即CKD 2期),且利用CKD-EPI公式计算的eGFR值与预后[包括全因死亡率、心血管死亡率及终末期肾病(ESRD)发生率]相关性更好[12]。

图1 根据CKD-EPI公式与rMDRD公式所得eGFR与实际GFR差异比较[11]
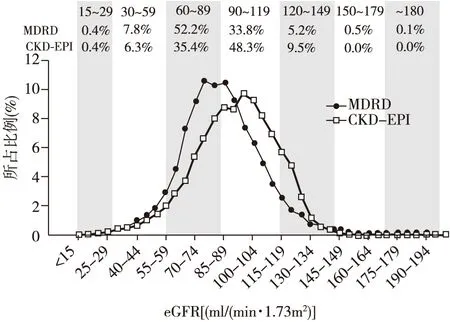
图2 不同公式对16 032例样本eGFR分布比较[11]
目前已有多项研究对上述公式的准确性进行比较[11,13-18]。绝大多数研究中,CKD-EPI公式比简化的MDRD公式偏倚更小,精确度和准确性更高[尤其是当GFR>60 ml/(min·1.73m2)],但也有少数研究显示了不同的结果(表1),这可能与不同研究纳入的人群不同有关。由于CKD-EPI公式在GFR较高时具有更高的准确性,可提供确切的GFR以供临床应用,因此在许多大型临床研究中已逐步取代MDRD公式,成为目前KDIGO指南推荐应用的公式[3]。
国内研究中,顾红霞等[19]对1 033例CKD患者的研究中,以99mTc-DTPA肾动态显像法测定的GFR作为标准[平均49.1±30.75 ml/(min·1.73m2)],酶标法检测SCr,结果显示CKD-EPI公式要优于7GFR、aGFR、c-7GFR和c-aGFR。苏超等[20]对304例CKD患者的研究中,以99mTc-DTPA肾动态显像法测定的GFR作为标准[平均55.09±26.16 ml/(min·1.73m2)],苦味酸法检测SCr,结果亦显示CKD-EPI公式优于aGFR和c-aGFR。尽管如此,研究表明CKD-EPI公式在北美、欧洲和澳大利亚人群的准确性优于这些区域以外的人群[21],提示CKD-EPI公式应用于中国人群仍有待改进。
基于SCr的GFR估算公式的影响因素SCr的来源包括从食物中摄取的外源性肌酐和体内细胞代谢产生的内生性肌酐。肾功能正常者肌酐绝大部分通过肾小球滤过进入原尿,少部分通过肾小管分泌排出。肾功能减退时部分肌酐需依赖肾外途径清除(主要是肝脏和肠道)。多种病理生理机制可影响SCr水平(包括GFR相关因素和非GFR相关因素),进而影响GFR估算结果。非GFR相关因素主要包括:(1)影响肌酐生成的因素:如种族、年龄、性别、肌肉容积、体型、饮食及营养状态等;(2)影响肾小管分泌肌酐的因素:如甲氧氨苄嘧啶、西咪替丁等;(3)影响肌酐肾外清除途径的因素:如抗生素可影响肠道微生物活性,进而减少肠道肌酐清除;(4)SCr不稳定:急性肾损伤时,不推荐采用此类公式进行GFR的评估;(5)检测方法的影响:不同的SCr检测方法、公式推导过程中采用不同的实际GFR参考标准等[3,22]。
一般而言,各种估算公式的最佳适用范围应符合开发该公式的样本特点,以减少非GFR相关因素对估算结果造成的影响。由于准确的SCr检查结果对GFR的评估至关重要,目前推荐在体外采用标准化参考物质和参考测量程序,将标准化的肌酐检测方法用于GFR的评估,以减少不同的检测手段及仪器带来的误差[9]。

表1 不同研究对CKD-EPI和rMDRD公式的比较
基于胱抑素C(CysC)的GFR估算公式
CysC是一种理想的内源性GFR标志物,每日分泌量恒定,不受饮食和肌肉容积影响,并可自由通过肾小球滤过膜,不被肾小管分泌,在反映早期肾功能损害方面要优于SCr。尽管如此,研究表明在联合性别、种族、年龄等变量后,与SCr相比,CysC在估算GFR方面的优势不再明显[18],而两者联合评估GFR的准确性则优于单一因素[23]。此外,CysC浓度可受到甲状腺功能、激素治疗、肥胖、炎症等多种肾外因素的影响,其具体代谢机制并不明确[24,25]。目前尚无证据表明CysC在CKD患者中的作用可取代SCr。
目前在标准化的检测方法基础上发展出来的基于CysC的GFR估算公式也有很多[23,26,27]。其中2012 CKD-EPI CysC公式使用简便,精确度高,并适用于不同人群[23]。由于当GFR <60 ml/(min·1.73 m2)时,由2009 CKD-EPI公式估算的eGFR总体略低于实际GFR(图1),在eGFR轻度降低而无其他肾损伤证据(血、尿成分异常或影像学检查异常)时,该结果有可能对是否存在CKD产生误判。目前KDIGO指南将CysC作为一种补充手段,在以SCr估算的eGFR值处于45~59 ml/(min·1.73m2)且无其他肾脏损伤的证据时,推荐联合应用2012 CKD-EPI CysC公式,来明确能否诊断CKD,即当两者估算的GFR均<60 ml/(min·1.73m2)时,CKD的诊断方可确定[3]。
一项纳入93 710例患者的Meta分析结果显示,经2012 CKD-EPI CysC公式计算的CKD发生率[指GFR<60 ml/(min·1.73m2)]较基于SCr的2009 CKD-EPI公式相比要高,且与后者相比,无论是在普通人群还是在CKD患者,由前者得出的eGFR与终点事件(包括全因死亡率、心血管死亡率及ESRD发生率)相关性更高[28]。
估算GFR的临床意义
已知精确的GFR估算对于CKD的诊断和分期均有重大意义,近来其在评价CKD的进展方面的作用也日益受到重视。以往肾脏预后通常定义为SCr倍增或进展至ESRD,但这两个指标通常需要观察很长时间,且一旦发生已处于晚期,不利于病情的及时评估和临床研究的开展,因此需要寻找更敏感且能短期内协助判断预后的指标[29]。
最近Coresh等[30]纳入170万例患者的Meta分析结果显示,无论是eGFR<60还是≥60 ml/(min·1.73 m2)的患者,一定时间内eGFR变化的幅度与发生死亡及进展至ESRD的风险均显著相关,下降幅度较大者,发生死亡/ESRD的风险亦明显升高。此外,对CKD-EPI公式而言,当SCr>0.9 mg/dl(男性)或>0.7 mg/dl(女性)时,肌酐倍增近似于eGFR下降约57%,这意味着对于CKD早期、病情进展较缓慢的患者,临床研究以肌酐倍增作为随访终点仍需花费大量时间,而eGFR的轻度下降发生率更高,且与预后相关,因此eGFR的轻度下降(例如2年内下降30%)可作为一个有效的终点事件评估CKD的进展,缩短临床试验的观察时间并节省人力物力。
小结:精确的GFR估算对于CKD的诊断、分期、判断预后均意义重大。经过数十年的演变,GFR估算公式的发展已日趋成熟。但不论运用哪一种公式,其结果与实际GFR值之间均存在一定差异。比较而言,MDRD公式对CKD 3~5期的患者可进行较为准确的GFR评估,CKD-EPI公式可弥补其在GFR较高时的缺陷,因而成为目前KDIGO指南推荐应用的公式。部分患者尚需结合以CysC为基础的估算公式对GFR进行综合判断。
1Liu ZH.Nephrology in China.Nat Rev Nephrol,2013,9(9):523-528.
2National Kidney Foundation.K/DOQIclinical practice guidelines for chronic kidney disease:evaluation,classification and stratification.Am J Kidney Dis,2002,39 (2 suppl 1):S1-266.
3Kidney Disease:Improving Global Outcomes (KDIGO).KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.Kidney Int Suppl,2013,3(1):1-150.
4Cockcroft DW,Gault MH.Prediction of creatinine clearance from serum creatinine.Nephron,1976,16(1):31-41.
5Levey AS,Bosch JP,Lewis JB,et al.A more accurate method to estimate glomerular filtration rate from serum creatinine:a new prediction equation.Modification of Diet in Renal Disease Study Group.Ann Intern Med,1999,130(6):461-470.
6Levey AS,Greene T,Kusek J.A simplified equation to predict glomerular filtration rate from serum creatinine [Abstract].J Am Soc Nephrol,2000,11:155A.
7Levey AS,Coresh J,Greene T,et al.Expressing the MDRD Study equation for estimating GFR with IDMS traceable (gold standard) serum creatinine values [Abstract].J Am Soc Nephrol,2005,16:69A.
8Levey AS,Coresh J,Greene T,et al.Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate.Ann Intern Med,2006,145(4):247-254.
9Myers GL,Miller WG,Coresh J, et al.Recommendations for improving serum creatinine measurement:a report from the Laboratory Working Group of the National Kidney Disease Education Program.Clin Chem,2006,52(1):5-18.
10 Ma YC,Zou L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease.J Am Soc Nephrol,2006,17(10):2937-2944.
11 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
12 Matsushita K,Mahmoodi BK,Woodward M,et al.Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate.JAMA,2012,307(18):1941-1951.
13 Tent H,Rook M,Stevens LA,et al.Renal function equations before and after living kidney donation:a within-individual comparison of performance at different levels of renal function.Clin J Am Soc Nephrol,2010,5(11):1960-1968.
14 Michels WM,Grootendorst DC,Verduijn M,et al.Performance of the Cockcroft-Gault,MDRD,and new CKD-EPI formulas in relation to GFR,age,and body size.Clin J Am Soc Nephrol,2010,5(6):1003-1009.
15 White CA,Akbari A,Doucette S,et al.Estimating glomerular filtration rate in kidney transplantation:is the new chronic kidney disease epidemiology collaboration equation any better? Clin Chem,2010,56(3):474-477.
16 Cirillo M,Lombardi C,Luciano MG,et al.Estimation of GFR:a comparison of new and established equations.Am J Kidney Dis,2010,56(4):802-804.
17 Lane BR,Demirjian S,Weight CJ,et al.Performance of the chronic kidney disease-epidemiology study equations for estimating glomerular filtration rate before and after nephrectomy.J Urol,2010,183(3):896-901.
18 Eriksen BO,Mathisen UD,Melsom T,et al.Cystatin C is not a better estimator of GFR than plasma creatinine in the general population.Kidney Int,2010,78(12):1305-1311.
19 顾红霞,秦利,傅宏亮,等.基于血清肌酐的肾小球滤过率估算值与99mTc-肾小球滤过率的相关性.上海交通大学学报(医学版),2010,30(11):1376-1379.
20 苏超,张桂霞,王瑞峰,等.CKD-EPI方程估算中国慢性肾脏病患者肾小球滤过率的适用性评价.中华疾病控制杂志,2013,17(7):621-624.
21 Earley A,Miskulin D,Lamb EJ,et al.Estimating equations for glomerular filtration rate in the era of creatinine standardization:a systematic review.Ann Intern Med,2012,156(11):785-795.
22 Stevens LA,Levey AS.Measured GFR as a confirmatory test for estimated GFR.J Am Soc Nephrol,2009,20(11):2305-2313.
23 Inker LA,Schmid CH,Tighiouart H,et al.Estimating glomerular filtration rate from serum creatinine and cystatin C.N Engl J Med,2012,367(1):20-29.
24 Stevens LA,Schmid CH,Greene T,et al.Factors other than glomerular filtration rate affect serum cystatin C levels.Kidney Int,2009,75(6):652-660.
25 Stevens LA,Padala S,Levey AS.Advances in glomerular filtration rate estimating equations.Curr Opin Nephrol Hypertens,2010,19(3):298-307.
26 Stevens LA,Coresh J,Schmid CH,et al.Estimating GFR using serum cystatin C alone and in combination with serum creatinine:a pooled analysis of 3,418 individuals with CKD.Am J Kidney Dis,2008,51(3):395-406.
27 Inker LA,Eckfeldt J,Levey AS,et al.Expressing the CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) cystatin C equations for estimating GFR with standardized serum cystatin C values.Am J Kidney Dis,2011,58(4 ):682-684.
28 Shlipak MG,Matsushita K,rnlöv J,et al.Cystatin C versus creatinine in determining risk based on kidney function.N Engl J Med,2013,369(10):932-943.
29 National Kidney Foundation.Research:GFR decline as an endpoint in clinical trials for CKD.Accessed October 15,2013.http://www.kidney.org/professionals/research/research_info.cfm.
30 Coresh J,Turin TC,Matsushita K,et al.Decline in Estimated Glomerular Filtration Rate and Subsequent Risk of End-Stage Renal Disease and Mortality.JAMA,2014,311(24):2518-2531.

