C3肾病的临床病理特征及预后分析
张 涛 章海涛 徐 峰 黄 倩 王金泉 曾彩虹 陈慧梅 刘志红
C3肾病(C3G)是2010由Fakhouri等[1]提出的肾小球疾病新分型,是从膜增生性肾小球肾炎中分离出来的[2],经Hou等[3]对8个诊断标准的比较验证,2013年英国Pickering等[4]提出了C3G诊断的专家共识。C3G依据免疫病理特征命名,突出表现为肾组织补体C3和电镜下电子致密物的沉积。目前研究认为,这类疾病主要由补体旁路途径激活、沉积及降解异常导致[1]。据超微结构特征分为致密物沉积病(DDD)和C3肾小球肾炎(C3GN)。目前临床实践中C3G仍有许多问题尚未明确,中国和亚洲地区也缺乏大样本的研究,本研究通过对G3G患者和亚型的临床、病理及预后特征分析,从而加深对该疾病的认识。
对象和方法
研究对象1985年9月至2014年2月在南京军区南京总医院肾脏科行肾活检的患者,根据肾脏病理特征共54例明确诊断C3G[4]。诊断标准为:光镜下可见肾小球系膜增生、膜增生、毛细血管内皮增生或新月体;免疫荧光为显著C3沉积,C3的量至少比其他免疫球蛋白和补体成分高2个级别(含量等级包括0、微量、+、++和+++),可伴少量免疫球蛋白的沉积;电镜下多数病例有电子致密物沉积于肾小球基膜,也可沉积于系膜区、毛细血管袢和肾小管基膜等;并排除感染后肾小球肾炎、系统性红斑狼疮、冷球蛋白血症、淀粉样变性、慢性乙型或丙型肝炎病毒感染、甲状腺相关疾病及恶性肿瘤等。进一步依据电镜下特征,分为DDD(15例):肾小球基膜内出现均质飘带状电子致密物沉积[5];C3GN(39例):电镜下电子致密物沉积达不到DDD标准[6]。
临床资料与相关定义一般资料及实验室检查:性别、年龄、基线肾脏病病程、首发症状、肾外损害的症状体征及实验室检查:活检时24 h尿蛋白定量、镜下血尿、血红蛋白、血清肌酐(SCr)、血清白蛋白、球蛋白、补体C3/C4。并且记录患者治疗、随访时间和肾脏生存情况等。
儿童定义为年龄<16周岁。肾活检时肾脏病病程定义为从发现肾脏病至行肾活检的时间。高血压定义为成人静息状态下收缩压≥140 mmHg和(或)舒张压≥90 mmHg。随访时间定义为从病理诊断至进入随访终点的时间,或至最近1次临床随访时间。镜下血尿为尿沉渣红细胞计数>20万/ml。新月体型肾炎定义为包含新月体的肾小球比例大于50%。慢性肾脏病3期定义为估算的肾小球滤过率(eGFR)30~60 ml/(min·1.73m2)。随访终点定义为eGFR<15 ml/(min·1.73m2)或持续肾脏替代治疗。
病理资料与相关定义所有病例均在B 超引导下行肾活检术。活检组织经甲醛固定,行光镜、免疫荧光及电镜检查。光镜染色包括HE、PAS、PASM-Masson及Masson三色染色。直接免疫荧光法检测肾组织中IgG、IgA、IgM、C3、C4、C1q和Fibrin,观察免疫球蛋白和补体沉积的部位和强度。电镜组织以3.75%冷戊二醛固定,1%四氧化锇后固定,70~80 nm超薄切片,醋酸铀、柠檬酸铅霜染色,置Hitachi 7500透射电子显微镜下观察。每例患者肾活检标本的病理评分均在PAS染色上进行。按照病理分型标准,肾小管萎缩与间质纤维化(IFTA):1分(IFTA病变范围<25%);2分(IFTA病变范围25%~50%);3分(IFTA病变范围>50%)。新月体、袢坏死、血管硬化等,则按照有无该项病变进行区分。
统计方法采用SPSS 19.0统计软件进行数据分析。正态分布数据以均值±标准差表示,组间比较使用t检验。非正态分布数据以中位数(范围)表示,组间比较采用Man-Whitney、Kruskal-Wallis检验。分类变量以率表示,组间比较采用Pearsonχ2检验或Fisher精确检验。利用Kaplan-Meier法和COX回归模型进行患者的肾脏生存分析。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
本研究共纳入C3G 54例,其中DDD 15例,C3GN 39例(10例DDD和17例C3GN曾分别独立报道[7,8])。54例患者中无同一家系的患者,肾活检时平均年龄(31.7±16.1)岁,中位肾脏病病程为13月(表1)。DDD与C3GN组年龄上有显著差异(P=0.011);本中心1986年开始诊断DDD,呈散发趋势,28年的平均年肾活检检出率0.04%。本中心2009年起诊断G3GN,年检出率逐年增加,2013年为0.16%。
临床表现及实验室检查特点C3G患者起病表现为肾病综合征者24例,肉眼血尿9例,镜下血尿34例,急性肾损伤13例,SCr升高12例,1例C3GN患者起病时需透析治疗,综合治疗后摆脱。44例(81.5%)血清C3降低,61%患者抗链球菌溶血素“O”(ASO)检测高于正常值。
亚组比较,DDD组并发高血压明显低于C3GN组(P=0.031)。两组的平均蛋白尿水平相似,但DDD组肾病综合征发生率达60%,与C3GN组比较,DDD组血清白蛋白水平明显偏低(P=0.009,表1)。
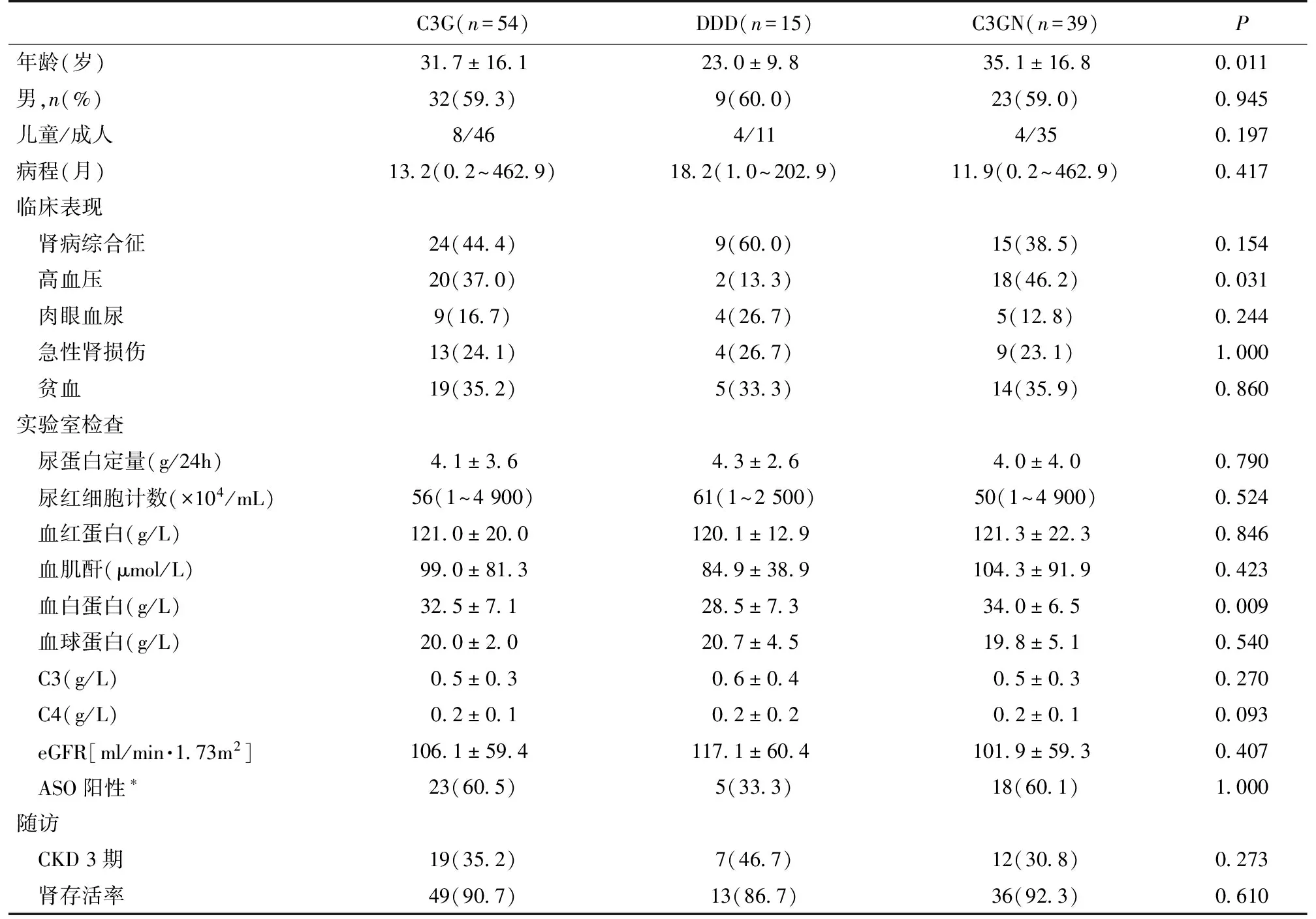
表1 C3G患者的临床及实验室资料
肾脏组织学特征
本研究中C3G患者肾小球以膜生生样病变为主(34例,63%),其次为系膜增生病变(15例,27.8%),11例(20.4%)患者新月体形成。近一半的C3G患者发生血管病变。免疫荧光染色示C3G患者C3沉积部位主要为毛细血管袢和系膜区,32例(59.3%)患者血管袢和系膜区均有沉积。C3G患者免疫球蛋白染色阴性22例(40.7%),IgM阳性最常见。电镜观察电子致密物沉积部位和C3沉积部位符合。
两个亚组间比较,DDD和C3GN患者光镜下肾小球病变无明显统计学差异。DDD患者多见新月体病变,特别是新月体比例大于50%的。DDD患者肾小管基膜和间质血管C3沉积明显多于C3GN组(P<0.001和P=0.004),DDD组免疫球蛋白沉积多于C3GN组。电镜下除肾小球基膜内电子致密物沉积,C3GN组电子致密物常沉积于系膜区、内皮下和上皮侧,而DDD患者常沉积于肾小球包囊壁和肾小管基膜,两组间有显著统计学差异(表2)。

表2 C3G患者的肾组织病理特点
治疗及预后
C3G患者接受了各种免疫抑制剂的治疗,药物的使用频率无明显差异,DDD和C3GN组间治疗也无明显差异。C3G患者的中位随访时间为25.9月,随访过程中进展至终末期肾病(ESRD)患者为9.3%(2例DDD,3例C3GN)。运用多元Logistic回归统计,无临床、实验室及肾脏病理因素与C3G进展至ESRD相关。COX回归生存分析发现,肾活检时SCr>132.6 μmol/L增加5年后进展为ESRD的风险(P=0.005)。Kaplan-Meier法分析DDD和C3GN两组患者累积肾脏存活率,两组间无明显差异(图1)。

图1 DDD与C3GN患者累积肾存活率比较
此外,31例C3G患者曾行C3肾炎因子检测,3例(9.7%)阳性,5例DDD检测者中有1例阳性,随访7.5年进入CKD 3期;检测的26例C3GN患者中2例阳性,分别随访4年和6.5年肾功能无异常。另有15例患者(1例DDD,14例G3GN)行免疫固定电泳检查,5例C3GN患者单克隆免疫球蛋白阳性,平均随访1年,未发现进展为骨髓瘤。
讨 论
本研究回顾性分析了单中心54例C3G患者临床病理及预后特点,在中国乃至亚洲是样本量最大的相关研究。目前亚洲地区C3G报道较少,国内只有肖慧捷报道了3例儿童患者[9],章海涛等[7]和喻小娟等[10]分别报道了17例和12例C3肾炎患者,其他均为个案报道,美国Jean等报道了128例C3G患者中亚洲人种仅4例[3]。法国C3G的队列研究和塞浦路斯肾病队列研究中,入组患者近100例,男女比例无统计学差异[11-13],本研究中性别分布也无差异。随着对C3G认识的加深,C3G年检出率有上升趋势,特别是C3GN。目前尚无C3G流行病学的确切报道,本中心年肾活检检出率为0.03%~0.16%。
进一步C3G亚组分析,DDD组活检时平均年龄明显低于C3GN(P=0.011)。DDD患者发病年龄低,也已被多个报道证实[8,14],Servais等[11]报道C3GN与DDD年龄比为(30.3±19.3岁vs18.9±17.7岁),但也有报道约20%的DDD患者发病年龄较晚[8,15]。Servais等[11]报道的C3G与膜增生性肾小球肾炎Ⅰ型患者比较,除年龄和肾病综合征外,其余临床表现无统计学差异。 Jean等[3]报道75%的C3G患者存在血清补体C3减低而C4正常。本研究中比例为77.8%,DDD和C3GN间血清C3水平无明显差异。既往队列研究报道C3GN患者蛋白尿水平要低于DDD患者(3.6±3.3vs5.6±4.5g)[16],本研究中两组间无明显统计学差异,只在血清白蛋白水平及高血压发生率上有差异,DDD患者血清白蛋白更低。另外,我们发现61%的C3G患者ASO检测阳性,尤其C3GN患者,进一步提示感染可能是其诱因之一。既往报道DDD的肾外表现有眼玻璃膜疣、脂肪营养障碍、1型糖尿病和意义未明的单克隆免疫球蛋白病等[2,5],本研究中未发现相关性,但C3GN中意义未明的单克隆免疫球蛋白病检出率较高,达35.7%。
近两年有不同中心的学者报道了C3G的病理特征,但是结论并不一致。Nicolas等[17]报道C3G肾小球病变55%为膜增生样病变,DDD与C3GN比较肾脏间质纤维化有差异,C3GN肾组织仅有C3沉积的比例也高于DDD(58%vs33%)。本研究发现C3G肾小球病变也以膜增生样病变为主,其次为系膜增生性病变,少量为内皮增生及新月体型,这与目前定义及报道是一致的,而肾小管及间质的病变无明显差异。虽然DDD患者新月体发生率高,C3GN动脉硬化发生率高,但两组间都无统计学差异,而血管病变可能和患者年龄差异有关。本研究中C3G患者免疫荧光C3主要沉积于血管袢和系膜区,这与既往报道也是一致的[16]。而我们发现DDD患者C3也大量沉积于肾小管基膜和间质血管壁,与C3GN组比较有统计学差异,这是以前未曾报道的。电镜下DDD患者电子致密物除沉积于基膜内,还沉积于包囊壁和肾小管基膜,与C3GN组比较有统计学差异,这与既往报道一致,但本组DDD患者包囊壁及肾小管基膜电子致密物沉积比例明显高于既往报道。免疫荧光C3沉积部位和电镜结果相一致,这也进一步提示DDD和C3GN可能存在不同的病理生理机制。免疫球蛋白的沉积在既往报道中也不一致,目前报道在DDD患者中,仅41%无免疫球蛋白沉积,约1/3的DDD患者肾小球有IgG沉积,约59%伴IgM沉积[16,18]。Nicolas等[17]报道C3G IgM沉积率达49%,也有报道C3GN以IgG沉积为主[3,19]。本研究中C3G免疫球蛋白沉积以IgM为主,无免疫球蛋白沉积的患者达40.7%,C3GN组多见。
既往报道C3G预后与年龄、新月体形成有关,DDD也增加预后风险[16],而Servais等[11]报道DDD成人患者预后较C3GN差, DDD儿童患者与C3GN患者随访10年预后无差异[20]。本研究中C3GN和DDD患者随访5年累积肾生存率无差异,据COX回归校正,肾活检时SCr增高是患者肾脏预后的危险因素。
目前C3G治疗的研究主要局限于个案研究和回顾性研究,缺少随机对照研究。非特异性的一些治疗包括控制血压、降蛋白尿治疗,特别应用ACEI/ARB,可延缓肾脏损害。关于霉酚酸酯和利妥昔单抗等抗细胞免疫抑制治疗的疗效目前报道不一[15,21]。目前尚无证据支持C3G可采用血浆治疗。抗补体C5的单克隆抗体(依库珠单抗,eculizumab)在大部分国家尚在临床试验阶段,在国外3个病例报道及一个小型实验中证实其能减轻疾病[21,22]。本研究中主要为免疫抑制治疗,COX回归显示其对预后无明显影响。Smith等[22]报道了DDD的治疗流程,主要依据补体替代途径评估情况选择治疗方式。本研究中检测了部分患者的补体旁路途径调节蛋白水平及基因突变,病例较少,需进一步完善补体旁路评估手段及进行基因筛查以指导治疗。
小结:本研究回顾性分析了C3G患者的临床、病理及预后特征,并对G3GN和DDD亚组进行了比较,有助于促进这一疾病临床诊疗的提高。本研究的样本量仍偏小,对于发现的疾病特征还需要更多的临床研究加以验证,并进行机制的探讨以指导治疗。
1Fakhouri F,Frémeaux-Bacchi V,No⊇l LH,et al.C3 glomerulopathy:a new classification.Nat Rev Nephrol,2010,6(8):494-499.
2D’Agati VD,Bomback AS.C3 glomerulopathy:what’s in a name? Kidney Int,2012,82(4):379-381.
3Hou J,Markowitz GS,Bomback AS,et al.Toward a working definition of C3 glomerulopathy by immunofluorescence.Kidney Int,2014,85(2):450-456.
4Pickering MC,D’Agati VD,Nester CM,et al.C3 glomerulopathy:consensus report.Kidney Int, 2013,84(6):1079-1089.
5Zhang Y,Meyer NC,Wang K,et al.Causes of alternative pathwaydysregulation in dense deposit disease.Clin J Am Soc Nephrol,2012,7(2):265-274.
6Sethi S,Fervenza FC,Zhang Y,et al.C3 glomerulonephritis:clinicopathological findings,complement abnormalities,glomerular proteomic profile,treatment,and follow-up.Kidney Int,2012,82(4):465-473.
7章海涛,陈惠萍,曾彩虹,等.C3肾小球肾炎的临床表现及病理特征.肾脏病与透析肾移植杂志,2011,20(4):307-11.
8Wang J,Tang Z,Luo C,et al.Clinical and pathological features of dense deposit disease in Chinese patients.Clin Nephrol.2012 Sep;78(3):207-115.
9He RJ,Xiao HJ,Wang SX,et al.Characteristics of pediatric C3glomerulopathy with decreased factor H in 3 cases.Zhonghua Er Ke Za Zhi,2012,50(12):939-943.
10 喻小娟,刘刚,赵明辉.12例C3肾小球肾炎的临床病理特点及其血浆补体活化分析.中华肾脏病杂志,2011,27(11):797-801.
11 Servais A,No⊇l LH,Roumenina LT,et al.Acquired and genetic complement abnormalities play a critical role in dense deposit disease and other C3 glomerulopathies.Kidney Int,2012,82(4):454-164.
12 Deltas C,Gale D,Cook T,et al.C3 glomerulonephritis/CFHR5 nephropathy is an endemic disease in Cyprus:clinical and molecular findings in 21 families.Adv Exp MedBiol,2013,735:189-196.
13 Gale DP,Maxwell PH.C3glomerulonephritis and CFHR5 nephropathy.Nephrol Dial Transplant,2013,28(2):282-288
14 Lu DF,Moon M,Lanning LD,et al.Clinical features and outcomes of 98 children and adults with dense deposit disease.Pediatr Nephrol,2012,27(5):773-781.
15 Barbour TD,Pickering MC,Terence Cook H.Dense deposit disease and C3glomerulopathy.Semin Nephrol,2013,33(6):493-507.
16 Medjeral-Thomas NR,O’Shaughnessy MM,O’Regan JA,et al.C3 glomerulopathy:clinicopathologic features and predictors of outcome.Clin J Am Soc Nephrol,2014,9(1):46-53.
17 Nicolas C,Vuiblet V,Baudouin V,et al.C3 nephritic factor associated with C3 glomerulopathy in children.Pediatr Nephrol,2014,29(1):85-94.
18 Sethi S,Fervenza FC,Zhang Y,et al.C3 glomerulonephritis:clinicopathological findings,complement abnormalities,glomerular proteomic profile,treatment,and follow-up.Kidney Int,2012,82(4):465-473.
19 Kerns E,Rozansky D,Troxell ML.Evolution of immunoglobulin deposition in C3-dominant membranoproliferative glomerulopathy.Pediatr Nephrol,2013,28(11):2227-2231.
20 Servais A,No⊇l LH,Frémeaux-Bacchi V,et al.C3 glomerulopathy.Contrib Nephrol,2013,181:185-193.
21 Gurkan S,Fyfe B,Weiss L,et al.Eculizumab and recurrent C3 glomerulonephritis.Pediatr Nephrol,2013,28(10):1975-1981.
22 Smith RJ,Alexander J,Barlow PN,et al.New approaches to the treatment of dense deposit disease,J Am Soc Nephrol,2007,18(9):2447-2456.

