选择性COX-2抑制剂尼美舒利对人卵巢癌细胞株移植瘤生长的不同影响
石 琪,张科荣,王 平
(1.四川大学华西第二医院妇产科,四川 成都 610041;2.川北医学院附属医院妇产科,四川 南充 637000)
近年来,临床、基础及循证学研究均有证据支持非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDS),即环氧合酶(cyclooxygenasa,COX)抑制剂,特别是选择性COX-2抑制剂可降低卵巢癌的风险及抑制卵巢癌细胞株的生长、侵袭和转移[1-3],但也有研究指出应用NSAIDS和降低卵巢癌风险没有相关性[4-5],因此是否能应用COX抑制剂防治卵巢癌颇具争议。对NSAIDS抗癌机制尚不清楚,但其的基本药理作用是抑制COX活性,因此当肿瘤组织不表达COX,尤其是COX-2时,NSAIDS是否仍然具有抗肿瘤潜能,是否就此造成了在卵巢癌研究中结论的多样性,亟待探究。本研究初步探讨了选择性COX-2抑制剂尼美舒利(Nimesulide)对COX-2表达不同的人卵巢癌组织的影响,以期了解肿瘤的COX-2表达谱情况是否影响其抑制剂的抗肿瘤潜能。
1 材料与方法
1.1 材料和实验动物
Balb/c小鼠(nu-/nu-),雌性,6~8周龄,19~24 g,24只,购自四川大学华西医学中心实验动物中心。人卵巢腺癌SKOV-3细胞株由四川大学华西医学中心免疫教研室提供;人卵巢腺癌OVCAR-3细胞株购自中国科学院上海生科学院细胞资源中心。Nimesulide粉剂,购自Sigma公司。hVEGF-ELISA试剂盒,购自上海晶美生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养 SKOV-3及OVCAR-3细胞分别置于含10%热灭活新生小牛血清、青霉素100 000 U/L、链霉素100 mg/L及含20%热灭活类胎牛血清、0.01 mg/mL牛胰岛素、青霉素100 000 U/L、链霉素100 mg/L的RPMI1640细胞培养液中,在37 ℃、5%CO2、饱和湿度恒温密闭条件下传代培养。SKOV-3细胞呈片状贴壁生长,传代周期2~3 d;OVCAR-3细胞呈岛片状贴壁生长,传代周期约5~7 d。
1.2.2 建立荷瘤小鼠模型 准备预试验BALB/c雌性小鼠4只,试验小鼠20只,约6~8周龄,检疫1周,无异常。按上述培养条件培养观察细胞,当细胞数≥5×107个后将其消化,收集于离心管中离心(1 000 rpm、5 min)无血清培养基洗涤2次,同上离心;常规0.4%苔盼蓝染色计数,将活细胞数调制3×107mL。将细胞悬液接种于各预试小鼠右侧腋窝皮下组织内,0.2 mL/只;观察小鼠精神、食纳、睡眠等一般情况及游标卡尺测量肿瘤生长情况。当肿瘤长至接近2 cm×2 cm大小时,脱颈法处死小鼠,无菌条件下剥出肿瘤,两种肿瘤各分为10份,每份大小约0.5 cm×0.5 cm,植入试验小鼠右腋皮下。
1.2.3 分组治疗实验 分组:将植入相同肿瘤的小鼠按随机表法分为治疗组和对照组,每组5只,分笼饲养;治疗组给予尼美舒利1.5 mg/kg[8]溶于2%DMSO-PBS(pH=7.2)0.1 mL中,腹腔注射(IP),每日一次(qd),共3周;对照组给予2%DMSO-PBS(pH=7.2)0.1 mL,IP,qd×3周。开始实验干预后,每3 d游标卡尺测量移植瘤的最长径和最短径,计算近似体积,绘制移植瘤生长曲线;观察小鼠一般情况及有无腹泻、呕吐、咯血等情况;3周试验期满后,脱颈法处死小鼠,剥出肿瘤,游标卡尺测量肿瘤长、宽、高度,计算肿瘤体积及抑瘤率;各取100 mg肿瘤组织于-70 ℃低温冰箱冻存。
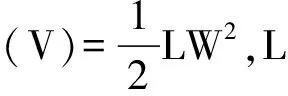
2 结果
2.1 各组小鼠移植瘤肿瘤大小比较、生长状况及抑瘤率
SKOV-3组:治疗组实验结束后的肿瘤体积为(1.026 4±0.34)cm3;对照组实验结束后的肿瘤体积为(1.668 2±0.94)cm3。两者比较无统计学意义(P=0.19)。生长曲线如图1。可见两组的肿瘤生长曲线没有显著分离。OVCAR-3组:治疗组和对照组移植瘤体积的比较:治疗组实验结束后的肿瘤体积为(0.139 6±0.061)cm3;对照组实验结束后的肿瘤体积为(0.263 4±0.056)cm3;两者比较有统计学差异(P=0.01)。生长曲线如图2。尼美舒利干预后肿瘤生长被抑制,抑制率为56.3%,如表1。
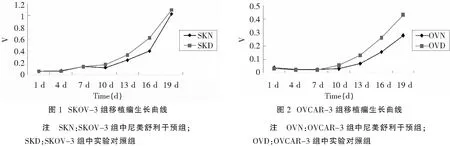
表1 尼美舒利干预后OVCAR-3组肿瘤抑制率
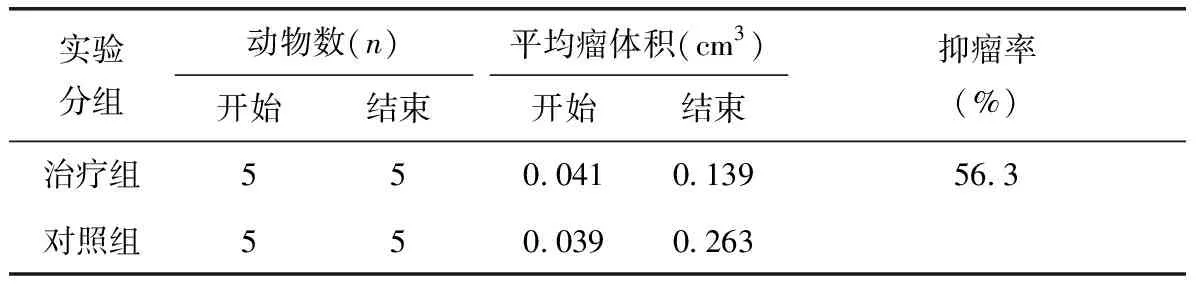
实验分组动物数(n)开始结束平均瘤体积(cm3)开始结束抑瘤率(%)治疗组550.0410.13956.3对照组550.0390.263
2.2 各组肿瘤组织内VEGF含量的比较
SKOV-3组:治疗组肿瘤的VEGF含量为(1 481.1±235.61)pg/mL;对照组肿瘤的VEGF含量为(1 648±179.02)pg/mL;两者比较无统计学意义(P=0.09>0.05)。OVCAR-3组:治疗组肿瘤的VEGF含量为(1 070.4±578.29)pg/mL;对照组肿瘤的VEGF含量为(1 641.3±541.84)pg/mL;两者比较有统计学差异(P=0.04),如表2。
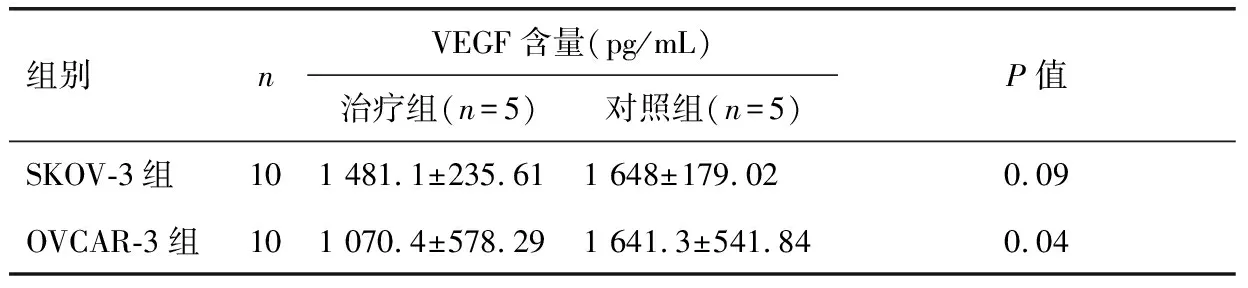
表2 尼美舒利干预后各组肿瘤组织内VEGF含量的比较
3 讨论
在妇科肿瘤领域,卵巢癌的死亡率最高,预后最差,在多种治疗方法的作用下,五年生存率仅为30%。寻找新的治疗方法达到防治的目的是迫切需要解决的问题。虽然大部分循证学和临床试验研究支持应用COX抑制剂防治多种癌症和心脑血管疾患,但在与卵巢癌发病风险的研究中结论尚不统一[1,4,7]。在Guido E.Eibl医生的研究小组发现COX-2抑制剂尼美舒利能够刺激不表达COX-2的人胰腺癌细胞系的肿瘤生长,而不是抑制,并且还可刺激其血管生长,对COX-2表达阳性的人胰腺癌细胞系则可发挥抑制作用[8]。类似的机制是否也发生在卵巢癌中,尚无相关报道,本实验首次初步探讨了COX-2表达谱不同的情况下,选择性COX-2抑制剂的不同抗肿瘤潜能。
应用肿瘤体积为观察指标,根据每个测量时间点的肿瘤平均体积绘制各组肿瘤的生长曲线(图1、图2),可发现尼美舒利在干预OVCAR-3组时,该组内治疗组和对照组肿瘤的生长曲线逐渐相互分离,实验结束后两组肿瘤大小有统计学意义(P=0.01),并可计算出抑瘤率为56.3%。提示尼美舒利的干预在COX-2表达阳性的OVCAR-3组内对肿瘤的大小、生长有抑制作用。SKOV-3组中,治疗组和对照组的肿瘤生长曲线没有显著分离,实验结束后两组肿瘤大小没有统计学差异,提示尼美舒利的干预在COX-2表达阴性的SKOV-3组内对肿瘤的大小、生长无显著抑制作用。
关于COX-2的具体致癌机制尚不完全明确,其中大部分机制是基于COX-2产生的PGE2有致癌作用[9-10],如PGE2能刺激肿瘤组织内各种间质细胞产生血管内皮生长因子(vascular endothelial growth factor,VEGF)[11]。COX-2抑制剂的抗肿瘤机制则主要通过抑制COX-2酶活性而实现。本实验进一步研究了肿瘤组织内的VEGF水平。结果显示在OVCAR-3组内,治疗组肿瘤组织的含量显著低于对照组(P=0.04)。提示尼美舒利可能通过抑制COX-2表达阳性的人卵巢癌OVCAR-3移植瘤组织产生VEGF,参与抑制肿瘤的生长、发展,进一步支持实验中对OVCAR-3组肿瘤生长的观察结果。在SKOV-3组内,治疗组和对照组肿瘤组织的VEGF含量没有统计学差异,与SKOV-3组肿瘤生长的观察结果一致,因此尚没有证据支持尼美舒利能抑制COX-2表达阴性的人卵巢癌SKOV-3移植瘤组织产生VEGF,进而影响肿瘤的生长。选择性COX-2抑制剂尼美舒利在COX-2表达谱不同的卵巢肿瘤组织中表现出的抗肿瘤潜能是不同的。
本实验采用安全范围内高剂量尼美舒利进行干预,根据Eibl等研究提示[8]高剂量的尼美舒利能增加COX-2表达+/-胰腺癌细胞产生的VEGF产量。在阴性细胞株中,这种作用与肿瘤增长及促血管形成相关。在阳性细胞株里,其作用与其对肿瘤内非恶性细胞产生的VEGF的减少作用相抵消,表现为抑制肿瘤生长和血管形成。本实验尚未发现选择性COX-2抑制剂对COX-2表达阴性的卵巢癌组织有促进生长的作用,但实验结果已提示选择性COX-2抑制剂对COX-2表达阴性的卵巢癌组织没有显著抑制作用,这为应用COX-2抑制剂在卵巢癌的研究中结论的多样性提供了一定理论基础,其机理有待进一步研究。
综上所述,在对肿瘤防治的研究中,选择性COX-2抑制剂有传统肿瘤治疗药物不可比拟的优点:(1)COX-2抑制剂可口服、可长期坚持、副反应小;(2)对多种肿瘤有一定的预防作用,这对一些有明显肿瘤高发倾向的人群无疑有很好的保护作用;(3)可与手术、放化疗等传统肿瘤治疗手段联合应用,提高肿瘤对放化疗的敏感性,延长肿瘤患者的生存期[12];(4)COX-2在肿瘤及相关疾患中的新角色、新作用正在不断发现,颇具研发前景[10]。但肿瘤的发生发展是一个多基因、多因素、多步骤的复杂过程,也就意味着肿瘤本身存在多样性,不同肿瘤和不同的个体对药物的反应都有其特异性。包括本研究在内的相关研究均存在异质性结论[13],提示COX-2抑制剂是否适用于各种肿瘤,包括同一种肿瘤的不同亚型,还有待商榷。在选用COX-2抑制剂防治卵巢癌时,有可能需要筛查肿瘤细胞表达COX-2的情况。
【参考文献】
[1]Trabert B,Ness RB,Lo-Ciganic WH,et al.Aspirin,nonaspirin nonsteroidal anti-inflammatory drug,and acetaminophen use and risk of invasive epithelial ovarian cancer:a pooled analysis in the Ovarian Cancer Association Consortium[J].J Natl Cancer Inst,2014,106(2):djt431.
[2]Lin Y,Cui MH,Xu TM,et al.Silencing of cyclooxygenase-2 inhibits the growth,invasion and migration of ovarian cancer cells[J].Molecular Medicine Reports,2014,9(6):2499-2504.
[3]Sahin IH,Hassan MM,Garrett CR.Impact of non-steroidal anti-inflammatory drugs on gastrointestinal cancers:Current state-of-the science[J].Cancer Letters,2014,345(2):249-257.
[4]Ni X,Ma J,Zhao Y,et al.Meta-analysis on the association between non-steroidal anti-inflammatory drug use and ovarian cancer[J].Br J Clin Pharmacol,2013,75(1):26-35.
[5]Setiawan VW,Matsuno RK,Lurie G,et al.Use of nonsteroidal anti-inflammatory drugs and risk of ovarian and endometrial cancer:the Multiethnic Cohort[J].Cancer Epidemiol Biomarkers Prev,2012,21(9):1441-1449.
[6]Zhang DQ,Guo Q,Zhu JH,et al.Increase of cyclooxygenase-2 inhibition with celecoxib combined with 5-FU enhances tumor cell apoptosis and antitumor efficacy in a subcutaneous implantation tumor model of human colon cancer[J].World J Surg Oncol,2013,11:16.
[7]Neill AS,Nagle CM,Protani MM,et al.Aspirin,nonsteroidal anti-inflammatory drugs,paracetamol and risk of endometrial cancer:a case-control study,systematic review and meta-analysis[J].Int J Cancer,2013,132(5):1146-1155.
[8]Eibl G,Takata Y,Boros LG,et al.Growth stimulation of COX-2-negative pancreatic cancer by a selective COX-2 inhibitor[J].Cancer Research,2005,65(3):982-990.
[9]Pomianowska E,Sandnes D,Grzyb K,et al.Inhibitory effects of prostaglandin E2 on collagen synthesis and cell proliferation in human stellate cells from pancreatic head adenocarcinoma[J].BMC Cancer,2014,14(1):413.
[10]Boyce JA,Peebles RS.Regulation of Th9-type pulmonary immune responses[J].American Journal of Respiratory and Critical Care Medicine,2013,187(8):785-786.
[11]Omori K,Kida T,Hori M,et al.Multiple roles of prostaglandin E2-EP signal in vascular permeability[J].British Journal of Pharmacology,2014.doi:10.1111/bph.12815.
[12]Li W,Xu XL,Zhang J,et al.Effects of cyclooxygenase inhibitors on survival time in ovarian cancer xenograft-bearing mice[J].Oncol Lett,2012,4(6):1269-1273.
[13]Baandrup L,Faber MT,Christensen J,et al.Nonsteroidal anti-inflammatory drugs and risk of ovarian cancer:systematic review and meta-analysis of observational studies[J].Acta Obstet Gynecol Scand,2013,92(3):245-255.

