EvaGreen实时荧光定量PCR检测猪圆环病毒2型方法的建立
蔡晔 饶品彬 吴海港 姜永厚
(浙江理工大学生命科学学院,杭州 310018)
EvaGreen实时荧光定量PCR检测猪圆环病毒2型方法的建立
蔡晔 饶品彬 吴海港 姜永厚
(浙江理工大学生命科学学院,杭州 310018)
根据GenBank中的猪圆环病毒2型(PCV2)ORF4基因序列设计一对特异性引物,通过常规PCR扩增PCV2的ORF4基因,并将其纯化的PCR产物克隆入pMD18-T载体中,构建重组质粒。应用该重组质粒进行EvaGreen实时荧光定量PCR,建立了PCV2 DNA的标准曲线,并进行熔解曲线分析。结果显示:建立的EvaGreen实时荧光定量PCR特异性强,与其他非靶标病毒基因不发生交叉反应;灵敏度高,最高可检测到10拷贝/μL的病毒量;重复性好,3个浓度的批间和批内的变异系数均小于2.5%;对118份临床样品进行检测,阳性样品25份,阳性率为21.2%,检测结果与普通PCR相符率为99.2%,其中一份样品经荧光PCR检测为PCV2阳性,普通PCR检测为阴性。结果表明,建立的EvaGreen实时荧光定量PCR方法具有特异性强、敏感度高、重复性好、简便快捷等特点,可用于临床PCV2感染的早期诊断以及分子流行病学调查。
猪圆环病毒2型 EvaGreen 实时荧光定量PCR 检测
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是近年来发现的一种重要的猪病病原,与在各地广泛流行的断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)、猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)、猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、仔猪先天性震颤(Congenital tremor,CT)及猪繁殖系统障碍等多种疾病密切相关[1,2],其中以PMWS危害最大,给世界各地养猪业造成了重大经济损失。PCV2具有自身特
有的生物学特性,单一感染PCV2后一般不会引起明显的发病,但由于其具有持续性感染和免疫抑制作用,能诱发病猪产生免疫抑制后继发感染和混合感染其他病原,且其致病性与病毒载量相关,导致其潜在危害很大[3-5]。因此建立一种快速准确的诊断方法对PCV2进行早期快速检测,对促进养猪业的健康发展具有重要意义。
实时荧光定量PCR(Real-time fluorescent quantitative PCR,Real-time PCR)是在普通PCR技术基础上加入荧光基团发展起来的一种快速灵敏的核酸检测技术,弥补了常规的病毒分离鉴定、血清学等方法对感染早期无法确诊及普通PCR技术不能精确定量和假阳性率高等缺点[6,7],可应用于病毒疾病的早期诊断。实时荧光定量PCR一般包括荧光杂交探针和荧光染料两类,与荧光探针实时定量PCR方法比较,染料法实时定量PCR避免了设计、标记荧光探针,检测费用相对降低,同时适用于任何PCR扩增体系[8]。EvaGreen是一种新型的用于实时荧光定量PCR的DNA结合荧光染料,对PCR的抑制性远小于在实时荧光定量PCR中使用较多的SYBR Green染料[9]。因此,EvaGreen在Real-time PCR中可使用较高工作浓度,从而获得比SYBR Green更好的扩增信号,其稳定性也强于SYBR Green[10,11]。基于此本研究拟建立一种EvaGreen实时荧光定量PCR方法用于PCV2的检测,应用于PCV2的早期诊断中,同时也为进一步开展疫苗研究、诊断试剂研发等奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒株与临床样品 PCV2参考株由本实验室保存,阴性对照包括猪伪狂犬病病毒(Pseudorabies virus,PRV)和猪乙型脑炎病毒(Japanese encephalitis virus,JEV)疫苗干粉购自武汉科前动物生物制品有限公司;猪细小病毒(Porcine parvovirus,PPV)疫苗干粉购自北京中海保健科技有限公司;猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪流感病毒(Swine influenza virus,SIV)、猪圆环病毒1型(Porcine circovirus type 1,PCV1)及其他相关菌株均由本实验室保存。118份临床样品(58份血清样品和60份组织样品),其中血清样品收集自湖北、福建、安徽、广东、河南、浙江及天津等地猪场;组织样品包括猪肺、淋巴结、肝及肾等收集自杭州市下沙附近的5个猪肉市场。
1.1.2 主要试剂与仪器TaqDNA聚合酶、dNTPs、蛋白酶K等购自上海生工生物工程有限公司;pMD18-T vector、Agarose、DNA Marker DL2000、MiniBEST Viral RNA/DNA Extraction Kit Ver.3.0等购自TaKaRa公司;EB固体购自Boehringer Mannheim公司;EvaGreen购自Biotum公司。DNA Gel Extraction Kit及Plasmid Mini Kit购自Axygen公司。PCR扩增仪Bio-Rad S1000;凝胶成像分析系统Tanon 1600;紫外分光光度计Nanodrop 2000;离心机 Fresco 21;荧光定量PCR仪ABI 7300。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中已发表的PCV2(GQ996404)ORF4基因核苷酸序列用Primer Premier 5.0软件设计一对引物1,其相应PCR产物(371 bp)用于构建重组质粒,并在此扩增产物序列范围内(299-669 bp)再设计一对用于EvaGreen实时荧光定量PCR的引物2,其对应扩增产物长度为71 bp。引物由上海生工生物工程有限公司合成。
引物1上游(F1):5'-CGAGAAAGCGAAAGGAACMGA-3',下游(R1):5'-GGTAACCATCCCACCACTT-3';引物2上游(F2):5'-CGAGAAAGCGAAAGGAA-3',下游(R2):5'-ACTCGATCAGTAAGTTGCC-3'。
1.2.2 PCV2重组质粒标准品制备
1.2.2.1 PCV2核酸提取及普通PCR扩增 参照病毒RNA/DNA小量制备试剂盒说明书,从感染PCV2的细胞株中提取PCV2的病毒DNA。以提取的总DNA为模板进行PCR反应,依次加入10×Buffer 2.5 μL,25 mmol/L MgCl22 μL,0.5 μL的上下游引物1,2.5 mmol/L dNTPs 0.5 μL,TaqDNA(5 U/μL)0.3 μL,1 μL的模板DNA(约100 ng),加入ddH2O至总体积为25 μL。反应程序:95℃ 3 min;94℃ 30 s,56℃30 s,72℃ 30 s,30个循环;72℃ 10 min。反应结束后,使用DL2000 Marker对目的片段进行1%的琼脂糖凝
胶电泳检测。
1.2.2.2 标准品模板构建 用引物1进行常规PCR反应扩增PCV2完成后,PCR产物回收纯化后克隆到pMD18-T载体中,构建重组质粒,将重组质粒转化入DH 5α感受态细胞内,通过Amp+培养基筛选,提取重组质粒DNA进行PCR鉴定,并将电泳检测正确的重组质粒委托上海生工生物工程公司进行序列测定,将经测序验证后,序列正确的重组质粒用紫外分光光度计Nanodrop 2000测定OD260,根据阿弗加德罗常数将浓度转换为拷贝数,再按10倍梯度进行系列稀释,制备成1.0×100-1.0×107拷贝/μL的PCV2重组质粒标准品。
1.2.3 PCV2 EvaGreen实时荧光定量PCR方法建立
反应总体积为10 μL,反应体系组成为:25 mmol/L Mg2+1.2 μL,10×Buffer 1 μL,2.5 mmol/L dNTPs 0.8 μL,20×EvaGreen 0.5 μL,0.5 UTaq酶,上下游引物2各0.2 μL,质粒模板1 μL,补充ddH2O至10 μL。反应扩增程序为:95℃ 3 min;95℃ 15 s,60℃ 1 min,40个循环;扩增完成后,制作熔解曲线。熔解曲线程序为:95℃ 15 s,60℃1 min,95℃ 15 s,60℃开始收集荧光信号制作熔解曲线。
1.2.4 PCV2 EvaGreen实时荧光定量PCR方法评价1.24.1 特异性 按照EvaGreen实时荧光定量PCR反应体系配制9份,l份加入PCV2的DNA 1 μL(约100 ng),其余8份作为对照组,模板分别加入其他7种猪病毒包括PRV、JEV、PPV、CSFV、PRRSV、SIV和PCV1的DNA/cDNA 1 μL(约100 ng),还有1份加入ddH2O 1 μL为阴性对照,按实时荧光定量PCR反应程序扩增,验证其特异性。
1.2.4.2 灵敏度 将PCV2标准品质粒进行10倍梯度系列浓度稀释,进行EvaGreen实时荧光定量PCR反应。通过能够检测出阳性结果的最高稀释度的拷贝数,确定PCV2在EvaGreen实时荧光定量PCR中灵敏度。
1.2.4.3 重复性 选取PCV2的3个浓度梯度(104、103、102拷贝/μL)的质粒标准品分别进行批内、批间重复试验。批内重复试验是将每个浓度在同一次EvaGreen实时荧光定量PCR中重复3次;批间重复试验是在3次不同时间段进行试验对3个梯度进行EvaGreen实时荧光定量PCR反应。
1.2.5 临床样品检测 对118份临床样品分别进行EvaGreen实时荧光定量PCR和常规PCR检测,比较其检测结果。
2 结果
2.1 PCV2 ORF4基因的PCR扩增、克隆及鉴定
取PCR产物5 μL于1%琼脂糖上电泳,结果表明扩增产物为371 bp左右的DNA片段(图1)与预期的片段长度相一致。经鉴定,该片段与连接前的PCR产物片段长度一致。测序结果显示,所获序列与GenBank上PCV2的ORF4基因序列完全一致,表明重组质粒中含有该基因核苷酸序列。

图1 PCV2 ORF4基因的PCR扩增
2.2 PCV2 EvaGreen实时荧光定量PCR检测标准曲线的建立
通过多次重复试验,按优化的反应条件,以PCV2重组质粒稀释成系列浓度标准品(106、105、104、103、102和50拷贝/μL)进行实时荧光定量PCR反应,得到PCV2荧光定量PCR扩增动力学曲线(图2)。
根据PCV2荧光定量PCR扩增动力学曲线,以lg浓度值(lgCo)为横坐标,相应Ct值为纵坐标,在ABI7300上生成相应标准曲线(图3),其中斜率为-3.37,截距为37.66,扩增效率为0.980(相关系数为大于0.99),从而可以得出拷贝数与Ct值之间的线性关系曲线表达式 Ct= -3.37×lgCo+37.66,而待测样品的Ct值可以从仪器读取,把待测样品的Ct值代入表达式就可以算出其初始拷贝数。
2.3 实时荧光定量PCR检测方法的特异性
将PCV2、PPV、PRRSV、JEV、CSFV、PCV1、SIV和PRV及阴性对照(ddH2O)在优化好的实时
荧光定量PCR条件下进行荧光定量PCR检测,结果(图4)发现除PCV2能够显示正常扩增曲线外,其他病毒和阴性对照(NTC)均不能检测到正常扩增曲线(荧光信号未达到阈值),表明所建立的方法具有较强的特异性。
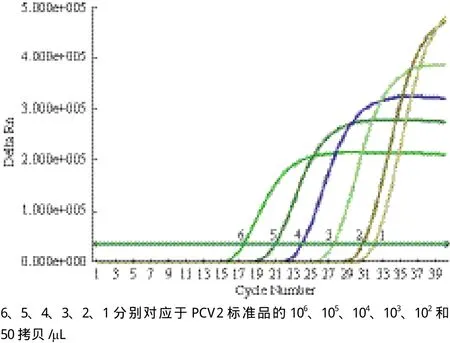
图2 PCV2 EvaGreen实时荧光定量PCR扩增曲线

图3 PCV2 EvaGreen实时荧光定量PCR标准曲线
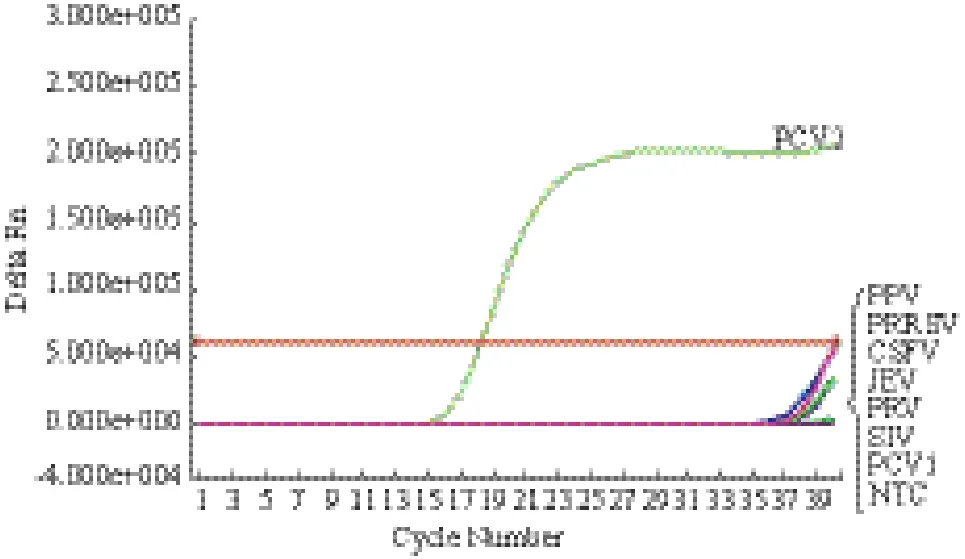
图4 PCV2 EvaGreen实时荧光定量PCR特异性
2.4 实时荧光定量PCR检测方法的灵敏度
将PCV2重组质粒标准品10倍梯度稀释进行实时荧光定量PCR,经实时扩增完成后,通过熔解曲线分析,所能产生熔解峰的最低拷贝数即为PCV2的检测极限,其在106、105、104、103、102、50、25及10 拷贝/μL时均有明显熔解峰,在100拷贝/μL时没有熔解峰,即EvaGreen实时荧光定量PCR检测PCV2的灵敏度可达10拷贝/μL(图5)。
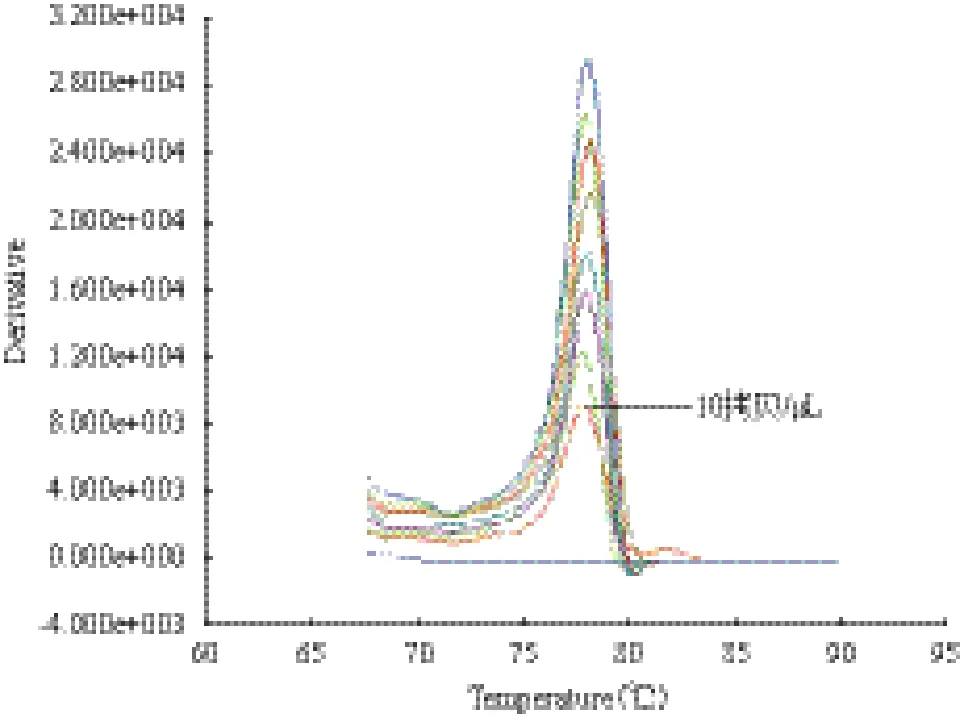
图5 PCV2 EvaGreen实时荧光定量PCR灵敏度
2.5 实时荧光定量PCR检测方法的重复性
为了验证实时荧光定量PCR检测结果的重复性,选取104、103及102拷贝/μL 3个浓度进行批内和批间重复性试验。在批内重复中变异系数(Coefficient of variation,CV)分别为0.81%、1.90%和1.49%,批间重复中CV分别为1.19%、2.32%和2.46%,两种重复试验的变异系数均小于2.5%(表 1),表明实时荧光定量PCR检测方法具有较高的重复性,从而保证了不同样品间检测结果的可靠性和稳定性。
2.6 临床样品检测
对118份样品进行处理,利用病毒RNA/DNA抽提试剂盒从样品中提取DNA。应用本研究所建立的EvaGreen实时荧光定量PCR方法和常规PCR方法同时对样品进行PCV2检测,其中用实时荧光定量PCR方法共检测出25份PCV2阳性样品(11份阳性血清样品和14份阳性组织样品),阳性率为21.2%,而经普通PCR方法只检测出24份PCV2阳
性样品(11份阳性血清样品和13份阳性组织样品),阳性率为20.3%,实时荧光定量PCR检测灵敏度明显高于普通PCR,能检测出普通PCR不能检测出的感染病毒样品。

表1 PCV2的EvaGreen实时荧光定量PCR重复性
3 讨论
近年来,PCV2及其相关疾病在猪群中广泛流行,给养猪业造成了巨大经济损失。由于PCV2感染主要通过引起机体免疫抑制,进而导致继发性感染和条件性感染而引起发病[12,13]。因此,进行病毒抗原或核酸的早期检测尤为重要。实时荧光定量PCR技术因其快速、特异、敏感等优点而在病毒早期检测中越来越被广泛应用[14,15]。
本研究通过构建PCV2阳性重组质粒,用EvaGreen染料法进行Real-time PCR,得到Real-time PCR标准曲线,并计算出其直线回归方程,通过线性回归方程可以对PCV2阳性样品进行准确定量。从灵敏度试验结果可见,最高可检测稀释到10拷贝/μL的病毒模板,通过对熔解曲线分析,产物的熔解峰(Tm value)值相同,并未出现明显的非特异性熔解峰。在特异性试验中除PCV2有扩增曲线外,其他非靶标病毒基因和阴性对照均未出现扩增曲线(荧光信号未达到阈值),说明本方法特异性强,而且批内和批间重复试验的变异系数均小于2.5%,也同时证明了本方法具有高度可重复性,从而保证检测结果的可靠性和稳定性。
在对118份临床样品的检测中,本研究结果显示25份PCV2阳性,而普通PCR检测只有24份阳性。通过分析阳性样品在扩增曲线上的对应的Ct值在标准曲线上的位置,计算出所检测阳性样品病毒量大都集中在106-105拷贝/μL。实时荧光定量PCR检测呈阳性而普通PCR检测呈阴性的样品,其拷贝数通过计算约为103拷贝/μL,比较103拷贝/μL的PCV2阳性重组质粒标准品经普通PCR检测后也为阴性,两者检测结果一致,再次验证本研究中的方法,检测敏感性明显高于普通PCR,表明该方法能够用于PCV2的早期诊断中。应用该荧光PCR方法的检测结果显示,在血清样品中PCV2检出率为19.0%,与梁鹏帅等[16]利用套式PCR检测多个猪场收集的807份血清样品,不同猪场间PCV2阳性率为15.83%-43.33%检测情况相符;在组织样品检测中PCV2检出率为23.3%,与刁有祥等[17]应用PCR方法对125份临床健康猪肺脏进行PCV2的检测,其阳性率为16.8%,两者比较一致,证实了本研究方法对样品的检测结果,符合PCV2的流行情况。由于其中的组织样品取自猪肉市场,本研究方法检测结果也表明PCV2存在很严重的亚临床感染,是养猪业健康发展的一大潜在危险,应当引起足够的重视。
本研究方法与普通PCR相比,扩增和检测都在同一管内完成,不需PCR产物后处理,有效解决了污染问题,还能利用96孔板同时检测96个样品,能直接分析检测结果,既方便又省时;与一般使用的SYBR Green Ⅰ实时荧光定量PCR相比,具有更好的特异性、稳定性,能显示更高的荧光信号强度。本方法检测敏感性比SYBR Green Ⅰ实时荧光定量PCR检测高10倍左右[18,19];与探针法相比,更加简便,只需在EvaGreen反应混合液中加入引物和待测样品即可,成本相对低廉,且无须合成价格昂贵的探针,同时检测敏感性能达到探针检测水平[20]。
4 结论
本研究建立的检测猪圆环病毒2型EvaGreen实时荧光定量PCR方法是一种快速、准确、简便的检测方法,同时为PCV2的定性或定量检测、致病机理及其防控措施研究奠定了良好技术基础。
[1] Opriessnig T, Langohr I. Current state of knowledge on porcine circovirus type 2-associated lesions[J]. Veterinary Pathology Online, 2013, 50(1):23-38.
[2] Huang Y, Shao M, Xu X, et al. Evidence for different patterns of natural inter-genotype recombination between two PCV2 parental strains in the field[J]. Virus Research, 2013, 175(1):78-86.
[3] Meng X. Porcine circovirus type 2(PCV2):pathogenesis and interaction with the immune system[J]. Animal Biosciences, 2013, 1(1):43-64.
[4] Ge X, Wang F, Guo X, et al. Porcine circovirus type 2 and its associated diseases in China[J]. Virus Research, 2012, 164(1):100-106.
[5] Opriessnig T, Halbur PG. Concurrent infections are important for expression of porcine circovirus associated disease[J]. Virus research, 2012, 164(1):20-32.
[6] 杨光国, 甘振磊, 汤德元, 等. 猪圆环病毒病珍断技术的研究进展[J]. 猪业科学, 2011, 28(5):92-96.
[7] Espy M, Uhl J, Sloan L, et al. Real-time PCR in clinical microbiology:applications for routine laboratory testing[J]. Clinical Microbiology Reviews, 2006, 19(1):165-256.
[8] Kubista M, Andrade JM, Bengtsson M, et al. The real-time polymerase chain reaction[J]. Molecular Aspects of Medicine, 2006, 27(2):95-125.
[9] Eischeid AC. SYTO dyes and EvaGreen outperform SYBR Green in real-time PCR[J]. BMC Research Notes, 2011, 4(1):263-267.
[10] Mao F, Leung W, Xin X. Characterization of EvaGreen and the implication of its physicochemical properties for qPCR applications[J]. BMC Biotechnology, 2007, 7(1):1-16.
[11] Santos CG, Melo VS, Amaral JS, et al. Identification of hare meat by a species-specific marker of mitochondrial origin[J]. Meat Science, 2012, 90(3):836-841.
[12] Ko K, Jung J, Kang S, et al. Prevalence of porcine parvovirus in pigs with postweaning multisystemic wasting syndrome in Jeju Island[J]. Korean Journal of Veterinary Research, 2011, 51(3):203-208.
[13] Chae C. A review of porcine circovirus 2-associated syndromes and diseases[J]. The Veterinary Journal, 2005, 169(3):326-336.
[14] Wilhelm J, Pingoud A. Real-time polymerase chain reaction[J]. Chembiochem, 2003, 4(11):1120-1128.
[15] Bustin S, Benes V, Nolan T, et al. Quantitative real-time RT-PCR-a perspective[J]. Journal of Molecular Endocrinology, 2005, 34(3):597-601.
[16] 梁鹏帅, 蔡汝健, 刘燕玲, 等. 华南地区猪圆环病毒和猪繁殖与呼吸综合征病毒检测分析[J]. 动物医学进展, 2012, 33(4):15-21.
[17] 刁有祥, 丁家波, 姜世金, 等. 猪传染性胸膜肺炎病料中PCV-2和PRRSV的PCR检测[J]. 微生物学报, 2005, 45(3):397-400.
[18] Yang Z, Habib M, Shuai J, et al. Detection of PCV2 DNA by SYBR green I-based quantitative PCR[J]. Journal of Zhejiang University Science B, 2007, 8(3):162-169.
[19] McIntosh KA, Tumber A, Harding J, et al. Development and validation of a SYBR green real-time PCR for the quantification of porcine circovirus type 2 in serum, buffy coat, feces, and multiple tissues[J]. Veterinary Microbiology, 2009, 133(1):23-33.
[20] 陈蓉, 王艳, 魏建忠, 等. 猪圆环病毒2型TaqMan荧光定量PCR检测方法的建立[J]. 中国生物制品学杂志, 2012, 25(4):487-491.
(责任编辑 李楠)
Development of EvaGreen Real-time Fluorescence Quantitative Polymerase Chain Reaction to Detect Porcine Circovirus Type 2
Cai Ye Rao Pinbin Wu Haigang Jiang Yonghou
(College of Life Science,Zhejiang Sci-Tech University,Hangzhou 310018)
According to genome sequences of ORF4 of porcine circovirus type 2(PCV2)published in GenBank, a pair of primers was designed. The ORF4 gene was amplified with traditional PCR. The PCR product was cloned into pMD18-T vector and sequenced to construct positive recombinant plasmid. The recombinant plasmid was used as template for EvaGreen real-time PCR to generate standard curve and melt curve. The results showed that EvaGreen real-time PCR in the present study was highly specific while used to detect other nontarget viruses, and its sensitivity was proved to be 10 copies/μL and reproducibility for both intra-assay and inter-assay were less than 2.5%. Then the established method was utilized to test 118 clinical samples. The result indicated that the PCV2 positive rate was 25/118, which was 99.2% consistent with that of conventional PCR tests, except one sample that was positive for PCV2 by real-time PCR but negative by conventional PCR. Thus, this method in the current study showed the characteristics of specificity, sensitivity, reproducibility and simple operation, which could be used in subclinical diagnosis and epidemiological investigation of PCV2.
Porcine circovirus type 2 EvaGreen Real-time PCR Detection
2014-01-18
浙江省科技攻关项目(2008C22081)
蔡晔,女,研究方向:动物病毒学;E-mail:meviky_cy@sina.cn;饶品彬同为本文第一作者
姜永厚,男,博士,副教授,研究方向:病毒分子诊断与动物病毒分子生物学;E-mail:yonghoujiang@163.com

