植物激素脱落酸受体及其信号转导途径研究进展
曹婧 兰海燕
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
植物激素脱落酸受体及其信号转导途径研究进展
曹婧 兰海燕
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
脱落酸是广泛存在于植物体的多功能激素,通过与体内受体及随后的复杂信号网络互作进而调节植物生长发育、抵御环境胁迫。脱落酸受体的筛选和鉴定一直备受关注,并已取得较大突破,其信号转导机制也再次成为人们研究的热点。对脱落酸受体的鉴定以及介导的信号转导途径方面最新进展进行了综述并展望,以期对相关研究领域提供参考。
脱落酸 受体 PYR/PYL/RCAR 信号转导
脱落酸(Abscisic acid,ABA)是20世纪60年代发现的一种倍半萜类化合物,作为植物最重要的激素之一,参与调控植物生长发育(如胚胎发育、种子休眠与萌发、幼苗生长、根系发育、果实成熟和衰老等)以及对干旱、高盐、低温及病菌等胁迫产生应答。但其发挥生理作用的分子机制及信号通路的具体组分研究一直存在很大争议。近年来,利用拟南芥和其他植物的突变体陆续发现并鉴定了一些ABA受体,研究从最初开花时间调控蛋白A的发现到Mg离子螯合酶H亚基、G蛋白偶联受体的鉴定,以及最近ABA受体家族(PYR/PYL/RCARs)的成功鉴定,由此对植物ABA信号转导通路分子机制的研究起到显著推动作用,对农业生产具有重要实践意义。因此,本文就目前对ABA受体鉴定及信号途径机制的进展进行综述,期望为相关研究提供参考。
1 开花时间控制蛋白FCA
对ABA受体研究的首次突破是FCA(Flowering control locus A)蛋白的发现,它是参与拟南芥开花时间和根发育调控的RNA结合蛋白,通过与成花过渡过程中主要抑制因子FLC的mRNA结合发挥作用,这项研究结果曾引起植物学界强烈轰动[1]。但进一步试验发现该结果不能被重复[2],FCA并不能特异结合ABA。
2 Mg离子螯合酶H亚基(ABAR/CHLH)
国内张大鹏教授课题组于2002年通过亲和层析的方法首次从蚕豆(Vicia faba)叶片中分离纯化了(+)-ABA特异性结合蛋白,暗示其具备ABA受体的特征,被命名为ABAR(Abscisic acid receptor)[3]。通过蛋白测序分析,发现该结合蛋白在拟南芥中的同源基因为Mg离子螯合酶H亚基(Mg-chelatase H subunit,CHLH)。CHLH定位于植物细胞质体/叶绿体上,能够与Mg离子螯合酶D 亚基和I亚基形成聚合体,催化细胞叶绿素前体物质的合成,并参与应激条件下质体/叶绿体与细胞核之间的信号反向传递[4,5]。
有关研究表明,拟南芥中的ABAR/CHLH同源蛋白也能特异性结合ABA,且符合受体与配体结合的动力学特征,超表达CHLH和RNAi改变了ABA结合位点的数量,但未改变其与ABA的亲和力。同时,根据转基因材料在种子萌发、幼苗生长和气孔运动等生理试验的表型,以及ABA信号应答基因的表达推断,ABAR/CHLH可作为受体蛋白正向调控ABA信号应答反应[6]。但随后的研究显示了相反结果,在大麦(Hordeum vulgare)中与拟南芥CHLH同源的XanF蛋白却未能表现出ABA受体功能,暗示大麦CHLH不是ABA受体,也许是单子叶植物CHLH蛋白与双子叶植物在ABA结合和信号传导方面存在差异,故对ABAR/CHLH是ABA受体的结论提出质疑[7]。随后,张大鹏课题组在过表达ABAR/CHLH的转基因株系中发现,结合ABA的C端区域可导致植物在种子萌发、幼苗生长及气孔运动的信号通路对ABA全面超敏,而不结合ABA的N端区域仅限于调节种子萌发或幼苗生长其中之一功能,而ABAR/CHLH的RNAi株系则出现对ABA不敏感表型,于是证明ABAR/CHLH分子的C端是介导ABA信号的核心区域,参与ABA信号的正向调节[8]。此外,有研究发现一个关键的生物钟调节器TOC1(Timing of CAB expression 1)具有绑定ABAR启动子的功能,独立地证明ABAR调节ABA介导的植物对干旱的适应性反应,并在植物昼夜节律和干旱反应的联系方面担任关键角色。该发现进一步支持了ABAR/CHLH在ABA信号转导发挥正调节作用的观点[9]。再联系单子叶植物大麦XanF和水稻CHLH都能结合ABA并发挥生物学功能的事实,推测之所以在大麦中会出现矛盾的试验结果,可能是XanF基因功能出现冗余亦或是试验操作不当造成的[6,8,10,11]。
此外,ABAR介导的下游信号通路一直是悬而未决的问题。研究发现,ABAR是跨越叶绿体被膜的蛋白质,其C端和N端曝露于细胞质中;ABAR在细胞质一侧的C端部分能结合ABA或与一组WRKY转录因子(WRKY40、WRKY18和WRKY60)互相作用[8,10]。在拟南芥中通过部分遗传学和生物化学证据表明,WRKY40/18/60是一组以WRKY40为核心的转录抑制因子,负调节ABA信号通路[10,12]。ABAR与ABA信号分子结合后,可以刺激WRKY40从细胞核转移至细胞质,促进ABAR与WRKY40的互相作用,由此激发一种未知因子(或信号系统),阻遏WRKY40的表达,以解除WRKY40对ABA响应基因(如ABI5、DREB2A等)转录的抑制,最终实现ABA的生理效应。这些发现描述了一条新的始于叶绿体从信号原初识别到下游基因表达的ABA信号通路(ABA-ABAR-AD1A-ABI5,图1)[10,11]。另一项对wrky40突变体的研究结果显示,该突变体对ABA信号并不敏感,且WRKY40对ABI5、DREB2A基因转录的抑制作用并未被解除,而wrky18和wrky60突变体是ABA反应的正向调控元件,这与上述结果相矛盾[13]。近来,由放射性ABA测定系统及相关突变体表型的试验结果显示,ABAR/CHLH影响了ABA介导的气孔保卫细胞的运动,但并不影响种子萌发和根系生长,推测Mg螯合酶不是作为ABA受体,可能以整体形式参与调控气孔运动[14]。同时,被H3标记的ABA不能与重组的ABAR/CHLH结合,而是与另一个公认的ABA受体PYR1结合,再次质疑了其作为ABA受体的结论[14]。因此,我们仍需应用恰当的试验手段来进一步证实:WRKY-40/18/60在ABA信号转导过程中的明确作用,以及ABAR/CHLH是以受体蛋白形式识别和传递ABA信号,还是以调节因子形式参与ABA信号的应答。要想阐明ABAR/CHLH是否为ABA受体,则需对其开展空间结构及功能结构域的研究,以便在分子水平深入揭示ABAR/CHIH结合及感知ABA的信号机制。
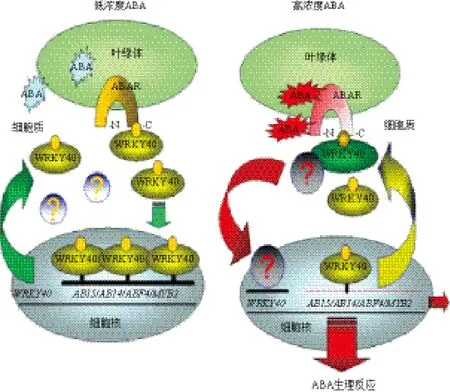
图1 ABAR-WRKY40偶联的信号转导模式图[10]
3 G蛋白偶联受体(GCR2)
定位在细胞质膜上的G蛋白偶联受体(G protcin-coupled receptors,GPCRs)是一类能与G蛋白相互作用形成复合物的蛋白,在真核生物中介导细胞内外信号的识别,并通过一系列信号转导过程最终引发胞内相关基因的表达和生理生化响应,参与生物体内许多重要的生理活动[15]。近来,在拟南芥基因组中发现GCR2(G-protein coupled receptor 2)蛋白的C端能与拟南芥G蛋白α亚基GPA1(G-protein α-subunit)相互作用形成复合体,与(+)-ABA特异性结合,诱使G蛋白释放,随后分离为Gα和Gβγ二聚体,并分别通过作用于其下游的效应因子调控ABA信号应答反应,如种子萌发、气孔关闭、ABA应答基因的表达等[16]。经预测发现该蛋白具有哺乳动物细胞典型G蛋白偶联受体的普遍结构特征,含有7个跨膜拓扑结构,但其在植物激素信号转导中的功能与已知GPCR存在差异[17]。进一步分析显示:GCR2定位于细胞膜;它的缺失导致所有ABA生理效应的丧失;而其过表达使植株对ABA敏感性增强;GCR2和ABA的结合具有高亲合力,且在遗传和生理上均可相互作用,由此认为GCR2具有ABA受体的功能[17,18]。
但试验发现GCR2与ABA并没有高亲合性[19],使以上研究很快受到质疑。有关研究还显示,gcr2突变体种子的萌发依然对ABA 敏感[17]。此外,不同GCR2 突变体组合及其同源蛋白(GCR2-Like 1 and GCR2-Like 2)在种子萌发过程中对ABA分别表现超敏或轻微不敏感的不同反应[20];鉴于并未预测到此蛋白的7个跨膜结构域,认为拟南芥中的GCR2既非跨膜蛋白,也非G蛋白偶联受体,而只是细菌羊毛硫氨酸合成酶(Bacterial lanthionine synthetases)在植物中的同源蛋白[21]。尽管后来针对该观点给予的回应表示GCR2可能是一种新型的G蛋白偶联受体[18]。试验证明,GCR2在拟南芥种子萌发及幼苗生长阶段并未参与调控ABA信号应答反应,推测该蛋白可能是真核生物LanC超级家族的新成员而并非G蛋白偶联受体[22],并利用傅立叶变换算法解释了GCR2被误认为G蛋白偶联受体的可能原因[23]。因此,GCR2的ABA受体功能仍需进一步确认。
4 新型的G蛋白偶联受体(GTG1和GTG2)
通常,G蛋白由Gα、Gβ和Gγ亚基组成协同G蛋白偶联受体及其下游效应因子在响应植物激素信号应答过程中发挥重要作用[24,25]。已发现拟南芥中G蛋白参与调节ABA信号[26,27],目前对G蛋白α亚基GPA1在ABA信号通路中的作用研究较为深入,被认为是ABA信号通路的第二信使[28]。最近,通过生物信息学分析发现2个与人类G蛋白偶联受体GPR89高度同源的新G蛋白,其拓扑学结构与GPCR类似,具有9个跨膜结构域,因此被称为GTGs(GPCR-type G proteins),分别命名为GTG1和GTG2[29]。与GPR89不同的是GTG1/2能特异性结合GTP且具有GTP酶活性。随后,利用遗传学和生物化学的技术手段证实了GTG1/2具有G蛋白所有基本特征,能与GPA1相互作用,与GTP结合后具有GTP酶活性,并能通过GPA1-GTP的互相作用来增强GTGs结合GTP能力。GTGs-GTP能特异性结合(+)-ABA,暗示其可能是定位于细胞质膜上的ABA受体蛋白[29]。该研究指出,GTGs-GDP与ABA的结合力要强于GTGs-GTP形式,因此推测前者可能是GTG1/2感知和传导 ABA信号的活性状态(图2)。
GTG1/2可作为ABA受体蛋白的结论同样遭到质疑。对gtg1/gtg2双突变体的研究发现,其虽在种子萌发、幼苗生长和气孔关闭中显示对ABA的低敏感性,但双突变体中的ABA信号响应并未消失,这
表明可能还存在其他的ABA信号感知位点[30]。有研究认为GTG1/2蛋白只是ABA信号通路中的一个调节因子,或可能是受ABA调控的阴离子通道[31]。据报道GTG1/2属于跨膜蛋白,但目前分离纯化功能性跨膜蛋白仍存在较大困难,有关试验表明实际能结合ABA的GTG1/2蛋白量很低(仅1%左右),故仍需进一步确认该蛋白对ABA的结合活性[32-34]。尽管目前尚不能确定该蛋白是否具有ABA受体功能,但对该蛋白的深入研究将极大地促进对G蛋白信号转导通路与ABA信号应答之间相关性的阐明。
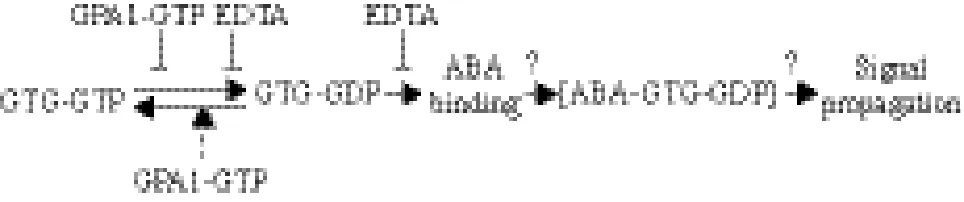
图2 GTGs和GPA1介导的ABA信号转导模式图[29]
5 ABA受体家族(PYR/PYL/RCARs)
由于上述几种ABA受体均受到不同程度的质疑,使得对ABA受体的研究越来越具有挑战性。到目前为止,利用传统遗传学方法均未能鉴定出ABA受体,这可能因为植物ABA受体存在功能上的冗余或植物缺少ABA受体导致致死效应[35]。
于是,有研究小组避开传统遗传学方法的缺陷,运用化学遗传学手段,人工合成了种子萌发抑制剂pyrabactin[36](至今仍未有文献报道其合成路线),作为ABA信号应答的选择性拮抗剂,可特异性激活拟南芥ABA受体蛋白PYR1,由此成功鉴定出一类胞质内受体[37]。据报道,pyrabactin和ABA在抑制种子萌发方面具有相同的属性,且两者能诱导种子中一系列高度相关的转录响应(r=0.98),而在幼苗中很少有对ABA应答的基因同时也对pyrabactin作出显著应答[36]。随后,通过筛选抗pyrabactin突变体,从拟南芥中分离到12个Pyrabactin resistance 1(Pyr1)突变等位基因,命名为PYR1。拟南芥中共有13个同源的PYR1基因(PYR1-likegenes),分别命名为Pyl1-Pyl13。虽然pyr1单突变体对种子萌发、幼苗生长、ABA诱导下游基因表达及SnRK2激酶活性等一系列ABA反应表现与野生型相似,但其三突变体(pyr1/pyl1/pyl4)和四突变体(pyr1/pyl1/pyl2/pyl4)对ABA并不敏感,在四突变体中,对ABA调控气孔闭合表现为低敏感性,下游基因RD29A受ABA的诱导表达也明显低于野生型[38]。在之后的酵母双杂交试验中,当pyrabactin存在时,以PYR1作为诱饵,分离得到植物A类2C型磷酸酶(PP2C)蛋白家族中的一个成员HAB1(Hypersensitive to ABA 1),在ABA信号转导过程中作为负调节因子发挥调控作用[39],由此进一步完善了以ABA-PYR1-PP2C复合体为中心的ABA信号转导通路(图3)。另外,该信号通路模式在体外试验中也得到验证[40]。
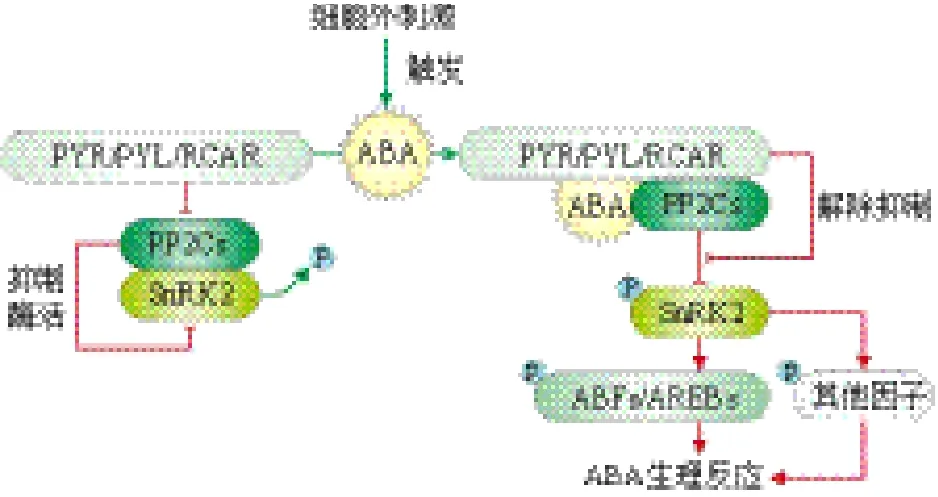
图3 PYR/PYL/RCAR介导的ABA信号转导模式图(参考相关文献绘制)
与此同时,另一个独立研究小组运用酵母双杂交技术,以负调控ABA信号应答反应的PP2C家族蛋白磷酸酶ABI2为诱饵,也筛选出ABA受体PYL9,命名为RCAR1[41]。研究表明,RCAR1的瞬时表达增强了ABA对应答基因的表达调控,其稳定过表达株系对ABA敏感,表现为抑制种子萌发和根伸长,并促进气孔关闭。由此提出了以ABARCAR1-ABI2为核心的ABA信号通路模式。
事实上,RCAR1与PYR1都是定位在细胞核和细胞质上的START/BetvI超蛋白家族成员,都能在体内外特异性结合(+)-ABA,只是命名方式不同。这两个独立科研小组有关PYR/PYL/RCAR即是ABA受体蛋白的报道,几乎同时发表在Science
杂志上,在学术界受到广泛关注。由于之前关于ABA受体的诸多争议,该报道的可靠性有待进一步验证。随后又有相关的研究用HAB1为诱饵筛选到PYL5/6/8,并重点介绍了PYL5作为受体蛋白在ABA信号转导中的分子机制[42];还有用携带YFP标签的ABI1为诱饵,利用亲和层析和质谱的方法鉴定出PYR/PYL/RCAR家族中的9个成员,其中包括已报道的ABA受体PYR1和RCAR1[43]。在随后开展的一系列结构生物学研究中,确认了PYL2-ABAPP2C复合物的晶体结构,分析了该复合物对ABA信号通路的启动和关闭的分子结构机制等[44]。此外,还揭示了PYL蛋白在结合/不结合ABA以及同时结合ABA和下游PP2C的3个状态下的高分辨率分子结构,通过结构比较和生化分析,确认了PYL蛋白的确是ABA受体,并且发现其中一个被命名为CL2的蛋白柔性区在介导ABA信号及抑制PP2C活性中起到至关重要的作用[45,46]。上述结果为阐明受体蛋白识别和传递ABA信号的过程提供了重要的理论依据。“PYR/PYL/RCAR受体蛋白的鉴定及结构解析”这一重要成果被评为2009年10大科学进展。
最终确认PYR/PYL/RCAR家族共有14个成员,除去PYL13,其他成员的序列和结构都具有高度保守性,均能发挥ABA受体功能[47]。并对已克隆的10个PYR/PYL/RCAR受体蛋白(PYL7、PYL11和PYL12除外)进行了系统的生化分析,发现有部分受体蛋白无论ABA存在与否都能与蛋白磷酸酶PP2Cs相互作用并抑制其活性。随后,应用生物化学和结构生物学手段分析了受体蛋白PYL10不依赖ABA抑制蛋白磷酸酶PP2Cs的分子机制,为深入探讨PYR/PYL/RCAR受体蛋白调控的ABA信号转导通路,以及该家族受体蛋白的分类提供了结构和功能依据[48]。总之,PYR/PYL/RCAR的筛选和鉴定无疑是ABA受体研究中的重大突破,有力地推动了植物ABA信号转导途径的研究。
6 小结
近年来,有关植物ABA代谢及转运[49,50]、ABA受体及其信号转导功能组分的筛选与鉴定[51,52]、ABA信号转导通路模型的构建及与其它植物激素间的相互作用[53-55]等方面的研究均取得了重要进展,其中ABA受体的筛选与鉴定始终是研究ABA信号途径的焦点。直到最近,广泛应用蛋白质互作组学和化学遗传学手段,最终取得了重大突破,确定了第一个ABA受体蛋白家族PYR/PYL/RCAR。ABA受体的明确将成为ABA研究的新起点,为阐明植物体如何在细胞内及胞质间做出ABA响应的具体机制提供新思路。由于细胞内ABA信号转导网络的复杂性,为了更好地弄清其中的具体机制,梳理整合已报道受体从感知ABA到发挥生理作用的分子机制很有必要。本文根据目前已鉴定的ABA受体及其介导的信号通路,绘制图4。
虽然关于ABA信号通路的研究已取得阶段性进展,但如何进一步鉴定有争议的蛋白,如何系统诠释以不同受体蛋白为中心的信号通路作用机制,以及各通路间的相互作用,仍是有待解决的关键问题。虽现有的ABA转导通路模型帮我们了解了部分受ABA 调控的下游事件,如转录重组、保卫细胞离子通道开放等,但仍有很多的下游事件未被阐明,如应对非生物胁迫、调控蛋白质表达、RNA代谢以及表观遗传修饰等。因此,ABA调控这些下游事件的
具体机制也将成为未来科学研究的焦点。此外,ABA还是介导植物应对各种非生物与生物胁迫的重要激素,了解其在体内的作用方式并应用于遗传育种方面以指导培育抗旱作物,应对当今水资源日益匮乏的局面,为现代农业生产提供有价值的理论借鉴。
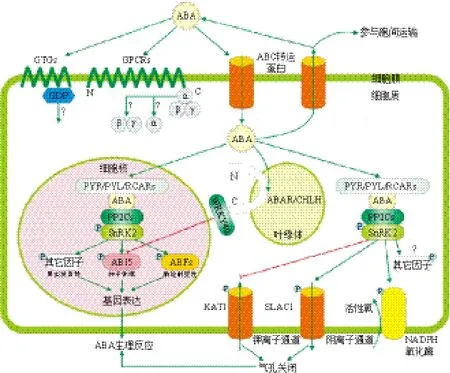
图4 主要的ABA受体及其介导的信号转导通路模型(参考相关文献绘制)
[1] Razem FA, El-Kereamy A, Abramset SR, et al. The RNA-binding protein FCA is an abscisic acid receptor[J]. Nature, 2006, 439(7074):290-294.
[2] Risk JM, Macknight RC, Day CL. FCA does not bind abscisic acid[J]. Nature, 2008, 456(7223):E5-E6.
[3] Zhang DP, Wu ZY, Li XY, et al. Purification and identification of a 42-kilodalton abscisic acid-specific-binding protein from epidermis of broad bean leaves[J]. Plant Physiol, 2002, 128:714-725.
[4] Walker CJ, Willows RD. Mechanism and regulation of Mgchelatase[J]. Biochem J, 1997, 327(2):321-333.
[5] Mochizuki N, Brusslan JA, Larkin R, et al.Arabidopsisgenomes uncoupled 5(GUN5)mutant reveals the involvement of Mg-chelatase H subunit in plastid-to-nucleus signal transduction[J]. Proc Nat Acad Sci USA, 2001, 98(4):2053-2058.
[6] Shen YY, Wang XF, Wu FQ, et al. The Mg-chelatase H subunit is an abscisic acid receptor[J]. Nature, 2006, 443(7113):823-826.
[7] Müller AH, Hansson M. The barley magnesium chelatase 150 kd subunit is not an abscisic acid receptor[J]. Plant Physiol, 2009, 150:157-166.
[8] Wu FQ, Xin Q, Cao Z, et al. The Mg-chelatase H subunit binds abscisic acid and functions in abscisic acid signaling:new evidence inArabidopsis[J]. Plant Physiol, 2009, 150:1940-1954.
[9] Legnaioli T, Cuevas J, Mas P. TOC1 functions as a molecular switch connecting the circadian clock with plant responses to drought[J]. The EMBO Journal, 2009, 28(23):3745-3757.
[10] Shang Y, Yan L, Liu ZQ, et al. The Mg-chelatase H subunit ofArabidopsisantagonizes a group of WRKY transcription repressors to relieve ABA-responsive genes of inhibition[J]. Plant Cell, 2010, 22:1909-1935.
[11] 张大鹏. 始于质体/叶绿体的ABA信号通路[J]. 植物学报, 2011, 46(4):361-369.
[12] Liu ZQ, Yan L, Wu Z, et al. Cooperation of three WRKY-domain transcription factors WRKY18, WRKY40, and WRKY60 in repressing two ABA-responsive genes ABI4 and ABI5 inArabidopsis[J]. J Exp Bot, 2012, 63(18):6371-6392.
[13] Chen H, et al. Roles ofArabidopsisWRKY18, WRKY40 and WRKY60 transcription factors in plant responses to abscisic acid and abiotic stress[J]. BMC Plant Biology, 2010, 10(1):281.
[14] Tsuzuki T, Takahashi K, et al. Mg-chelatase H subunit affects ABA signaling in stomatal guard cells, but is not an ABA receptor inArabidopsis thaliana[J]. J Plant Res, 2011, 124:527-538.
[15] Temple BRS, Jones AM. The plant heterotrimeric G-protein complex[J]. Annu Rev Plant Biol, 2007, 58:249-266.
[16] Liu XG, Yue YL, Li B, et al. A G protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J]. Science, 2007a, 315(5819):1712-1716.
[17] Gao Y, Zeng Q, Guo J, et al. Genetic characterization reveals no role for the reported ABA receptor, GCR2, in ABA control of seed germination and early seedling development inArabidopsis[J]. The Plant Journal, 2007, 52(6):1001-1013.
[18] Liu XG, Yue YL, et al. Response to comment on “A G protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid”[J]. Science, 2007b, 318:914-914.
[19] Risk JM, Day CL, Macknight RC, et al. Reevaluation of abscisic acid-binding assays shows that G-protein-coupled receptor2 does not bind abscisic acid[J]. Plant Physiol, 2009, 150:6-11.
[20] Guo J, Zeng Q, et al. The GCR2 gene family is not required for ABA control of seed germination and early seedling development inArabidopsis[J]. PLoS One, 2008, 3(8):e2982.
[21] Johnston CA, Temple BR, et al. Comment on “A G protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid”[J]. Science, 2007, 318(582):914.
[22] Chen JG, Ellis BE. GCR2 is a new member of the eukaryotic lanthionine synthetase component C-like protein family[J]. Plant Signaling & Behavior, 2008, 3(5):307-310.
[23] Illingworth CJ, Parkes KE, Snell CR, et al. Criteria for confirming sequence periodicity identified by Fourier transform analysis:Application to GCR2, a candidate plant GPCR?[J]. Biophysical Chemistry, 2008, 33(1):28-35.
[24] Assmann SM. Plant G proteins, phytohormones, and plasticity:three questions and a speculation[J]. Sci STKE, 2004, 264:re20.
[25] Jones AM, Assmann SM. Plants:the latest model system for
G-protein research[J]. EMBO Rep, 2004, 5:572-578.
[26] Pandey S, Assmann SM. TheArabidopsisputative G proteincoupled receptor GCR1 interacts with the G protein a subunit GPA1 and regulates abscisic acid signaling[J]. Plant Cell, 2004, 16:1616-1632.
[27] Pandey S, Chen JG, et al. G-protein complex mutants are hypersensitive to abscisic acid regulation of germination and postgermination development[J]. Plant Physiol, 2006, 141:243-256.
[28] Hirayama T, Shinozaki K. Perception and transduction of abscisic acid signals:keys to the function of the versatile plant hormone ABA[J]. Trends Plant Sci, 2007, 12:343-350.
[29] Pandey S, Nelson DC, Assmann SM. Two novel GPCR-type G proteins are abscisic acid receptors inArabidopsis[J]. Cell, 2009, 136:136-148.
[30] Guo JJ, Yang XH, David J, et al. Abscisic acid receptors:Past, Present and Future[J]. Journal of Integrative Plant Biology, 2011, 53(6):469-479.
[31] Pennisi E. Plant biology. Stressed out over a stress hormone[J]. Science, 2009, 324:1012-1013.
[32] Christmann A, Grill E. Are GTGs ABA’s biggest fans?[J]. Cell, 2009, 136(1):21.
[33] Risk JM, Day CL, Macknight RC. Reevaluation of abscisic acidbinding assays shows that G-protein-coupled receptor2 does not bind abscisic acid[J]. Plant Physiology, 2009, 150(1):6-11.
[34] Jones AM, Sussman MR. A binding resolution[J]. Plant Physiology, 2009, 150(1):3-5.
[35] Mc Court P. Genetic analysis of hormone signaling[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50:219.
[36] Zhao Y, Chow TF, Puckrin RS, et al. Chemical genetic interrogation of natural variation uncovers a molecule that is glycoactivated[J]. Nat Chem Biol, 2007, 3:716-721.
[37] Park SY, Fung P, Nishimura N, et al. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J]. Science, 2009, 324(5930):1068-1071.
[38] Nishimura N, Sarkeshik A, et al. PYR/PYL/RCAR family members are majorin-vivoABI1 protein phosphatase 2C-interacting proteins inArabidopsis[J]. Plant J, 2010, 61:290-299.
[39] Rodriguez PL. Protein phosphatase 2C(PP2C)function in higher plants[J]. Plant Molecular Biology, 1998, 38(6):919-927.
[40] Fujii H, Chinnusamy V, et al.In vitroreconstitution of an abscisic acid signaling pathway[J]. Nature, 2009, 462:660-664.
[41] Ma Y, Szostkiewicz I, Kortz A, et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J]. Science Signalling, 2009, 324(5930):1064-1068.
[42] Santiago J, Dupeux F, et al. The abscisic acid receptor PYR1 in complex with abscisic acid[J]. Nature, 2009, 462:665-668.
[43] Nishimura N, Hitomi K, Arvai AS, et al. Structural mechanism of abscisic acid binding and signaling by dimeric PYR1[J]. Science, 2009, 326:1373-1379.
[44] Melcher K, Ng LM, Zhou XE, et al. A gate-latch-lock mechanism for hormone signalling by abscisic acid receptor[J]. Nature, 2009, 462:602-608.
[45] Miyazono K, Miyakawa T, Sawano Y, et al. Structural basis of abscisic acid signaling[J]. Nature, 2009, 462:609-614.
[46] Yin P, Fan H, Hao Q, et al. Structural insights into the mechanism of abscisic acid signaling by PYL proteins[J]. Nat Struct Mol Biol, 2009, 16:1230-1236.
[47] Yuan XQ, Yin P, Hao Q, et al. Single amino acid alteration between valine and isoleucine determines the distinct pyrabactin selectivity by PYL1 and PYL2[J]. J Biol Chem, 2010, 285:28953-28958.
[48] Hao Q, Yin P, Li WQ, et al. The molecular basis of ABA-independent inhibition of PP2Cs by a subclass of PYL proteins[J]. Mol Cell, 2011, 42:662-672.
[49] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism[J]. Annu Rev Plant Biol, 2005, 56:165-185.
[50] Umezawa T, Nakashima K, Miyakawa T, et al. Molecular basis of the core regulatory network in ABA responses:sensing, signaling and transport[J]. Plant Cell Physiol, 2010, 51:1821-1839.
[51] Finkelstein RR, Gampala SS, Rock CD. Abscisic acid signaling in seeds and seedlings[J]. Plant Cell, 2002, 14:S15-S45.
[52] Cutler SR, et al. Abscisic acid:emergence of a core signaling network[J]. Annu Rev Plant Biol, 2010, 61:651-679.
[53] Fedoroff NV. Cross-talk in abscisic acid signaling[J]. Sci STKE, 2002, 140:re10.
[54] Raghavendra AS, Gonugunta VK, et al. ABA perception and signaling[J]. Trends Plant Sci, 2010, 15:395-401.
[55] Wang YH, Irving HR.Developing a model of plant hormone interactions[J].Plant Signal Behav, 2011, 6:494-500.
(责任编辑 狄艳红)
Research Progress on Abscisic Acid Receptor and Signal Transduction Pathway
Cao Jing Lan Haiyan
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046)
Abscisic acid(ABA)is a multi-functional hormone widely existing in plant, by interaction with receptors and consequently with the complex signal network, it can play the physiological roles in regulation of plant growth and development, as well as mediating adaptive responses to diverse environmental stresses. The screening and identification of abscisic acid receptors have been controversial. Recently, there are some breakthroughs in the discovery of the ABA receptors, and its signal transduction has attracted great attention again. In this paper, the latest advances on identification of ABA receptors and ABA signal transduction were reviewed, and the future developing prospects were also discussed.
Abscisic acid Receptors PYR/PYL/RCAR Signal transduction
2013-11-22
国家自然科学基金项目(31060027,31260037)
曹婧,女,硕士研究生,研究方向:植物抗逆分子生物学;E-mail:jingyu90217@163.com
兰海燕,女,博士,教授,研究方向:植物抗逆分子生物学;E-mail:lanhaiyan@xju.edu.cn

