罗非鱼水解蛋白金属离子螯合物的抑菌活性研究
王子怀,胡 晓,李来好,杨贤庆,郝淑贤,吴燕燕,陈胜军,岑建伟
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州510300;2.上海海洋大学食品学院,上海201306;3.中国科学院南海海洋研究所,广东广州510301)
罗非鱼水解蛋白金属离子螯合物的抑菌活性研究
王子怀1,2,胡 晓1,3,李来好1,*,杨贤庆1,郝淑贤1,吴燕燕1,陈胜军1,岑建伟1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州510300;2.上海海洋大学食品学院,上海201306;3.中国科学院南海海洋研究所,广东广州510301)
罗非鱼肉蛋白经木瓜蛋白酶水解后分别与CaCl2、FeCl2按质量比(水解物∶金属盐)为5∶1、10∶1、20∶1进行螯合,研究并比较了罗非鱼水解蛋白钙、亚铁离子螯合物的抗菌活性。结果表明:钙、亚铁离子与水解物的螯合率随着水解物与金属盐质量比的升高而逐渐增大;氨基酸分析表明罗非鱼肉蛋白水解物中具有金属螯合活性的氨基酸含量较高,其占总氨基酸含量的34.59%;抑菌实验显示得到的螯合物对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌的生长表现出明显的抑制作用,其中以5∶1质量比得到的亚铁离子螯合物的抑菌活性最高。
罗非鱼水解蛋白,金属离子螯合物,抑菌活性
我国罗非鱼养殖产量位居世界首位,罗非鱼资源极为丰富。目前,罗非鱼的加工主要以冻全鱼与冻鱼片为主,而出口产品中以加工初级产品较多,深加工产品很少,大大限制了罗非鱼蛋白的高值化利用。钙和铁都是人体必需的金属元素,钙一旦缺乏将影响机体发育并易造成骨质疏松等多种疾病;缺铁易导致贫血和免疫力下降等疾病。人体对钙、铁的需求主要从食物中获得,但其吸收过程及生物利用率受到多方面因素的影响。离子螯合肽是金属离子按一定的摩尔比以共价键同肽类物质结合而成的有机物。钙、铁离子与肽螯合而形成有机态后,能够借助肽在机体内的吸收机制提高其生物利用率[1-4]。研究发现,将具有抗菌活性或抗氧化活性的不同来源的蛋白质水解产物与一些金属离子(如钙、铁、锌、铜等)螯合后可以增强其生物活性[5-10]。因此,蛋白水解物与金属离子的螯合物不仅可以作为一种金属元素补充剂,又可作为食品、化妆品的添加剂,具有很大的研发价值。为提高罗非鱼精深加工和综合利用水平,寻求罗非鱼肉蛋白新的利用途径已成为目前的研究热点,利用罗非鱼肉蛋白制备抗菌活性肽是提高其生物效价的方式之一。纵观国内外文献资料,制备罗非鱼水解蛋白金属离子螯合物并探索其螯合率与抑菌活性关系的相关研究报道不多。本实验以罗非鱼肉为原料,采用酶法水解制备得到罗非鱼肉蛋白水解物,将此水解物分别与钙、铁离子螯合后研究其抑菌活性,以期为具有抗菌活性的金属离子螯合肽的研究与开发提供重要参考。
1 材料与方法
1.1 材料与仪器
罗非鱼 购自广州华润万家超市,取罗非鱼肉,绞碎,放置于聚乙烯袋内于-18℃冻藏备用;木瓜蛋白酶(实际酶活:264000U/g) 广州齐云生物技术有限公司;氯化钙、氯化亚铁、氯化铵 均为分析纯,广州齐云生物技术有限公司;枯草芽孢杆菌(Bacillus subtilis,ATCC6633)、大肠杆菌(E.coli,ATCC25922)、金黄色葡萄球菌(Staphylococcus aureus,ATCC6538)、技术琼脂、营养琼脂 广东环凯生物科技有限公司;氨基酸标准品 Sigma。
DK-S24恒温水浴锅 上海信森实验仪;普及型pH计 德国Sartorius公司;HJ-3恒温磁力搅拌器 江苏荣华仪器制造有限公司;3K30高速冷冻离心机 德国Sigma公司;AA240原子吸收光谱仪 美国Varian公司;Mars xpress微波消解仪 美国CEM公司;1100 series高效液相色谱 美国Agilent公司;PICO.TAG色谱柱 Waters,Milford,MA,USA;Transsonic T1-H-10超声波清洗仪 德国Elma公司;Alpha1-4冷冻干燥机 德国Chaist公司。
1.2 实验方法
1.2.1 罗非鱼肉蛋白水解物的制备 参考马赛蕊等[11]方法,取罗非鱼肉解冻后以1∶2(m/V)加入去离子水均质至混合物呈均一乳白色后,55℃恒温水浴。待样品中心温度达到55℃后,添加木瓜蛋白酶,加酶量为0.3g/100g鱼肉,搅拌酶解4h后沸水浴15min灭酶。冷却后,于4℃、10000r/min离心20min后,抽滤得到的滤液即为酶解液。将酶解液冻干后即得到罗非鱼肉蛋白水解物。
1.2.2 罗非鱼肉水解蛋白金属离子螯合物的制备 本实验选取亚铁、钙两种金属离子与上述罗非鱼肉蛋白水解物螯合并测定螯合物的螯合率。以CaCl2、FeCl2为金属源,配制5mg/mL CaCl2、FeCl2溶液,称取一定量的水解物溶于水中,室温水化10min,然后按比例加入CaCl2、FeCl2(水解物与金属盐质量比为5∶1、10∶1、20∶1)于37℃水浴40min进行螯合反应。反应结束后将溶液全部移入透析袋透析并记录透析后溶液的总膨胀体积,透析后溶液经冷冻干燥即得螯合物样品。
1.2.3 螯合率测定 取上述透析后溶液5mL于消化管(经10%HNO3浸泡过夜并用去离子水洗净),加入10mL浓硝酸和5mL去离子水后进行微波消解。取5mL消解液于100mL容量瓶(经10%HNO3浸泡过夜并用去离子水洗净),以去离子水定容后用原子吸收法测定溶液中所含金属离子的浓度C(mg/L),后经计算可得各螯合物的螯合率。
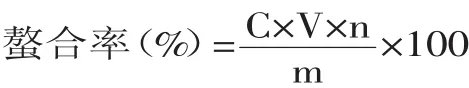
式中:C:为透析后金属离子的浓度(mg/L);V:为总膨胀体积(mL);m:为加入金属总质量(g);n:为稀释倍数。
1.2.4 螯合物的抑菌活性 参考张岩等[12]方法从4℃冰箱中取出的保藏菌株需经活化后使用,用接种环挑取适量菌苔在营养琼脂斜面上划线,37℃过夜培养。采用牛津杯双层平板法检测各螯合物抑菌活性,取5mL灭菌的2%琼脂于培养皿中铺平,待其凝固后摆放牛津杯,将1mL浓度为108CFU/mL测试菌液加入到灭菌后冷却到46℃的营养琼脂中,摇匀后适量倾倒入上述平板,待营养琼脂凝固后用灭菌的镊子小心取出牛津杯,向每个孔中分别加入一种螯合物水溶液(24mg/mL)150μL以测试各螯合物的抑菌活性,设置三个平行,以相同浓度(如5∶1质量比的螯合物相应的肽水解物浓度为20mg/mL)的肽水解物溶液作对照,以无菌水作空白,将培养皿小心移至恒温箱37℃培养12h,观察结果并测量抑菌圈直径。
1.2.5 氨基酸分析 用6mol/L盐酸于110℃处理样品24h,使其充分水解,采用反相高效液相色谱(Agilent)及PICO.TAG柱(Waters),以异硫氰酸苯酯柱前衍生化反相高效液相法[13]测定其氨基酸组成。其中色氨酸经碱解后测定,氨基酸标准品经过相同步骤处理后进行分析。
1.2.6 数据分析 实验数据用平均值±标准差表示(n=3),采用SPSS16.0统计软处理数据,应用t-test检验组间差异显著性,p<0.05表示组间差异显著。
2 结果与分析
2.1 螯合率测定结果
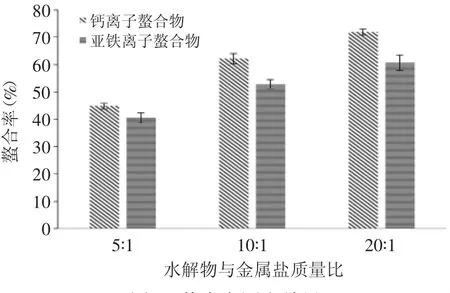
图1 螯合率测定结果Fig.1 Chelation rate of the samples
本实验中,罗非鱼肉蛋白水解物与钙离子和亚铁离子按质量比(水解物∶金属盐)5∶1、10∶1及20∶1进行螯合。由图1可知,钙离子螯合物在5∶1、10∶1及20∶1的配比下的螯合率分别为44.82%、62.17%及71.88%;亚铁离子螯合物的螯合率为40.49%、52.84%及60.72%。不同金属离子与同种蛋白水解物的螯合率不同,相同质量比下,水解物与钙离子的螯合率较亚铁离子的高,说明相同条件下水解物更易与钙离子发生螯合反应;而同种金属在不同质量比下,螯合率随着质量比升高而增大。
2.2 氨基酸分析结果
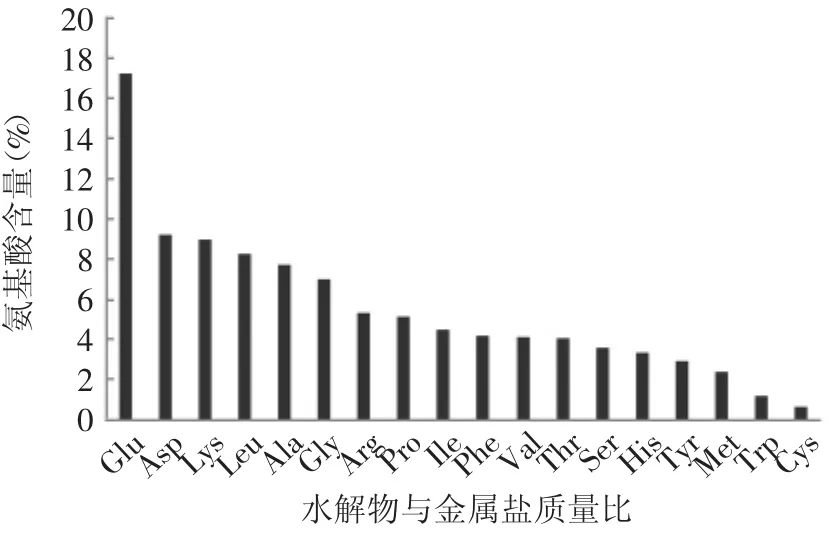
图2 罗非鱼蛋白水解物的氨基酸含量Fig.2 Amino acids content of tilapia protein hydrolysates
有研究表明,肽或蛋白的氨基酸组成及序列决定了其与金属离子结合的效果,具有高含量谷氨酸和天冬氨酸残基的肽或蛋白与金属离子的结合效果较好,Asp-Glu-Asp和Glu-Glu-Glu可能是与金属离子结合的关键序列[14-15]。几种与金属螯合活性较高的氨基酸已见诸报道,如组氨酸、丝氨酸、半胱氨酸、谷氨酸、天冬氨酸[16]。本实验中测得罗非鱼肉蛋白水解物样品中谷氨酸占17.28%,天冬氨酸占9.25%,组氨酸占3.38%,丝氨酸占3.58%,半胱氨酸占0.68%,这五种螯合活性较高的氨基酸占总氨基酸的34.59%,含量较高,这可能是罗非鱼蛋白水解物具有较好螯合钙、铁离子能力的主要原因。此外,有报道认为半胱氨酸是影响蛋白水解物尤其是肉类蛋白水解物与亚铁离子的螯合活性的重要氨基酸[17-19],而Kroll[20]发现钙离子与蛋白水解物的螯合活性与酸性氨基酸(Asp,Glu)上的羧基及组氨酸上的咪唑基团有关。本实验中得到的罗非鱼蛋白水解物中半胱氨酸(Cys)含量为0.68%,显著低于酸性氨基酸(Asp,Glu)与组氨酸的含量,这与亚铁离子螯合率较钙离子螯合率低的结果相一致。
2.3 金属离子螯合物抑菌活性
2.3.1 金属离子螯合物对枯草芽孢杆菌的抑菌活性
由表1可知,以无菌水做对照,水解物对枯草芽孢杆菌未表现出抑制效果,其抑菌圈直径小于无菌水可能由于是水解物无抑菌活性,但其本身作为营养物质又能被细菌利用助其生长所致。螯合物中,钙离子螯合物与无菌水的抑菌活性没有显著性差异(p>0.05),说明钙离子螯合物不能抑制枯草芽孢杆菌生长;以质量比为5∶1得到的亚铁离子螯合物抑菌圈直径达13.14mm,抑菌作用明显;三种亚铁离子螯合物与无菌水的抑菌活性均存在显著性差异(p<0.05),说明三种亚铁离子螯合物均能够抑制枯草芽孢杆菌生长;此外,不同质量比得到的三种亚铁离子螯合物的抑菌活性也有显著性差异(p<0.05),随着质量比增大,所得螯合物的抑菌活性下降明显,其原因可能是样品中亚铁离子的含量随质量比增大而减少,故螯合物的抑菌效果反而降低。
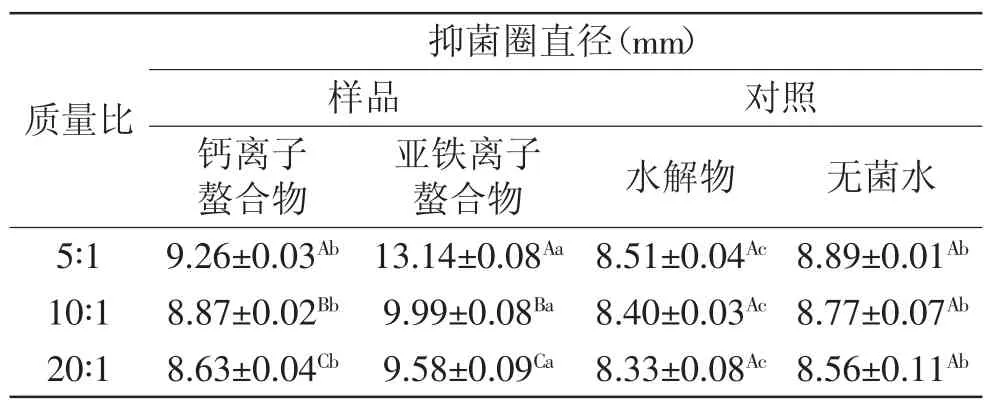
表1 螯合物对枯草芽孢杆菌的抑菌活性Table 1 Antibacterial activity of the chelates against Bacillus subtilis
2.3.2 金属离子螯合物对大肠杆菌的抑菌活性 表2中,水解物作为20∶1质量比得到螯合物的抑菌实验对照组,其抑菌圈直径与前两次实验呈显著性差异(p<0.05),这是由于实验用牛津杯的直径存在差别而造成的,对比其与无菌水的抑菌圈大小可知水解物对大肠杆菌无抑制效果。质量比为5∶1得到的亚铁离子螯合物抑菌圈直径达12.22mm,抑菌作用明显,其与10∶1和20∶1质量比得到的亚铁离子螯合物的抑菌活性差异显著(p<0.05)。以10∶1和20∶1质量比得到的亚铁离子螯合物与无菌水的抑菌活性差异显著(p<0.05),但这两种螯合物间的抑菌活性无显著差异(p>0.05),说明亚铁离子与水解物在三种质量比下得到的不同螯合物均表现出对大肠杆菌的抑制活性,但随着质量比增大,所得螯合物的抑菌活性显著下降。钙离子螯合物与无菌水间没有显著性差异(p>0.05),说明其无抑菌效果。
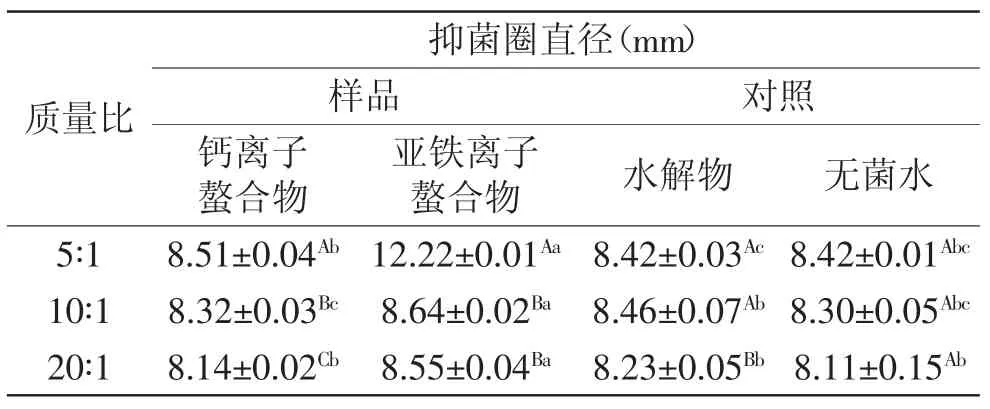
表2 螯合物对大肠杆菌的抑菌活性Table 2 Antibacterial activity of the chelates against E.coli
2.3.3 金属离子螯合物对金黄色葡萄球菌的抑菌活性 由表3可知,水解物对金黄色葡萄球菌也未表现出抑制效果,钙离子螯合物对金黄色葡萄球菌生长没有抑制作用。以质量比为5∶1得到的亚铁离子螯合物抑菌作用明显,抑菌圈直径为13.23mm,其与10∶1和20∶1质量比得到的亚铁离子螯合物的抑菌活性差异显著(p<0.05);以质量比10∶1得到的亚铁离子螯合物有抑菌作用,其与无菌水的抑菌活性差异显著(p<0.05);而以质量比20∶1得到的亚铁离子螯合物未表现出抑菌活性且三种质量比下得到的不同螯合物的抑菌活性有显著性差异(p<0.05),表明亚铁离子螯合物能够抑制金黄色葡萄球菌生长,但随着质量比的增大,所得螯合物的抑菌活性显著下降。

表3 螯合物对金黄色葡萄球菌的抑菌活性Table 3 Antibacterial activity of the chelates against Staphylococcus aureus
综上所述,相同的细菌浓度下,亚铁离子螯合物较钙离子螯合物表现出更好的抑菌活性,其中以质量比为5∶1得到的亚铁离子螯合物抑菌效果最好,初步分析可能是由于虽然质量比为20∶1得到的螯合物螯合率最高,但其样品干粉中实际金属含量较质量比为5∶1得到的螯合物少(1g以20∶1质量比得到的亚铁离子螯合物干粉中金属含量为0.03g,而5∶1的螯合物中金属含量为0.07g),因此能与细菌细胞膜上各亲疏水基团结合而造成其细胞膜损伤或代谢紊乱的金属离子数量降低,抑菌活性随螯合率上升反而下降。该螯合物对三种指示菌的抑制活性也有差异,对枯草芽孢杆菌及金黄色葡萄球菌的抑菌圈分别为13.14mm及13.23mm,高于大肠杆菌的12.22mm,而其中前两者为革兰氏阳性菌,后者为革兰氏阴性菌,说明该螯合物对革兰氏阳性菌的抑制效果可能要好于革兰氏阴性菌。另外,对照无菌水可见该水解物的水溶液对三种指示菌未表现出抑菌活性,但在与亚铁离子螯合后抑菌活性有所提高,说明罗非鱼肉蛋白水解在与某些金属离子螯合后能够增强其抑菌活性。
3 结论
罗非鱼肉蛋白水解物与钙、亚铁离子螯合的螯合率随着水解物与金属盐质量比的升高而逐渐增大,最高可达71.88%。对酶解产物的氨基酸分析表明该水解物中具有金属螯合活性的氨基酸占总氨基酸的34.59%,含量较高,这与螯合率较高的结果一致。比较此水解物与钙离子和铁离子的螯合物对相同浓度的指示菌的抑制效果,发现该蛋白水解物与亚铁离子在特定条件下得到的螯合物对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌的生长有明显的抑制作用,不同螯合物间抑菌活性存在差异,其中以质量比为5∶1得到的亚铁离子螯合物抑菌活性最高,对三种指示菌的生长都表现出一定的抑制效果,其原因可能是该质量比下制得的螯合物中金属离子含量最高,因此更易造成细菌细胞损伤或代谢紊乱。
金属离子螯合物作为一种新型金属元素补充剂是时下的研究热点,而以一些具有特殊生物活性的蛋白水解物与金属离子进行螯合,则既可以达到补充金属元素的效果,同时利用蛋白水解物的功能特性可使螯合产物成为一种天然无副作用的添加剂,应用于食品,饮料,药品,化妆品等领域,大大增加了螯合物的用途和价值。在后续实验中,期望摸索新的水解工艺以得到具有更高抑菌活性的蛋白水解物,优化螯合工艺以制备抑菌效果更好的螯合物,并探索螯合物结构与其抑菌活性间的关系。
[1]邱松山,姜翠翠,海金萍.罗非鱼加工中废弃物的综合利用探讨[J].食品与发酵科技,2010,46(3):22-24.
[2]施用晖,乐国伟,左绍群,等.产蛋鸡日粮中添加酪蛋白肽对产蛋性能及血浆肽和铁,锌含量的影响[J].四川农业大学学报,1996,14(s1):46-50.
[3]Kapsokefalou,Miller.Iron speciation in intestinal contents of rats fed meals composed of meat and nonmeat sources of protein and fat[J].Food chemistry,1995,52(1):47-56.
[4]Fouad M T.The physiochemical role of chelated minerals in maintaining optimal body biological functions[J].Journal of Applied Nutrition,1976:28.
[5]许庆陵,曾庆祝,闫磊,等.罗非鱼多肽-锌配合物的制备及其生物活性[J].食品科学,2010,31(10):75-80.
[6]丁利君,危雪如.罗非鱼蛋白酶解液的多肽与钙复合物的制备及其抑菌分析[J].食品科学,2009(20):198-202.
[7]钟明杰.带鱼下脚料蛋白水解螯合物制备及生物特性研究[D].青岛:中国海洋大学,2009.
[8]霍健聪,邓尚贵,谢超.多肽亚铁螯合物制备及抑菌活性研究[J].食品与机械,2009(1):86-89.
[9]霍健聪,邓尚贵,谢超.带鱼下脚料蛋白多肽亚铁螯合物的制备及抗氧化活性研究[J].食品工业科技,2009,30(4):267-270.
[10]黄薇,邓尚贵,唐艳,等.鳕鱼皮复合肽螯合钙的制备及抗氧化活性研究[J].食品科技,2012(3):143-146.
[11]马赛蕊,胡晓,吴燕燕,等.罗非鱼肉蛋白酶解液的抗氧化活性[J].食品科学,2012,33(19):52-56.
[12]张岩,吴燕燕,李来好,等.合浦珠母贝黏液细菌F35的鉴定及其抗菌物质分析[J].食品科学,2012,21:48.
[13]You L,Zhao M,Cui C,et al.Effect of degree of hydrolysis on the antioxidant activity of loach(Misgurnus anguillicaudatus)protein hydrolysates[J].Innovative Food Science& Emerging Technologies,2009,10(2):235-240.
[14]Bao X L,Lv Y,Yang B C,et al.A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J].Journal of Food Science,2008,73(3):C117-C121.
[15]Huang G,Ren Z,Jiang J.Separation of iron-binding peptides from shrimp processing by-products hydrolysates[J].Food and Bioprocess Technology,2011,4(8):1527-1532.
[16]Lv Y,Liu Q,Bao X,et al.Identification and characteristics of iron-chelating peptides from soybean protein hydrolysates using IMAC-Fe3+[J].Journal of Agricultural and Food Chemistry,2009,57(11):4593-4597.
[17]Glahn R P,Van Campen D R.Iron uptake is enhanced in Caco-2 cell monolayers by cysteine and reduced cysteinyl glycine[J].The Journal of Nutrition,1997,127(4):642-647.
[18]Martinez-Torres C,Romano E,Layrisse M.Effect of cysteine on iron absorption in man[J].The American Journal of Clinical Nutrition,1981,34(3):322-327.
[19]Taylor P G,Martinez-Torres C,Romano E L,et al.The effect of cysteine-containing peptides released during meat digestion on iron absorption in humans[J].The American Journal of Clinical Nutrition,1986,43(1):68-71.
[20]Kroll RD.Effect of pH on the binding of calcium ions by soybean proteins[J].Cereal Chemistry,1984,61:490-495.
Antibacterial activity of tilapia protein hydrolysates chelated with metal ions
WANG Zi-huai1,2,HU Xiao1,3,LI Lai-hao1,*,YANG Xian-qing1,HAO Shu-xian1,WU Yan-yan1,CHEN Sheng-jun1,CENG Jian-wei1
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,National R&D Center for Aquatic Product Processing,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;3.South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China)
Tilapia meat protein was hydrolyzed by papain and then the hydrolysates were chelated with CaCl2and FeCl2at the mass ratio(hydrolysate:mineral salt)of 5∶1,10∶1 and 20∶1,respectively.The antibacterial activity of the chelates was investigated.The result showed that the chelation rates were gradually increased with the increasing of the mass ratio.Amino acids analysis indicated that tilapia meat protein-hydrolysates had high content of chelating amino acids which accounted for 34.59%of total amino acid.Finally,antibacterial test showed that some chelates obtained under the certain conditions had significant antibacterial activity against Bacillus subtilis,Escherichia coli,and Staphylococcus aureus.The hydrolysate-ferrous ion chelate,which was obtained under the mass ratio of 5∶1,had the highest antibacterial activity against the three indicator bacterium.
tilapia protein hydrolysates;metal ion chelating;antibacterial activity
TS201.2
A
1002-0306(2014)08-0079-05
10.13386/j.issn1002-0306.2014.08.008
2013-06-17 *通讯联系人
王子怀(1988-),男,硕士研究生,研究方向:食品科学与工程。
国家自然科学基金(31301454);“十二五”国家科技支撑计划项目(2012BAD28B06);国家农业科技成果转化资金项目(2010GB23260577,2010GB2E000335);国家现代农业产业技术体系(CARS-49);广东省科技计划重点项目(2011A020102005);广东省海洋渔业科技推广专项(A201101C01);中央级公益性科研院所基本科研业务费专项资金项目(2011TS01)。

