类风湿关节炎关节液抑制间充质干细胞增殖
蒋志琼,唐 中,谭 竟,吴碧华
(川北医学院附属医院1.老年科,2.检验科,3.风湿科,四川南充637000)
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有自我更新和多向分化潜能的非造血干细胞,不仅来源广泛,体外培养增殖迅速,而且除具有支持体外造血、促进体内造血重建、组织损伤修复外还具有独特的免疫调节作用[1],为类风湿关节炎(rheumatoid arthritis,RA)的治疗带来了新的应用前景。但是,已有的研究[2]发现MSCs 在RA 动物模型体内并没有发挥预期的免疫负调节和损伤组织修复作用,这是否与RA 的炎性环境致MSCs 生物学特性改变有关呢?故对此作一相关研究。
1 材料与方法
1.1 材料:1)试剂:LG-DMEM 培养液(GIBCO 公司),反转录试剂盒ReverTra Ace 组合型(成都博瑞克生物技术有限公司),成人骨髓MSCs 成骨诱导分化完全培养基(广州赛业生物科技有限公司)。2)标本:骨髓标本来源于14 例健康志愿者。关节液来源于活动期RA 患者,共5 例,病程均超过10年。标本收集获得本单位伦理委员会的审查批准及本人的知情同意。
1.2 方法
1.2.1 骨髓MSCs 的分离培养:采用密度梯度离心法结合贴壁筛选法,取P3 代用于后续实验。
1.2.2 RA 关节液对MSCs 增殖的影响:将MSCs 以相同的数量(约4 000 个/孔)接种于96 孔板。实验组MSCs 培养液中分别加入10%、30%和50% 浓度的RA 关节液上清,对照组不加。培养5 d 后采用MTT 法检测各孔吸光度值(absorbance,A 值)。
1.2.3 RA 关节液对MSCs 凋亡的影响:将MSCs 以相同的数量(约105个/孔)接种于6 孔板,实验组MSCs 培养液中加入50%浓度的RA 关节液上清,对照组不加。培养5 d 后消化收获各组细胞,采用凋亡试剂盒流式细胞仪检测各组凋亡情况。
1.2.4 RA 关节液对MSCs 成骨诱导的影响:将MSCs 以相同的数量(约105个/孔)接种于6 孔板。实验组MSCs 培养液中加入50% RA 患者关节液上清,设空白对照。培养5 d后开始加入成骨细胞诱导液诱导,每3 天完全换液1 次,共诱导7 d。茜素红染色检测钙结节的形成,RT-PCR 检测成骨细胞特异性产物骨桥蛋白基因的表达。
2 结果
2.1 MSCs 的生长特性和形态学观察:14 例标本均成功分离培养得到MSCs。MSCs 原代培养7~12 d 可铺满瓶底达80%以上,传代后细胞增殖更迅速,P3 代5~7 d 即可长满瓶底达80%以上,细胞形态均匀一致。至P5 代,MSCs 的增殖逐渐变慢,并出现胞体变大,突起增多的老化现象。
2.2 RA 患者关节液对MSCs 增殖的影响:加入RA 患者关节液培养的实验组MSCs,当关节液浓度为10%时的A 值为0.234 ±0.029,30%时为0.227 ±0.065,50% 时为0.194 ±0.059,显著低于对照组的0.269 ±0.047。
2.3 RA 患者关节液对MSCs 凋亡的影响:流式细胞仪分析显示经50% RA 患者关节液作用后的实验组MSCs 的凋亡比例为41.53%,与对照组的45.5%接近。
2.4 RA 患者关节液对MSCs 成骨诱导的影响:50% RA 患者关节液培养5 d 的MSCs,经成骨诱导7 d 后与对照组相比,产生的矿化结节数量更多且体积更大(图1)。实验组MSCs 经成骨诱导7 d 后就明显可见骨桥蛋白基因的表达,而对照组MSCs 骨桥蛋白基因的表达量还很少(图2)。
3 讨论
类风湿关节炎的发病机制目前并未真正明确,传统的治疗方法仍需发展。生物制剂的应用为RA 的治疗带来了新的希望,但治疗费用昂贵、易发生各种感染,且仅能控制或阻止疾病的进展,当关节畸形后,无法修复软骨及骨的破坏,因而有待寻求更好的治疗方法。
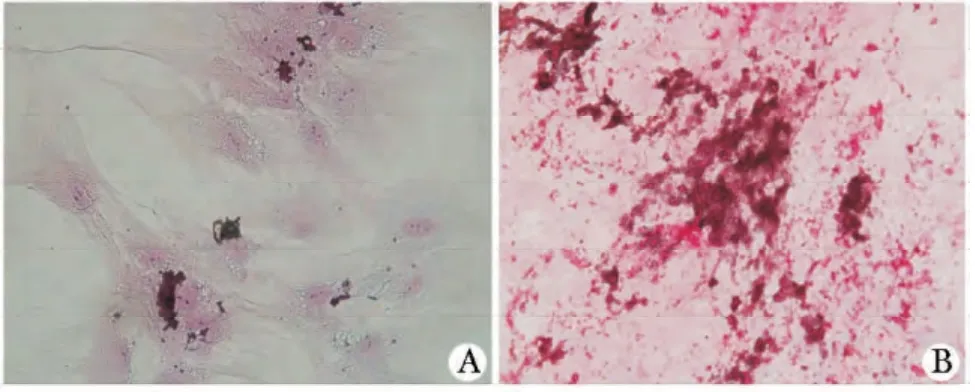
图1 MSCs 成骨诱导后茜素红染色示意图Fig 1 MSCs alizarin red staining after osteogenesis induction(×100)

图2 RT-PCR 示骨桥蛋白基因的表达Fig 2 RT-PCR in the expression of osteopontin gene
MSCs 兼具免疫调节与组织修复功能,有望成为RA 新的治疗手段。目前有研究[3]发现RA 滑液中的炎性环境可使定居于滑液纤维间质中的自身MSCs 数量降低,并会影响其功能的发挥,使其软骨形成能力受损,且新生软骨也可能被降解。但是RA 患者的炎性环境对外源性的MSCs 又有何影响呢?本研究发现RA 患者的炎性关节液可导致健康者MSCs 的增殖减慢,但是不会引起其凋亡增加。更进一步的研究发现,经关节液作用后的MSCs,其向成骨细胞分化的速度明显加快了。目前研究认为MSCs 向成骨细胞分化,一般要2~3 周才能检测到骨桥蛋白基因的表达。而经关节液作用7 d 的MSCs 经诱导1 周后就可见骨桥蛋白基因的表达,而此时未予关节液处理的MSCs 其骨桥蛋白基因的表达量是很弱的。因此认为RA 患者关节液抑制外源性MSCs 的增殖,可能是由于促进其向成骨细胞分化,因而是可以对RA的骨破坏提供治疗作用的。
[1]Tyndall A,Walker UA,Cope A,et al.Immunomodulatory properties of mesenchymal stem cells:a review based on an interdisciplinary meeting held at the Kennedy Institute of Rheumatology Division,London,UK,31 October 2005[C].Arthritis Res Ther,2007,9:301-301.
[2]Greish S,Abogresha N,Abdel-Hady Z,et al.Human umbilical cord mesenchymal stem cells as treatment of adjuvant rheumatoid arthritis in a rat model[J].World J Stem Cells,2012,4:101-109.
[3]Jones E,Churchman SM,English A,et al.Mesenchymal stem cells in rheumatoid synovium:Enumeration and functional assessment in relation to synovial inflammation level[J].Ann Rheum Dis,2010,69:450-457.

