转nanog基因抑制帕金森病大鼠脑内小胶质细胞介导的炎性反应
陈施艳,张志坚,刘丽金,林 红,吴秀丽,王 伟,王志强
(福建医科大学附属第一医院神经内科,福建福州350005)
帕金森病(parkinson's disease,PD)是一种常见的神经系统退行性疾病,以中脑黑质致密部多巴胺能神经元变性死亡为主要病理特点。值得注意的是,帕金森病患者尸检发现黑质致密部除多巴胺能神经元缺失外,还伴随大量的胶质细胞增殖,小胶质细胞激活后释放多种炎性因子,如肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、IL-1β、核因子κB(nuclear factor kappa B,NF-κB)和反应性氧自由基等,导致多巴胺能神经元损伤。近年证据表明,炎性反应参与了帕金森病多巴胺能神经元的变性过程,成为目前研究热点[1-3]。有学者在胚胎干细胞分化研究中发现,Nanog 可通过与NF-κB 蛋白结合抑制NF-κB 转录[4]。前期工作已成功构建携带nanog 基因的慢病毒载体,并证实其能抑制小鼠骨髓间质细胞中NF-κB 的表达[5],抑制脂多糖诱导的大鼠小胶质细胞中NF-κB 的转录[6],同时证实了帕金森病大鼠脑内炎性因子升高[7]。转nanog 基因对帕金森病发病中炎性反应是否产生影响?本实验在观察帕金森病大鼠脑内小胶质细胞和炎性因子变化的基础上,进一步观测Nanog 对多巴胺能神经元存活、小胶质细胞数量及TNF-α 表达的影响,为帕金森病的抗感染治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物实验分组与帕金森病大鼠模型的制备:清洁级雄性SD 大鼠32 只,体质量250~300 g(上海斯莱克实验动物有限责任公司,许可证:SCXK沪,2012-0001),随机分为对照组、6-OHDA + PBS组、6-OHDA + 慢病毒空载体PNL 组和6-OHDA +nanog 组(每组n =8)。采用双靶点注射神经毒素6-羟多巴胺(6-hydroxydopamine,6-OHDA)诱导方法制备帕金森病大鼠模型[8]。采用单侧双点立体定向注射法,先将2.5 μL 浓度为2 g/L 的6-OHDA 注射到大鼠左侧纹状体内;再将5 μL 携带nanog 基因的慢病毒载体、慢病毒空载体、PBS 分别注射到6-OHDA+ nanog 组、6-OHDA + PNL 组与6-OHDA +PBS 组大鼠左侧纹状体内。因预实验显示动物在注射6-OHDA 后近14 d 才有明显旋转行为改变,故选择在注射后14 d 这个时间点进行行为学评估以及脑组织取材进行各项指标的组织化学检测。所有动物均在室温22~25 ℃饲养,光线12 h 交替,自由饮水、进食,在实验前经反复检测无异常旋转行为。
1.1.2 主要试剂:慢病毒载体质粒PNL-IRES.EGFP,包装质粒HELPER,包膜质粒VSVG 以及293T 细胞均由美国杜兰大学陈一平教授惠赠。Top10 菌(福建医科大学林建银教授惠赠)。其他主要试剂:反转录酶、限制性内切酶BamH Ⅰ和Sal Ⅰ(Promega公司),高保真Pfu ultra DNA 聚合酶(Strategen 公司),Trizol 以及脂质体lipofectamin 2000(Invitrogen公司),polybrene(Sigma 公司),质粒抽提试剂盒(Qiagen 公司),DNA 凝胶回收试剂盒(上海博亚生物公司)。胎牛血清(PAA)、胰蛋白酶、6-OHDA、阿朴吗啡(Sigma 公司),兔抗大鼠酪氨酸羟化酶(tyrosine hydroxylase,TH)多克隆抗体(武汉博士德公司),辣根酶标记羊抗兔IgG 多聚体、DAB(北京中衫金桥公司),羊抗大鼠IBA1 多克隆抗体、兔抗大鼠TNF-α 多克隆抗体(Abcam 公司),驴抗羊IgGTRITC、驴抗兔IgG-TRITC(Jackson 公司)。
1.2 方法
1.2.1 携带nanog 基因慢病毒载体构建、鉴定:慢病毒载体的构建与鉴定已在前期相关研究中完成,所获病毒载体滴度为(6.1~6.8)×106IU/mL。该慢病毒载体质粒基因序列中的目的基因与Egfp 基因之间以IRES(内部核糖体进入位点)相连接,使二者转录出一条单顺反子,同时翻译出两种蛋白,从而通过观察EGFP 的表达直观地观测目的基因的表达。构建的载体的鉴定参照文献[5-6]。
1.2.2 行为学的检测:于手术后14 d 经腹腔注射0.5 mg/kg 阿朴吗啡(apomorphine,APO),诱发大鼠向健侧旋转,注射后5 min 观察各组大鼠旋转行为学改变,计算大鼠每分钟的旋转次数。计算标准以动物向注射对侧不改变方向旋转360°计为旋转1次,每只动物每次记录30 min 为限,若每次大鼠均恒定地转向右侧,平均≥7 转/min 视为成功模型。
1.2.3 TH 免疫组织化学检测:各亚组动物分别在注射后第14 天,用10%水合氯醛进行麻醉,经左心室注入肝素0.9%氯化钠注射液150 mL 及4%多聚甲醛溶液200 mL 进行灌注固定后,断头取脑置固定液中过夜。于中脑区行冰冻切片连续冠状切片,厚约20 μm,自前囟后5 mm 层面开始,每隔5 张选取1 张,每5 张为1 组,共取5 组。取一组切片用于TH 免疫组织化学染色。TH 免疫组织化学染色步骤按照试剂盒说明书进行。每只大鼠的5 张切片置显微镜下计数黑质区TH 免疫反应阳性神经元,分别累计大鼠注射侧黑质区TH 阳性神经元数目。
1.2.4 脑内nanog 基因表达的观测:各亚组的取材同1.2.3 步骤,取一组脑组织切片用于观测脑内nanog 基因表达。在荧光显微镜下,切片中注射针道周围0.5 mm 范围内任意选4 个视野,计算其表达绿色荧光的细胞个数,取均数。
1.2.5 小胶质细胞IBA1 及TNF-α 免疫荧光检测:各亚组的取材同1.2.3 步骤,分别各取一组脑组织切片进行小胶质细胞IBA1 及TNF-α 免疫荧光检测。小胶质细胞IBA1 及TNF-α 的免疫荧光染色分别按照试剂盒说明书操作。在荧光显微镜下,观察小胶质细胞的激活情况,并累计各组大鼠注射侧黑质区的小胶质细胞及TNF-α 表达阳性细胞的数目。
1.3 统计学分析
2 结果
2.1 APO 诱发旋转的行为学检测
在注射6-OHDA 后第14 天,模型组(6-OHDA+PBS、6-OHDA+PNL 与6-OHDA +nanog 组)大鼠均出现不同程度的向右侧健侧旋转。其中,6-OHDA+nanog 组大鼠APO 诱发的旋转次数少于6-OHDA+PNL 组与6-OHDA+PBS 组(P<0.05)(表1)。
2.2 nanog 基因在脑内的表达
注射后第14 天,对照组和6-OHDA +PBS 组几乎无绿色荧光表达,而在6-OHDA+PNL 组与6-OHDA+nanog 组的针道周围0.5 mm 范围内观察到大量绿色荧光阳性细胞(图1)。
表1 APO 诱发大鼠旋转实验结果Table 1 The results of APO-induced rotation in rats (turns/min)(±s)

表1 APO 诱发大鼠旋转实验结果Table 1 The results of APO-induced rotation in rats (turns/min)(±s)
*P<0.01 compared with control group;#P<0.05 compared with 6-OHDA+PNL and 6-OHDA+PBS groups.
groupscontrol6-OHDA+PBS6-OHDA+PNL6-OHDA+nanog 14 days after injection08.79 ±1.46*8.37 ±1.28*5.87 ±0.94*#

图1 各组大鼠注射侧脑纹状体绿荧光阳性细胞的观察与比较Fig 1 The number of green fluorescent positive cells in the left striatum of the rat brain in each group
2.3 各组大鼠中脑黑质中TH 阳性神经元的观察
光镜下观察大鼠中脑切片可见TH 阳性神经元分布于黑质,其形态为大多角形或锥形细胞,胞质棕染。注射后第14d,模型组大鼠注射侧黑质TH 阳性细胞数较对照组明显减少(P<0.05),但6-OHDA+nanog 组黑质区存活的TH 阳性细胞数多于6-OHDA+PNL 组与6-OHDA+PBS 组(P<0.05)(表2,图2)。
2.4 各组大鼠注射侧中脑黑质中小胶质细胞数量及TNF-α 含量的变化
IBA1-TRITC 免疫荧光染色呈红色阳性的细胞为小胶质细胞。与正常对照组相比,注射后第14 天,模型组大鼠注射侧中脑黑质区小胶质细胞数量增加(P<0.05),且阳性细胞胞体增大,突起变短、增粗,形态呈典型“阿米巴状”。但6-OHDA+nanog 组小胶质细胞数低于6-OHDA+PNL 组与6-OHDA+PBS 组(P<0.05)(表2,图3)。
免疫荧光染色呈红色者为TNF-α 阳性表达。与正常对照组相比,注射后第14 天,模型组大鼠注射侧中脑黑质区TNF-α 表达明显增加(P<0.05),但6-OHDA+nanog 组的TNF-α 表达阳性细胞数少于6-OHDA + PNL 组与6-OHDA + PBS 组(P<0.05)(表2,图4)。
表2 各组动物左侧注射6-OHDA 的黑质区TH、IBA1、TNF-α 免疫组化阳性细胞数Table 2 Number of TH,IBA1,TNF-α immunopositive cells in the left substantia nigra(number / section)(±s)
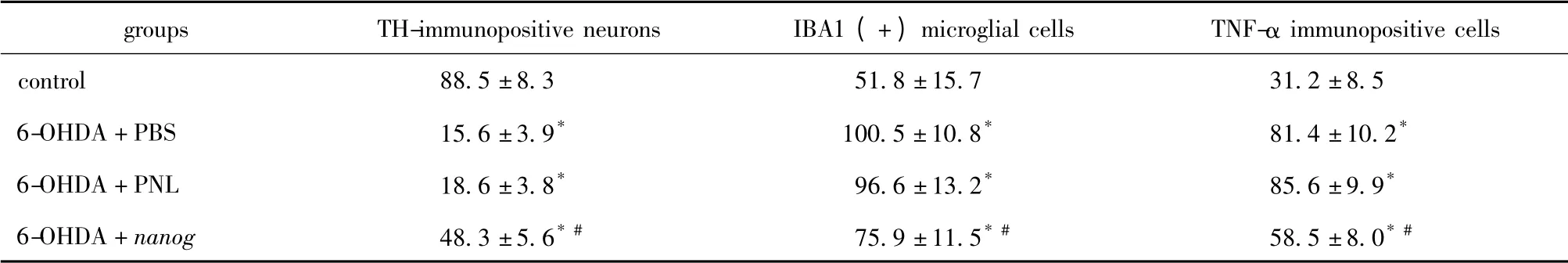
表2 各组动物左侧注射6-OHDA 的黑质区TH、IBA1、TNF-α 免疫组化阳性细胞数Table 2 Number of TH,IBA1,TNF-α immunopositive cells in the left substantia nigra(number / section)(±s)
*P<0.05 compared with control group;#P<0.05 compared with 6-OHDA+PNL and 6-OHDA+PBS groups.
groupsTH-immunopositive neuronsIBA1 (+)microglial cellsTNF-α immunopositive cells control88.5 ±8.351.8 ±15.731.2 ±8.5 6-OHDA+PBS15.6 ±3.9*100.5 ±10.8*81.4 ±10.2*6-OHDA+PNL18.6 ±3.8*96.6 ±13.2*85.6 ±9.9*6-OHDA+nanog48.3 ±5.6* #75.9 ±11.5* #58.5 ±8.0*#

图2 各组大鼠注射侧脑组织黑质区TH 阳性细胞的表达与比较Fig 2 Expression of TH positive cells in the left substantia nigra of the rat in each group(×200)
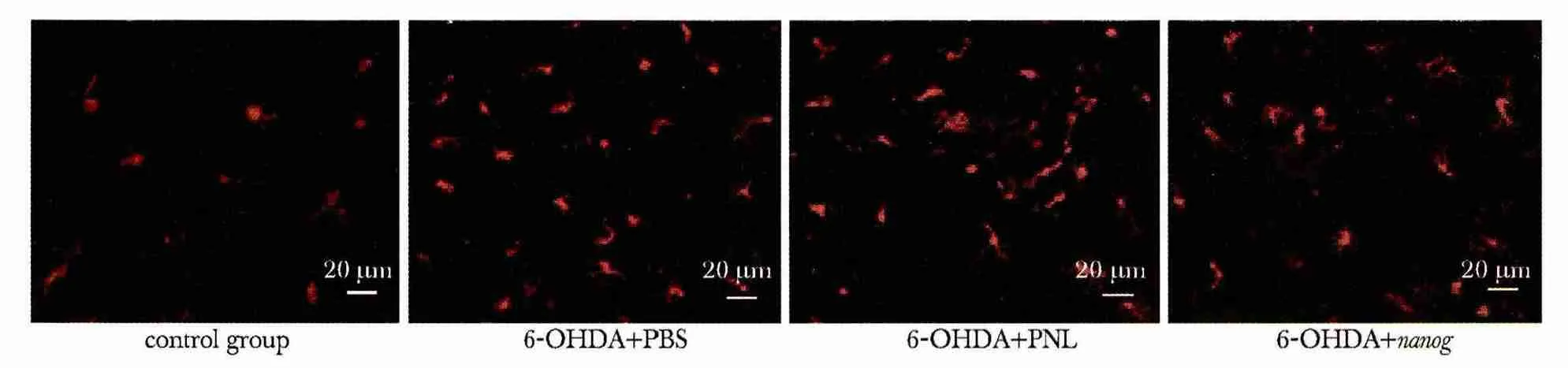
图3 各组大鼠注射侧脑组织黑质区小胶质细胞的观察与比较Fig 3 Observation and comparison of microglial cells in the left substantia nigra of the rat brain in each group(×200)
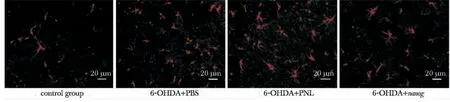
图4 各组大鼠注射侧脑组织黑质区TNF-α 阳性细胞的表达与比较Fig 4 Expression of TNF-α positive cells in the the left substantia nigra of the rat brain in each group(×200)
3 讨论
关于帕金森病发病机制的研究多集中于对多巴胺能神经元损伤的关注,近年来研究报道小胶质细胞的激活也参与了多巴胺能神经元的变性损伤过程[9]。小胶质细胞对外界环境刺激非常敏感,当中枢神经系统受损或发生炎性反应,甚至中枢神经系统微环境的轻微失衡,都可引起小胶质细胞激活,而激活的小胶质细胞可上调一些细胞因子,如TNF-α、白介素-1 等的分泌水平,同时还产生大量自由基,如过氧化物、喹啉酸、类花生酸类和一氧化氮,这些因子在介导多巴胺能神经元损害中均发挥关键作用[1-3,10]。TNF-α 属于一种前炎性因子,具有多效促炎性反应,在帕金森病发病中可启动并维持炎性反应损伤过程。在帕金森病患者脑内黑质纹状体系统和脑脊液中可检测到TNF-α 表达升高[11-12]。TNF-α 在中枢神经系统内主要由小胶质细胞和星形胶质细胞产生,可诱导神经元主要组织相容性抗原Ⅰ(major histocompatibility complex Ⅰ,MHCⅠ)表达上调,使之容易受到MHCⅠ限制性细胞毒性T 细胞的攻击。前期研究工作观察发现,6-OHDA 诱导的大鼠帕金森病模型存在炎性细胞因子的异常升高,炎性因子TNF-α、IL-6 参与了多巴胺能神经元损伤过程[7]。本实验进一步观测发现,6-OHDA 注射后14 d 大鼠注射侧中脑黑质区多巴胺能神经元明显减少,而小胶质细胞数目增多,且形态发生改变,同时存在TNF-α 表达增高,提示小胶质细胞激活可能介导并参与了损伤多巴胺能神经元的炎性反应过程。本实验证实在帕金森病的发病过程中,小胶质细胞及其激活后产生的炎性细胞因子对黑质多巴胺能神经元有不良反应,为炎性反应参与帕金森病的发病提供了实验依据,但至于这种激活改变与多巴胺能神经元之间相互作用的机制如何,还有待于更进一步深入研究。
假设如果能抑制小胶质细胞的激活,阻断其后续介导的炎性反应过程,可能为帕金森病的治疗提供新思路。Nanog 是一个独特的同源异型框转录因子,其表达仅限于多能性干细胞,在已分化的细胞中其表达则被抑制[13]。有学者在胚胎干细胞分化研究中发现,nanog 通过与NF-κB 蛋白结合抑制NF-κB 的转录活性和促分化能力,维持了胚胎干细胞的多能性[4]。Nanog 基因存在于人与动物的基因组中,在发育的后期处于沉默状态,如果在疾病的情况下,活化该基因有可能获益。转nanog 基因可能通过下调炎性因子来抑制炎性反应过程。前期工作已构建了携带nanog 基因的慢病毒载体,并证实nanog 能抑制脂多糖诱导的大鼠小胶质细胞中NF-κB 的转录[6]。在此基础上,本实验制备帕金森病大鼠模型,植入已带有nanog 基因的慢病毒载体来观察转nanog 基因的表达对小胶质细胞的激活及其后续介导的炎性反应是否有抑制作用。实验结果显示,注射6-OHDA 后第14 天,6-OHDA +nanog 组注射侧黑质区中小胶质细胞数目及TNF-α的表达低于6-OHDA+PNL 与6-OHDA+PBS 组,而且其黑质中存活的多巴胺能神经元较多,APO 诱发的大鼠向健侧旋转次数减少,这与一些研究报道的黑质纹状体多巴胺能神经元的损毁程度与APO 诱发大鼠向健侧的旋转圈数呈正相关相一致[14],提示6-OHDA 诱导的帕金森病大鼠经转nanog 基因后黑质多巴胺能神经元损毁程度较轻,这种减轻有可能源于nanog 对小胶质细胞激活及其后续介导的炎性反应过程的抑制。
[1]Qian L,Flood PM,Hong JS.Neuroinflammation is a key player in parkinson's disease and a prime target for therapy[J].J Neural Transm,2010,117:971-979.
[2]More SV,Kumar H,Kim IS,et al.Cellular and molecular mediators of neuroinflammation in the pathogenesis of Parkinson's disease[J].Mediators Inflamm,2013,2013:952375.doi:10.1155/2013/952375.Epub 2013 Jun 27.
[3]Su X,Federoff HJ.Immune responses in Parkinson's disease:interplay between central and peripheral immune systems[J].Biomed Res Int,2014,2014:275178.doi:10.1155/2014/ 275178.
[4]Torres J,Watt FM.Nanog maintains pluripotency of mouse embryonic stem cells by inhibiting NFkappaB and cooperating with Stat3[J].Nat Cell Biol,2008,10:194-201.
[5]黄志新,张志坚,张阳,等.过表达Nanog 基因的小鼠骨髓间质干细胞对NF-κB 表达的影响[J].生物工程学报,2010,26:671-678.
[6]Zhou H,Chen S,Wang W,et al.Nanog inhibits lipopolysaccharide-induced expressionof pro-inflammatory cytokines by blocking NF-κB transcriptional activity in rat primary microglial cells[J].Mol Med Report,2012,5:842-846.
[7]冯飞阳,陈施艳,张志坚,等.TNF-α、IL-6 在6-OHDA诱导帕金森病大鼠脑中的改变[J].福建医科大学学报.2012,46:315-318.
[8]Thomas J,Wang J,Takubo H,et al.A 6-hydroxydopamine-induced selective parkinsonian rat model:further biochemical behavioral characterization[J].Exp Neurol,1994,126:159-167.
[9]Block ML,Hong JS.Chronic microglia activation and progressive dopaminergic neurotoxicity[J].Biochem Soc Trans,2007,35:1127-1132.
[10]Graeber MB,Streit WJ.Microglia:biology and pathology[J].Acta Neuropathol,2010,119:89-105.
[11]Sharifi H,Mohajjel Nayebi A,Farajnia S.8-OH-DPAT(5-HT1A agonist) attenuates 6-Hydroxy-dopamine-induced catalepsy and modulates inflammatory cytokines in rats[J].Iran J Basic Med Sci,2013,16:1270-1275.
[12]Machado-Filho JA,Correia AO,Montenegro AB,et al.Caffeine neuroprotective effects on 6-OHDA-lesioned rats are mediated by several factors,including pro-inflammatory cytokines and histone deacetylase inhibitions[J].Behav Brain Res,2014,264:116-125.
[13]Wang Z,Oron E,Nelson B,et al.Distinct lineage specification roles for NANOG,OCT4,and SOX2 in human embryonic stem cells[J].Cell Stem Cell,2012,10:440-454.
[14]Blandini F,Levandis G,Bazzini E,et al.Time-course of nigrostriatal damage,basal ganglia metabolic changes and behavioral alterations following instriatal injection of 6-OHDA in the rat:new clues from an old model[J].Eur J Neurosci,2007,25:397-405.

