清热解毒方与益生菌联合治疗大鼠脓毒症
高巧营,刘大全,吴尚为,李东华,刘洪斌
实验研究
清热解毒方与益生菌联合治疗大鼠脓毒症
高巧营,刘大全,吴尚为,李东华,刘洪斌
目的:观察清热解毒方和益生菌联合治疗脓毒症模型大鼠的作用。方法:采用盲肠结扎穿孔法制作大鼠脓毒症模型,健康Wistar大鼠140只随机分为假手术组、脓毒症模型组、抗生素组、益生菌组、清热解毒方中药组及清热解毒方和益生菌联合治疗组,对大鼠腹水和血标本进行细菌培养鉴定及实时定量PCR检测。结果:与假手术组比较,脓毒症模型组大鼠腹水和血液中细菌检出率明显升高(P<0.05),其腹水中大肠杆菌检出率100%、金黄色葡萄球菌检出率63.6%,血液中大肠杆菌检出率94.7%、金黄色葡萄球菌检出率21.1%。与模型组比较,单纯中药组和单纯益生菌组治疗后细菌检出率和数量均有所降低(P<0.05)。与单纯用药组比较,联合治疗组上述细菌检出率和数量进一步降低(均P<0.05)。结论:脓毒症模型大鼠主要致病菌为大肠杆菌和金黄色葡萄球菌,清热解毒方和益生菌联合使用可协同抑制其主要致病菌。
脓毒症;清热解毒方;益生菌;致病菌;大鼠
脓毒症是感染引起的一种严重的全身炎症反应综合征,中医药已成为了治疗脓毒症不可或缺的手段[1]。益生菌可以治疗抗生素相关性腹泻、炎症性肠病、新生儿坏死性小肠结肠炎、肠易激综合征、女性泌尿生殖道感染等[2-3]。本研究采用传统细菌培养法和分子生物学方法相结合,分析中药清热解毒方与益生菌联用对脓毒症大鼠主要致病菌的抑制作用,阐述两者治疗脓毒症的协同作用。
1 材料与方法
1.1 动物 健康雄性Wistar大鼠140只,体质量240~260 g,由军事医学科学院环境所动物中心提供,动物许可证号SCXK(军)2009-003。
1.2 主要试剂与仪器 细菌基因组DNA提取试剂盒(QIAGEN,美国),荧光定量PCR试剂盒(北京天根生化科技有限公司),细菌培养皿(天津金章科技发展有限公司),厌氧培养皿(BioMerieux公司,法国),Microstation快速微生物鉴定系统(Biolog公司,美国),IQ5型荧光定量PCR仪(BIO-RAD,美国)。
1.3 药物 清热解毒方由大黄、黄芩、白头翁等组成,其流浸膏按文献[2]方法制备。金双歧三联活菌片(长双岐杆菌1×107CFU/g,保加利亚乳杆菌1× 106CFU/g,嗜热链球菌1×106CFU/g,内蒙古双奇药业)、头孢丙烯分散片(广州白云山制药)、甲硝唑(天津太平洋制药)。
1.4 分组 据前期研究[1]模型大鼠的死亡率和中药有效剂量,将Wistar大鼠140只随机分为假手术组(10只)、模型组(50只)、抗生素组(20只)、益生菌组(20只)、清热解毒方中药组(20只)、清热解毒方和益生菌联合治疗组(20只)。
1.5 造模 实验前大鼠12 h禁食、不限水,术前以10%水合氯醛腹腔注射麻醉。无菌条件下开腹,分离盲肠,距其末端2 cm处以1号丝线结扎,再用12号针头在盲肠末端穿孔,将盲肠放回腹腔后逐层关腹。假手术组大鼠只暴露盲肠,不进行结扎、穿孔。以下治疗药物剂量均依据临床患者用药剂量与大鼠等效剂量的折算剂量换算所得[4]。各组药物均用生理盐水稀释,灌胃量为8 mL/kg。抗生素组大鼠给头孢丙烯、甲硝唑片灌胃(头孢丙烯分散片50 mg/kg,甲硝唑片120 mg/kg)。益生菌组大鼠给三联活菌片灌胃(400 mg/kg)。中药组大鼠给清热解毒方流浸膏灌胃(生药24 g/kg)。联合治疗组大鼠给三联活菌片与清热解毒方流浸膏灌胃。4个治疗组均1次/d,连续3 d用药。假手术组和模型组大鼠给予等体积盐水灌胃。
1.6 标本采集 造模72 h各组动物在无菌条件下麻醉、开腹,采集腹水和血标本进行细菌培养。另取一份标本-80℃冰箱保存。
1.7 细菌培养 以20μL腹水作为原液(假手术组大鼠无腹水,采用2 mL生理盐水灌注腹腔),用无菌生理盐水进行10倍倍比稀释,分别取20μL各浓度细菌稀释液用L棒涂布接种于血琼脂培养皿、麦康凯琼脂培养皿、苯乙醇琼脂培养皿、普通厌氧菌培养皿。血琼脂培养皿用于总需氧菌计数。麦康凯琼脂培养皿可选择性培养革兰阴性菌,苯乙醇琼脂培养皿可选择性培养革兰阳性菌,两者用于需氧菌分纯鉴定。普通厌氧菌培养皿培养厌氧菌。厌氧培养皿放置于厌氧培养袋中,与需氧培养皿一同置于37℃培养箱内,培养时间见表1。结束后选择适当稀释度培养皿上生长的菌落(以培养皿上50~100个菌落为宜)进行计数、革兰染色、镜检、纯化、耐氧试验,进而得到纯化的需氧菌和厌氧菌。血液标本则无需稀释直接培养。将纯化菌接种于鉴定标准液中制备成菌悬液,取100μL接种于鉴定板上培养一定时间后,采用Microstation快速微生物鉴定系统检测,鉴定菌种。

表1 细菌培养方法与时间
1.8 细菌定量 每毫升腹水的细菌数(CFU/mL)=菌落数×10n×50(10n-与菌落数相对应的稀释度)。
1.9 实时定量PCR 取准确定量的标准菌株作为标准品做系列稀释,使其细菌浓度为104~108CFU/mL。应用DNA提取试剂盒提取腹水标本和标准品细菌基因组DNA。针对细菌16S rRNA序列设计特异性引物:大肠埃希菌:5'-CATGCCGCGTGTATGAAGAA -3',5'-CGGGTAACGTCAATGAGCAAA-3';金黄色葡萄球菌:5'-CGTCAGCTCGTGTCGTGAGATGTTG-3',5'-GCGGTTTCGCTACCCTTTGTATTGT-3'。扩增片段分别为95 bp和204 bp。具体实验方法参照文献[5]。将待测腹水标本的PCR结果和标准菌株曲线进行比较,即可获得该标本中上述两种细菌的具体数量。
2.0 统计学处理 采用SPSS 17.0软件,计量资料以(±s)表示,组间比较采用方差分析;计数资料两组间比较采用χ2检验,P<0.05为有统计学意义。
2 结果
2.1 死亡率 造模后72 h模型组大鼠死亡率56%,其治疗组死亡率均为10%(P<0.05),各治疗组比较无统计学差异。见表2。
2.2 腹水细菌培养 假手术组大鼠10只全部存活,腹腔无细菌生长。模型组大鼠腹腔内均有淡黄色或淡粉色混浊半透明状的腹水;各治疗组大鼠腹水量较模型组少,腹水性状也较为清亮。模型组和各治疗组细菌检出阳性率均100%,但检出的细菌菌种有所不同。见表3。
2.3 血液细菌培养 血标本均未培养出厌氧菌,需氧优势菌为大肠杆菌和金黄色葡萄球菌。模型组细菌阳性率最高,治疗组大鼠血培养阳性率明显降低(P<0.05)。见表4。中药组细菌检出阳性率为12.5%,与抗生素组无差异。联合组未培养出细菌。2.4 腹水细菌定量检测 将细菌总数计数为Log10N(N为细菌总数)。模型组腹水细菌计数约108CFU/mL;联合组约10 CFU/mL左右,其他3个治疗组约为103~104CFU/mL。应用实时定量PCR法检测大肠杆菌和金黄色葡萄球菌两种优势细菌,见表5。与模型组相比,治疗组大鼠腹水大肠杆菌、金黄色葡萄球菌的数量均明显减少(P<0.05),联合组尤为突出。
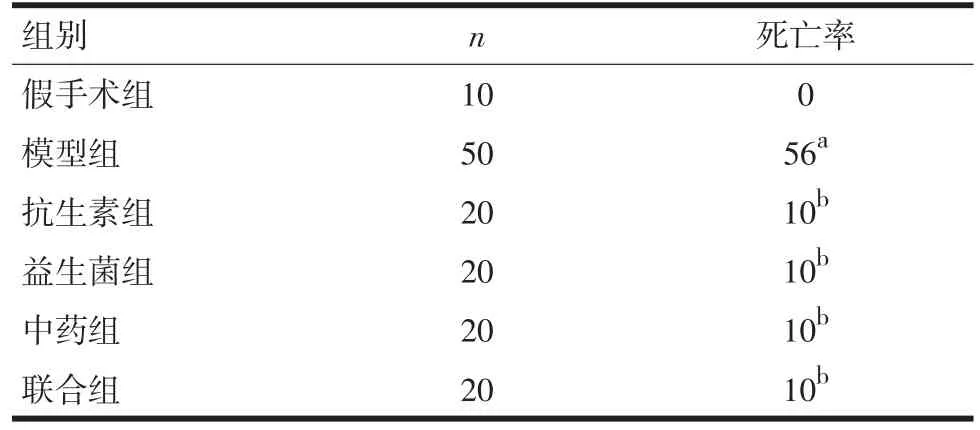
表2 大鼠死亡率比较(n,%)

表3 大鼠腹水中细菌的阳性率及主要菌群类别(n,%)

表4 大鼠血液中需养菌的阳性率及主要菌群类别(n,%)
表5 大鼠腹水中细菌数量比较(Log10N/mL腹水,±s)

表5 大鼠腹水中细菌数量比较(Log10N/mL腹水,±s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与益生菌组比较,cP<0.05;与中药组比较,dP<0.05;与抗生素组比较,eP<0.05
组别假手术组模型组抗生素组益生菌组中药组联合组需氧菌总数0 8.73±0.46a4.08±0.60b4.63±0.49b3.25±0.52b1.22±0.41b、c、d、e大肠杆菌0 8.60±0.83a2.78±0.34b3.93±0.73b2.76±0.64b1.02±0.24b、c、d、e金黄色葡萄球菌0 5.39±1.21a0b 2.80±0.75b3.07±0.69b0.73±0.23b、c、d
3 讨论
大鼠的CLP脓毒症模型是被广泛应用的脓毒症动物模型之一,造模后肠道中细菌扩散进入腹腔大量繁殖,引起严重的腹膜炎和脓毒症表现[6-7]。已有相关研究表明,肠道菌群在脓毒症的发病机制中占有相当重要的地位[8]。本研究证实,大量的大肠杆菌和金黄色葡萄球菌在脓毒症大鼠腹水和血液中检出,是此脓毒症模型的主要致病菌。以上两种菌均属条件致病菌,可存在于正常肠道中,但数量与其他菌群保持动态平衡,当平衡被打破后,它会进入腹腔甚至血液大量繁殖,引起脓毒症等。
清热解毒类、活血化瘀类和扶正固本类是临床上常用的治疗脓毒症中药复方。清热解毒方由大黄、黄芩、白头翁等组成,临床用于治疗化脓性阑尾炎、阑尾脓肿及其他腹腔感染者。在本研究过程中,我们发现,脓毒症大鼠在给予清热解毒方治疗后,出现了不同程度的腹泻症状,但大鼠的病死率、腹水及血标本细菌阳性率及数量有所降低。可见清热解毒方具有一定的抗菌抑菌作用,并可抑制细菌移位。该方对细菌的效应可能与该方4个组分可协同抗菌,大黄发挥泻下作用,促进了肠内细菌等有害物质的排出,细菌、内毒素等有害物质的吸收入血明显减少有关。
益生剂作为对宿主健康产生有益的活的微生物制剂[9],在肠道中发挥重要的生理作用。益生菌治疗疾病的机制主要包括维持机体微生态稳定、减少肠源性内毒素吸收、产生有机酸、游离脂肪酸、氨和过氧化氢等物质等。如双歧杆菌及其表面分子能提高NK细胞和巨噬细胞活性,其代谢活性物质可形成化学屏障以阻止致病菌侵入和繁殖,提高局部或全身的抗感染能力[10]。本研究使用双歧杆菌、乳杆菌和嗜热链球菌的三联制剂治疗脓毒症,有效降低脓毒症大鼠死亡率和血培养阳性率,明显抑制了腹水中致病菌大肠杆菌和金黄色葡萄球菌的大量繁殖,为脓毒症大鼠提供了保护作用。
本研究应用传统培养法和实时定量PCR结合,分析清热解毒方和益生菌联合治疗脓毒症大鼠标本细菌阳性率及数量。联合治疗后,大鼠腹水中主要致病菌数量明显下降,且血标本中未检出细菌,较单独使用清热解毒方或益生菌疗效更好。我们推断,益生菌保护肠道屏障减少致病菌的侵入为辅,增强了清热解毒方的泻下作用和直接抑菌灭菌作用,两者联用治疗脓毒症有协同作用,但具体的协同机制有待进一步研究。
[1]刘洪斌,吴咸中,李东华,等.清热解毒方对脓毒症大鼠的治疗作用[J].中国中西医结合外科杂志,2008,14(6):580-584.
[2]Rossi M,Amaretti A,and Raimondi S.Folate production by probiotic bacteria[J].Nutrients,2011,3(1):118-134.
[3]Williams NT.Probiotics[J].Am J Health Syst Pharm,2010,67(6):449-458.
[4]徐叔云,卞如濂,陈修,等.药理实验方法学[M].第3版.人民卫生出版社,2002:203.
[5]刘大全,李东华,刘洪斌,等.脓毒症大鼠肠道及腹水中菌群变化研究[J].中国实验诊断学杂志,2011,15(5):812-815.
[6]Buras J A,Holzmann B,Sitkovsky M.Animal models of sepsis:setting the stage[J].Nat Rev Drug Discov,2005,4(10):854-865.
[7]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc, 2009,4(1):31-36.
[8]Clark JA,Coopersmith CM.Intestinal crosstalk:a new paradigm for understanding the gut as the"motor"of critical illnes[J]. Shock,2007,28(4):384-393.
[9]Schrezenmeir J,de Vrese M.Probiotics,prebiotics,and synbiotics--approaching a definition[J].Am J Clin Nutr,2001,73(2 Suppl):361-364.
[10]Ohland CL,Macnaughton WK.Probiotic bacteria and intestinal epithelial barrier function[J].Am J Physiol Gastrointest Liver Physiol,2010,298(6):807-819.
(收稿:2013-10-16 修回:2014-03-10)
(责任编辑 王 丰)
Qing Re Jie Du(清热解毒)Prescription Combined Probiotics in Suppressing Main Pathogens to Treat Sepsis
GAO Qiao-ying,LIU Da-quan,WU Shang-wei,et al. Tianjin Institute of Acute Abdominal Diseases,Tianjin(300100),China
Objective To detect the main pathogens in septic model of rats and find the synergism between Qing Re Jie Du(清热解毒)Prescription and Probiotics.MethodsThe septic model was induced by cecal ligation and puncture.One hundred and forty healthy Wistar rats were randomly divided into six groups:control group,septic model group,antibiotic treated group,Probiotics treated group,Qing Re Jie Du(清热解毒)Prescription treated group and Qing Re Jie Du(清热解毒)Prescription-Probiotics group.Bacterial populations in ascites and blood were determined by bacterial culture and real time PCR.ResultsThe bacterial numbers in model group were significantly increased compared with control data.Detection rates of Escherichia coli and Staphylococcus aureus from ascites were 100%and 63.6%respectively,meanwhile the rates of Escherichia coli and Staphylococcus aureus from blood were 94.7%and 21.1%.The detection rates and bacterial numbers in Qing Re Jie Du(清热解毒)Prescription treated group and Probiotics treated group were decreased compared with those in septic model group.Rates and numbers in Qing Re Jie Du(清热解毒)Prescription-Probiotics group were lower than those in Qing Re Jie Du(清热解毒)Prescription treated group or Probiotics treated group.ConclusionEscherichia coli and Staphylococcus aureus may be primary pathogens of septic rats in our study.Qing Re Jie Du(清热解毒)Prescription-Probiotics treated group synergizes in the treatment of sepsis.
Sepsis;Qing Re Jie Du(清热解毒)prescription;probiotics;pathogen;rat
Q95-33;R631
A
1007-6948(2014)02-0160-04
10.3969/j.issn.1007-6948.2014.02.017
天津市中医药管理局中医、中西医科研项目(11020)
天津市南开医院中西医结合急腹症研究所(天津300100)
吴尚为,E-mail:shangweiwu10021@yahoo.com

