兔门静脉种植VX2癌栓CT灌注参数与血管内皮生长因子的相关性
魏 强 WEI Qiang
雷 振 LEI Zhen
冯国全 FENG Guoquan
杨 旭 YANG Xu
兔门静脉种植VX2癌栓CT灌注参数与血管内皮生长因子的相关性
魏 强 WEI Qiang
雷 振 LEI Zhen
冯国全 FENG Guoquan
杨 旭 YANG Xu
目的建立兔VX2肿瘤模型,采用多层螺旋CT(MSCT)灌注成像技术探讨兔门静脉VX2种植癌栓灌注参数与血管内皮生长因子(VEGF)表达的相关性。材料与方法8只实验兔经门静脉内接种VX2肿瘤,成瘤后行MSCT灌注扫描,测量并比较门静脉癌栓、近瘤灶和远离瘤灶肝脏的肝血流灌注量(HBF)、肝血容积(HBV)、毛细血管表面通透性(PS)及平均通过时间(MTT);摘取门静脉移植VX2癌栓,采用免疫组化检测癌栓组织VEGF表达,分析肝脏灌注参数与VEGF的相关性。结果近瘤灶和远离瘤灶肝脏各CT灌注参数间差异无统计学意义(P>0.05);门静脉癌栓区HBF、HBV及PS均较近瘤灶区和远离瘤灶区增高(P<0.05),MTT较近瘤灶区和远离瘤灶区降低(P<0.05)。门静脉VX2种植癌栓区HBF、HBV、PS与VEGF表达均呈正相关(r=0.711、0.646、0.626, P<0.05),MTT与VEGF表达呈负相关(r=-0.565, P<0.05)。结论兔门静脉VX2种植癌栓 MSCT灌注参数与VEGF表达具有相关性,MSCT能够评价门静脉种植VX2癌栓的血管生成。
肝肿瘤,实验性;VX2肿瘤;门静脉;体层摄影术,螺旋计算机;灌注成像;血流动力学;血管内皮生长因子类;疾病模型,动物;兔
原发性肝细胞癌伴门静脉癌栓形成可导致肝内外播散和门静脉高压[1]。癌栓内的微血管生成是癌栓生长、浸润和转移的一个重要因素。血管内皮生长因子(vascular endothelial growth factor, VEGF)是最有效的促血管生长因子,癌细胞的生长及转移依赖新生血管的形成[2,3]。免疫组化检测VEGF可以评价肿瘤血管生成,但其结果滞后,且为有创性检查;超声、MRI、 CT等均不能在肿瘤发生形态学改变之前检测到其功能变化。目前,肝癌患者门静脉癌栓的多层螺旋CT(MSCT)灌注参数与其VEGF表达相关性的临床及动物实验研究鲜有报道,建立肝癌伴门静脉癌栓的动物模型,是研究癌栓的病理机制和临床治疗的实验基础。本研究拟通过对兔门静脉VX2种植瘤行MSCT灌注成像,分析门静脉癌栓新生血管CT灌注参数的变化及其与VEGF表达的相关性,为肝癌患者门静脉癌栓的临床研究提供依据。
1 材料与方法
1.1 实验动物 日本大耳白兔9只,由辽宁医学院实验动物中心提供(合格证号SCXK辽2009-0004),雌雄不限,体重2.5~3.0 kg。实验兔于兔笼中饲养,给予植物性能量颗粒饲料及清洁饮水。本实验研究经辽宁医学院伦理委员会审核批准。
1.2 VX2瘤株的制备 将VX2瘤株冻存块解冻复苏,制备瘤细胞悬液。取1只用于传代肿瘤接种,接种于兔后肢内侧肌肉内,使之成瘤。约15 d后接种处可扪及一实质性包块。将兔全麻后于无菌条件下剥离肿瘤,切取包块边缘生长旺盛的鱼肉样组织,剔除坏死组织及纤维组织,将瘤组织剪切至大小约1.2 mm×1.2 mm×5.0 mm的小块瘤条,用生理盐水反复冲洗,置于盛有20 ml RPMI 1640培养液的玻璃皿中。采用1 ml注射器连接14 G针头抽取已经准备好的瘤株备用。
1.3 兔门静脉种植VX2癌栓模型制作 选取8只实验兔,经盐酸赛拉嗪注射液0.1 ml/kg全麻后,常规消毒,于上腹部剑突下作一长约5.0 cm切口,进入腹腔寻找到肠系膜上静脉,用准备好的注射器将肿瘤株快速注入肠系膜上静脉内,拔针后即用明胶海绵条按压穿刺处约1 min,充分止血后将肝脏回纳至腹腔,以生理盐水冲洗后在腹腔内喷撒白霉素,逐层缝合关闭腹腔,术后经耳缘静脉滴注白霉素0.1 g,1次/d,连续滴注3 d。
1.4 MSCT检查 瘤株接种2周后,8只荷瘤兔采用GE LightSpeed 16层CT机进行增强扫描,证实门静脉癌栓形成,并将造模成功的实验兔行MSCT灌注扫描。实验兔先行CT平扫,扫描参数:电压80 kV,电流120 mAs,矩阵512×512,视野12~16 cm,层厚2.5 mm。观察癌栓生长情况,选取癌栓最大层面的相邻4层为灌注层面。缓慢推注氯化琥珀胆碱1 mg/kg,待呼吸抑制时,采用MSCT的多层同层 动 态CT灌 注 扫 描(“Toggling table” 技 术 )进行4层同层灌注扫描。同时采用高压注射器经耳缘静脉注射对比剂碘海醇(350 mgI/ml)1.0 ml/kg,注射速度0.5 ml/s,延迟5 s开始CT灌注扫描,采用电影模式采集图像,扫描50 s;灌注扫描参数:层厚5 mm/4i,重建层厚1.0 mm/2i,4排探测器连续扫描,机架旋转1周床移3.75 mm,螺距比1.375,扫描架无倾斜,管电压80 kV,管电流130 mAs,矩阵512×512,视野12~16 cm。
数据传至ADW 4.2工作站,采用GE Perfusion 3中的体部肿瘤灌注软件进行数据处理,以腹主动脉为输入动脉,门静脉主干或分支为输入静脉,经计算机处理生成时间-密度曲线(TDC)。每一层面选取3~5个感兴趣区(ROI),每个ROI大小3~5 mm2,每只实验兔至少测量2个层面,测量门静脉种植癌栓区的灌注参数,包括肝血流灌注量(hepatic blood fow, HBF)、肝血容积(hepatic blood volume, HBV)、毛细血管表面通透性(probability of surface area product, PS)及平均通过时间(mean transit time, MTT)。
1.5 免疫组化检查 扫描结束后,实验兔于全麻下摘取门静脉移植VX2瘤栓。瘤组织经10%甲醛溶液固定,常规石蜡包埋,5 µm连续切片,行HE染色,并采用SP法测定VEGF表达。
1.6 VEGF表达判断标准 采用半定量积分法[4],按照染色强度及阳性细胞数占肿瘤细胞总数的百分比综合积分。参照刘佩芳等[5]和李杰等[6]的半定量方法,于400倍光镜下观察,肿瘤细胞胞质中见着色深浅不一的棕色或棕黄色颗粒即为VEGF表达阳性细胞,每张切片随机选取有VEGF表达的5个视野判断VEGF的表达程度,先根据染色强度打分:0分,无色;1分,淡黄色;2分,棕黄色;3分,棕褐色。然后根据阳性细胞占肿瘤细胞总数的百分比打分:0分,无阳性细胞;1分,阳性细胞<10%;2分,阳性细胞10%~50%;3分,阳性细胞51%~70%;4分,阳性细胞>70%。以染色强度和阳性细胞百分比积分的乘积判断肿瘤细胞VEGF表达水平:0分,阴性;<3分,弱阳性;≥3分,强阳性。
1.7 统计学方法 采用SPSS 17.0软件,门静脉癌栓、近瘤灶肝脏、远离瘤灶肝脏HBF、HBV、MTT、PS比较采用成组t检验,门静脉癌栓区HBF、HBV、MTT、PS与VEGF表达的相关性采用Spearman等级相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 肿瘤接种情况 8只实验兔接种VX2瘤株,均成功制作VX2癌栓模型,肿瘤接种成活率达100%。8只实验兔于接种部位均有肿瘤生长,均纳入本实验。
2.2 增强CT及灌注扫描结果 8只实验兔完成MSCT灌注扫描,CT增强扫描示门静脉区充盈缺损(图1A),灌注扫描显示,与正常肝组织灌注参数不同,门静脉种植癌栓区及周围肝组织灌注参数呈“热区”(图1B~E),瘤区的HBF、HBV及PS均高于周围肝组织,使用灌注软件获得对比剂灌注后50 s内的TDC图(图1F),MTT降低表明兔门静脉VX2种植癌组织灌注参数高于周围肝组织。分别于实验兔门静脉癌栓区、近瘤灶和远离瘤灶肝脏组织进行灌注参数测量,取平均值作为最终结果。
2.3 兔门静脉种植VX2癌栓与正常肝组织CT灌注参数比较 门静脉癌栓区HBF、HBV及PS较近瘤灶区和远离瘤灶区增高,差异有统计学意义(P<0.05),MTT降低,差异有统计学意义(P<0.05);近瘤灶区与远离瘤灶区肝脏HBF、HBV、PS及MTT比较,差异无统计学意义(P>0.05)。见表1及图1B~E。

表1 门静脉癌栓区、近瘤灶区和远离瘤灶区肝脏CT灌注参数比较(n=8)
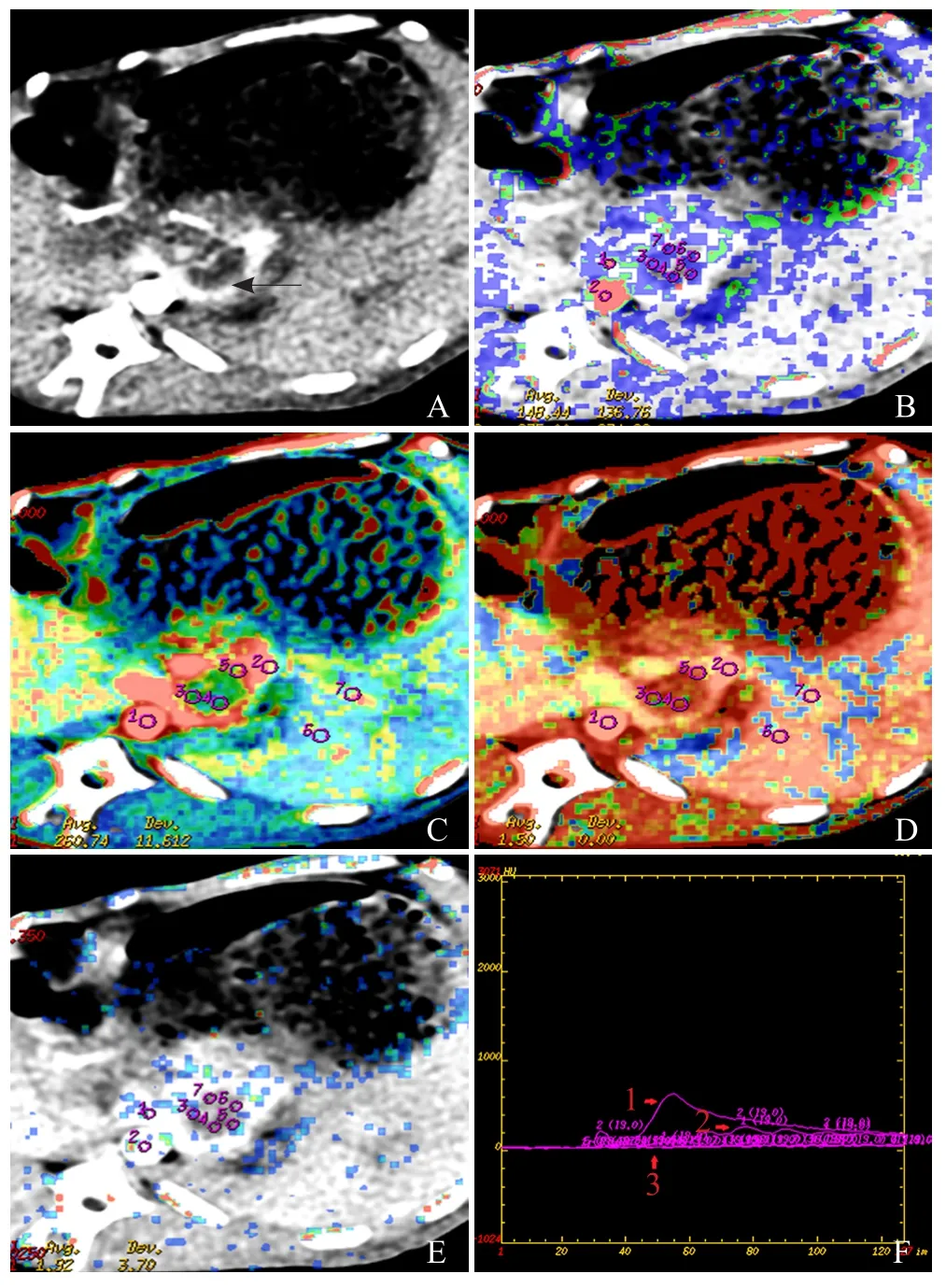
图1 CT增强扫描显示兔门静脉区充盈缺损(箭),证明癌栓形成,动物模型制作成功(A);灌注HBF图显示门静脉癌栓区血流状态(绿色)高于正常肝组织(蓝色,B);灌注HBV图显示门静脉癌栓区血流灌注状态(红色)高于正常肝组织(绿色,C);灌注MTT图显示门静脉癌栓区灌注MTT(红色)较肝组织(橙色)缩短(D);灌注PS图显示门静脉癌栓区渗透状态(绿色)高于正常肝组织(蓝色,E);TDC图显示腹主动脉TDC(1)、兔门静脉种植癌栓组织TDC(2)及远瘤灶肝组织TDC(3),2的峰值高于3,表明兔门静脉VX2种植癌栓组织灌注高于肝组织(F)
2.4 兔门静脉种植VX2癌栓的VEGF表达结果 VEGF阳性染色颗粒主要存在于肿瘤细胞胞质和包膜内(图2)。门静脉VX2种植组8只实验兔癌栓VEGF阳性表达积分分别为2分、6分、6分、8分、8分、9分、9分、12分,以门静脉VX2瘤栓种植组VEGF表达程度代表实验组VEGF表达程度。

图2 肿瘤组织VEGF表达。免疫组化染色示肿瘤细胞胞质内见棕褐色颗粒(箭),胞质较少,核大深染,异形性明显(SP法,×400)
2.5 兔门静脉种植VX2癌栓CT灌注参数与VEGF表达的相关性 兔门静脉种植VX2癌栓HBF、HBV及PS与癌栓的VEGF表达均呈正相关(r=0.711、0.646、0.626, P<0.05),而MTT与VEGF表达呈负相关(r=-0.565, P<0.05),见图3。
3 讨论
兔VX2种植瘤动物模型是目前能建立较大动物的可移植性肿瘤模型,VX2种植瘤株是一种由Shop病毒诱发的鳞状细胞癌肿瘤细胞株,可以接种到中、大型动物体内的肾脏、肝脏、肌肉等组织器官内,制作原位肿瘤动物模型[7],诱导时间短、成瘤率高、种植后组织学稳定,并有新的血管生成[8]。CT平扫及增强扫描与人体细胞原位癌CT表现相似[9],本实验采用肿瘤组织块直接移植的方法成功复制出兔门静脉VX2种植癌模型。在肿瘤移植后2~3周,即供瘤血管形成期,对肿瘤血管发生最活跃的部位重点进行灌注成像研究,对于灌注参数的变化能否用于反映肿瘤新生血管生成变化的研究更有意义,同时采用CT灌注成像的去卷积数学模型,该模型利用推动剩余函数计算对比剂静脉流出,对灌注的流入动脉和流出静脉进行综合考虑,计算HBF、HBV和MTT时不需要对潜存的脉管系统进行假设,与实际的血流动力学相近,计算出的灌注参数和函数图更能反映病变内部的实际情况[10]。

图3 兔门静脉种植VX2癌栓VEGF表达与HBF(A)、HBV(B)、MTT(C)、PS(D)的相关性
通过对常规CT增强图像与灌注参数图进行对比发现,灌注成像中所显示的瘤灶范围明显比CT增强扫描所显示的病灶范围大,增强图像显示正常的瘤灶周围肝组织在灌注图像中HBF、HBV、PS值明显增高,高于远离瘤灶肝组织各灌注参数,提示常规CT增强扫描显示正常的瘤灶周围肝组织多已被癌细胞所浸润,只是未出现形态学改变而很难在常规CT图像中呈现,而灌注图像显示的瘤灶边缘轮廓才是瘤灶周围浸润情况的真实体现,这对于临床制订合理有效的治疗方案及预后判断有重要的指导意义。
灌注图像中肿瘤周围区HBF及HBV显著增高,提示大量新生血管存在于肿瘤周围区域[10],PS增高表明肿瘤周围区新生的大量血管缺乏完整的基底膜,提示在VEGF的刺激下肿瘤组织新生出大量内皮发育不良的毛细血管,由于血管通透性高,造影剂容易由血管向周围组织间隙扩散,并在组织中存留。在CT增强扫描中,较高浓度的对比剂会增强组织强化程度,HBF、HBV、PS增高也同时反映了组织间隙滤过率会随对比剂浓度的增加而升高[11]。
MTT值降低,提示肿瘤组织内毛细血管表面通透性增加。本实验检测的兔门静脉VX2种植癌均已经生长2周,瘤体已进入血管生成旺盛期,肿瘤细胞通过自分泌和旁分泌方式过多地分泌VEGF等促血管生成因子[12],VEGF能诱导血管内皮细胞迁徙并不断分裂、增殖,使血管生成调控紊乱,形成大量的肿瘤血管[13,14],进而导致兔门静脉VX2种植癌栓组织的HBF及HBV较正常的肝组织高。由于恶性肿瘤微血管的内皮细胞是不完整的,基底膜被基质金属蛋白酶降解而不完整,部分毛细血管壁缺乏内皮细胞,血管内皮细胞之间连接松散,细胞间隙比较大,导致肿瘤组织内毛细血管表面通透性增加[15],当碘对比剂通过时容易引起对比剂外渗,为肿瘤血管的特点。本实验测得的兔门静脉VX2种植癌组织的PS高于正常肝组织,也正是由于肿瘤组织HBV和HPS增高而导致其MTT缩短。正常肝组织与非肿瘤区肝组织HBF、HBV、MTT、PS无明显差异,表明肝总血流量基本不受肝肿瘤的影响,整个肝脏保持着相对平衡的血供。
本次动物实验研究中门静脉种植癌栓的CT灌注参数HBF、HBV和PS值与VEGF阳性表达呈正相关,MTT值与VEGF阳性表达呈负相关。种植癌栓内部新生微血管的功能状态密切影响着种植癌栓的生长、浸润、转移及预后,血管内皮细胞通过分泌促血管生长因子(主要是VEGF)浓度上调即VEGF在兔VX2种植癌细胞质内的表达增高[13],使肿瘤周围原有的小血管内皮细胞被激活,经过分裂、增殖,以类似出芽的方式形成血管条索,再形成中空的小管,相互连接吻合形成毛细血管网,并与原有的血管相连通,逐渐分化小动脉和小静脉,建立起供应肿瘤细胞的血管网[14],这些新生血管的血管壁不完整,相邻血管内皮细胞间隙较大,因此其通透性较正常血管明显增加,肿瘤细胞容易进出血管,通过血管浸润周围组织并向远处播散,因此肿瘤的新生血管情况是评价肿瘤生长、浸润、转移及恶性程度的重要指标之一[15]。影像学检查不能直接观察到新生血管,但新生血管能引起灌注量、血容积、毛细血管通透性等的改变,MSCT灌注成像通过分析肿瘤内部的血管灌注特点,可以对单位肿瘤组织内的血容量、血流量和微血管通透性进行定量分析,从而间接反映肿瘤血管的功能状态[16]。
总之,兔门静脉VX2种植癌MSCT 灌注成像能够在活体评价种植癌栓新生血管的生成情况,并提供量化功能信息,将免疫组化检查和功能影像学方法相结合评价兔门静脉VX2种植癌模型的微血管生成,为肝癌患者门静脉癌栓的深入临床研究提供实验依据。MSCT灌注成像作为一种功能成像方式获得并分析门静脉癌栓灌注参数,可以间接反映门静脉癌栓的VEGF表达程度,对评价肿瘤内血管生成情况有一定的价值。然而CT灌注扫描对患者的电离辐射剂量较大,如何防护和控制辐射剂量尚需进一步研究。
[1] 孙伟, 李忱瑞, 周纯武. 原发性肝癌术后复发影响因素的临床分析. 中国医学影像技术, 2012, 28(6): 1148-1151.
[2] 李康, 吕富荣, 马千红, 等. 64层螺旋CT门静脉成像诊断门静脉海绵样变性. 中国医学影像技术, 2009, 25(6): 1050-1052.
[3] 王炳良, 乔乃春, 张名忠, 等. 原发性肝癌门脉癌栓螺旋CT双期扫描诊断价值. 临床肝胆病杂志, 2010, 26(1): 49-51.
[4] Kanematus M, Osada S, Amaoka N, et al. Expression of vascular endothelial growth factor in hepatocellular carcinoma and the surrounding live: correlation with angiographically assisted CT. Am J Roentgenol, 2004, 183(6): 1585-1593.
[5] 刘佩芳, 鲍润贤, 牛昀, 等. 乳腺良恶性病变动态增强MRI表现特征与血管生成相关性的初步研究. 中华放射学杂志, 2002, 36(11): 967-972.
[6] 李杰, 许良中. 非P-糖蛋白介导的多药耐药在乳腺癌中的研究. 肿瘤, 2000, 20(2): 143-145.
[7] 姚青, 陈江浩, 凌瑞, 等. 组织块悬液注射法制作兔VX2乳腺癌模型. 中国癌症杂志, 2004, 14(1): 22-23, 27.
[8] 李广琪, 陈毓秀, 康军, 等. 兔肝VX-2移植癌改良模型的建立. 武警医学院学报, 2007, 7(4): 369-372.
[9] 张洪新, 王执民, 王莉君, 等. 兔肝VX2移植癌模型的病理学和影像学表现. 实用放射学杂志, 2002, 18(7): 545-548.
[10] Bernstine H, Braun M, Yefremov N, et al. FDG PET/CT early dynamic blood fow and late standardized uptake value determination in hepatocellular carcinoma. Radiology, 2011, 260(2): 503-510.
[11] 戚跃勇, 邹利光, 王细文, 等. 原发性肝癌合并门静脉癌栓血液动力学变化的多层螺旋CT灌注成像研究. 肿瘤学杂志, 2007, 13(3): 204-207.
[12] Amaoka N, Saio M, Nonaka K, et al. Expression of vascular endothelial growth factor receptors is closely related to the histological grade of hepatocellular carcinoma. Oncol Rep, 2006, 16(1): 3-10.
[13] Kajdaniuk D, Marek B, Borgiel-Marek H, et al. Vascular endothelial growth factor (VEGF) - part 1: in physiology and pathophysiology. Endokrynol Pol, 2011, 62(5): 444-455.
[14] 梁斌, 肖恩华, 颜荣华, 等. 兔肝VX2瘤模型MR灌注成像与微血管密度及病理特征的对照研究. 实用放射学杂志, 2007, 23(2): 238-242, 255.
[15] 姜慧杰, 徐克, 张慧博, 等. 多层螺旋CT灌注成像活体评价肝VX2移植瘤新生血管生成. 中国医学影像技术, 2007, 23(7): 967-970.
[16] 王守安, 白人驹, 孙浩然, 等. 肝细胞癌的CT灌注成像及其在灌注参数图像上的表现. 实用放射学杂志, 2007, 23(12): 1630-1635.
(本文编辑 张春辉)
Relationship Between CT Perfusion Parameters and Vascular Endothelial Growth Factor Expression in Rabbits Portal Vein VX2 Implanting Tumor Emboli
PurposeTo establish rabbit VX2 tumor model and to explore the relation between perfusion parameters and the expression of the VEGF in the portal vein VX2 implanting tumor emboli.Materials and MethodsVX2 tumor was implanted in the portal vein of eight experimental rabbits. Multi-slice CT (MSCT) perfusion scan was performed after tumor formation to measure and compare portal vein tumor thrombus, hepatic blood fow (HBF) near tumor foci and far away from tumor foci, hepatic blood volume (HBV), probability of surface area product (PS) and mean transit time (MTT). The VX2 tumor emboli were then resected to analyze the relationship between the liver perfusion parameters and VEGF expression using immunohistochemical method.ResultsMSCT liver perfusion parameters were not statistically signifcant between foci close to or far away from the tumor (P>0.05). The HBF, HBV and PS within the tumor emboli were higher than that in hepatic parenchyma (P<0.05) and the MTT was higher (P<0.05). There was positive correlation (r=0.711, 0.646 and 0.626, P<0.05) between the HBF, HBV and PS of portal vein VX2 tumor emboli and VEGF expression, and there was negative correlation between MTT and VEGF expression (r=-0.565, P<0.05).ConclusionMSCT perfusion parameters in the portal vein VX2 implanting tumor emboli and the expression of VEGF are positively related. MSCT can evaluate the angiogenesis of portal vein VX2 implanting tumor emboli.
Liver neoplasms, experimental; VX2 neoplasms; Portal vein; Tomography, spiral computed; Perfusion imaging; Hemodynamics; Vascular endothelial growth factor; Disease models, animal; Rabbits
辽宁医学院附属第一医院放射科 辽宁锦州121001
雷 振
Department of Radiology, the First Affliated Hospital, Liaoning Medical College, Jinzhou 121001, China
Address Correspondence to: LEI Zhen
E-mail: 862759769@qq.com
R-33;R445.3
2014-03-03
:2014-07-19
中国医学影像学杂志
2014年 第22卷 第9期:650-654
Chinese Journal of Medical Imaging
2014 Volume 22(9): 650-654
10.3969/j.issn.1005-5185.2014.09.003

