兔急性心肌梗死模型的建立与心功能、病理演变的动态研究
龙湘党LONG Xiangdang
赵 康1ZHAO Kang
叶剑荣2YE Jianrong
喻 宏3YU Hong
蒲大容4PU Darong
兔急性心肌梗死模型的建立与心功能、病理演变的动态研究
龙湘党1LONG Xiangdang
赵 康1ZHAO Kang
叶剑荣2YE Jianrong
喻 宏3YU Hong
蒲大容4PU Darong
目的建立兔急性心肌梗死模型,并评估梗死后的心功能及病理动态变化。材料与方法35只新西兰大白兔采用开胸结扎冠状动脉左前降支(LAD)制作心肌梗死模型,术后1 d、1周、2周、4周、8周行超声心动图检查,同时抽取静脉血检测脑钠肽(BNP)浓度,并与术前及前一时间点比较。制作心肌病理切片,行HE染色并观察病理变化。结果制模总体死亡率为28.6%(10/35)。术后1周、2周、4周左心室舒张末期内径(LVEDD)、收缩末期内径(LVESD)均较术前和前一时间点增大(P<0.05)。术后1 d、1周、2周、4周左心室射血分数(LVEF)、短轴缩短率(LVFS)均较术前和前一时间点降低(P<0.05)。BNP术后1 d开始升高,1周达峰值,然后逐渐下降,至8周仍持续升高(P<0.01)。病理切片呈典型的心肌细胞变性、坏死、纤维化、钙化、瘢痕形成等动态变化。结论开胸结扎兔冠状动脉LAD是建立急性心肌梗死模型的有效方法;兔急性心肌梗死后心功能明显降低、BNP明显升高,其变化与病理演变密切相关。
心肌梗死;急性病;超声心动描记术,多普勒,彩色;心室功能;利钠肽,脑;病理学,外科;疾病模型,动物;兔
急性心肌梗死(acute myocardial infarction, AMI)是常见的心血管疾病,严重威胁着人类健康。AMI后将产生心脏大小、形态、组织结构及功能状态的改变,即心室重构,是心肌梗死发展为心力衰竭的重要病理生理过程,并贯穿于整个病程的始终,成为影响AMI近期及远期预后的主要原因之一。动物心肌梗死模型是研究AMI的病理生理机制、发生发展过程和探索新的治疗途径的基本环节。实验性心肌梗死的研究多侧重于制作AMI动物模型的方法学研究[1-4]以及对心肌梗死前后的心功能对比研究和病理学观察[2,3,5],对心肌梗死后心功能、生化指标及病理学演变的长期动态研究较少。本研究旨在通过结扎新西兰大白兔冠状动脉左前降支(LAD)建立心肌梗死模型,对兔AMI后心功能、脑钠肽(brain natriuretic peptide, BNP)及病理的动态演变规律进行研究并探讨它们的关系,以进一步加深对心肌梗死的了解,为心肌梗死的病理学及病理生理学研究打下基础,为临床治疗提供依据。
1 材料与方法
1.1 实验动物与模型建立 新西兰大白兔35只,雌雄不限,体重1.6~2.1 kg,由湖南省人民医院动物实验中心提供[许可证号syxk(湘)2010-0013]。大白兔经腹腔缓慢注射3%戊巴比妥钠1 ml/kg进行麻醉。实验兔仰卧位固定于手术台上,胸前区及上腹部备皮,保持自主呼吸,碘伏消毒,铺巾。于左侧胸壁第3~4肋间沿肋骨走行方向剪开皮肤及皮下组织,逐层切开斜行肌和竖行肌,钝性分离肋间肌,于胸骨左缘剪断第3~4肋软骨进入胸腔,保持胸膜完整,切开并悬吊心包,暴露心脏。于左心耳下缘及肺动脉圆锥间寻找心大静脉,并以此为标志在左心耳下缘5~10 mm处用6/0医用无创缝合线结扎LAD,观察结扎远端心肌变苍白,初步认为制模成功[1]。关闭胸腔,逐层缝合肌肉及皮肤。开胸手术时要小心操作,避免损伤血管及胸膜,以免术中发生大出血及气胸。术后连续5 d每天肌肉注射青霉素80万U抗感染,术后喂养8周。
1.2 超声心动图检查 所有实验动物于术前及术后1 d、1周、2周、4周、8周行超声心动图检查。应用ALOKA-ProSound α10彩色多普勒超声诊断仪,探头频率7.5~10.0 MHz,启动专用心脏程序进行常规超声心动图检查。于胸骨旁标准左心室长轴切面测量左心室舒张末期内径(left ventricular end diastolic diameter, LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter, LVESD);应用M型超声测量左心室射血分数(left ventricular ejection fraction, LVEF)和左心室短轴缩短率(left ventricular shortening fraction, LVFS)[6],每个指标至少测量3次,取平均值。
1.3 BNP检测 所有实验兔分别于术前及术后1 d、1周、2周、4周、8周抽取兔耳缘静脉血1 ml进行BNP检测,由长沙精维诚生物试剂公司提供专用兔BNP ELISA试剂盒,严格按使用说明测定BNP浓度。
1.4 病理学检查 抽血和超声检查结束后分别于术后1 d、1周、2周、4周、8周随机各取2只兔经耳缘静脉注射空气处死,迅速取出心脏,用预冷磷酸盐缓冲溶液冲洗,去除心房、大血管及周围结缔组织,仅留心室。取少许梗死组织和远离梗死部位的正常组织,固定于10%甲醛溶液中,石蜡包埋,HE染色,于光学显微镜下观察心肌组织的改变。
1.5 统计学方法 采用SPSS 13.0软件,配对资料比较采用配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 模型兔存活情况 35只大白兔手术过程中死亡6只,1只兔因心律失常、1只兔因失血过多、2只兔因大量气胸导致呼吸抑制死亡,2只兔结扎冠状动脉后猝死,推测因冠状动脉变异结扎了冠状动脉主干导致大面积心肌梗死急性心力衰竭死亡,病理检查支持该推断。术后1 d死亡2只,尸体解剖和病理检查发现大面积心肌梗死。术后2周死亡1只,尸体解剖发现伤口大量积脓,推测感染是其死亡原因。术后5周死亡1只,尸体解剖发现心脏明显增大,有心包积液,推测心力衰竭为其主要死因。25只兔存活并完成实验步骤,制模总体死亡率为28.6%(10/35)。
2.2 手术前后超声心动图测值及形态学比较 所有大白兔均获得胸骨旁左心室长轴切面,其中8只兔术后1 d检查时因肺气干扰及伤口影响,导致超声心动图显示欠佳,其中术后1 d、术后2周、术后5周各死亡1只,术后1 d、1周、4周各有1只被处死行病理学检查,2只喂养至8周。术后1 d出现节段性室壁运动减弱(图1),LVEF和LVFS较术前减低(t=16.5、22.3, P<0.05)。术后1周出现左心室内径增加(t=20.6、22.4, P<0.05),LVEF和LVFS较术后1 d减低(t=25.6、23.3, P<0.05),同时6只兔出现心包积液,8只出现心律失常。随着心肌梗死时间的推移,左心室逐渐扩大,心功能进一步降低,术后2周、4周左心室内径均较前一时间点增大(t=18.6、17.4、13.5、15.4, P<0.05),LVEF和LVFS较前一时间点降低(t=17.4、15.7、17.4、12.2, P<0.05),但术后8周与术后4周比较差异无统计学意义(P>0.05),见表1。术后4周左心室长轴切面显示左心室呈球形扩张,心尖圆钝(图2),3只兔室壁瘤形成。
2.3 BNP的动态变化 与术前比较,结扎后BNP浓度升高(t=20.8, P<0.01)。BNP术后1 d开始升高,1周达峰值,然后逐渐下降,至8周仍持续升高(t=20.7、27.9、19.2、30.8、8.0, P<0.01)。见图3。
2.4 术后病理演变特点 AMI兔光学显微镜下心肌病理表现如下:术后1 d:心肌细胞大部分变性,间质散在炎症细胞浸润;术后1周:心肌纤维凝固性坏死,心肌细胞变性,部分见核肥大、固缩,间质水肿,间质及梗死灶周围大量炎症细胞浸润,以中性粒细胞为主,有肉芽组织形成倾向(图4);术后2周:梗死后小片状纤维化,血管壁增厚,玻璃样变性;术后4周:梗死心肌中出现片状纤维化,脂肪细胞小片状增生,灶状钙化和瘢痕(图5);术后8周:梗死心肌出现机化,灶状钙化,瘢痕形成,伴有大片脂肪组织增生。
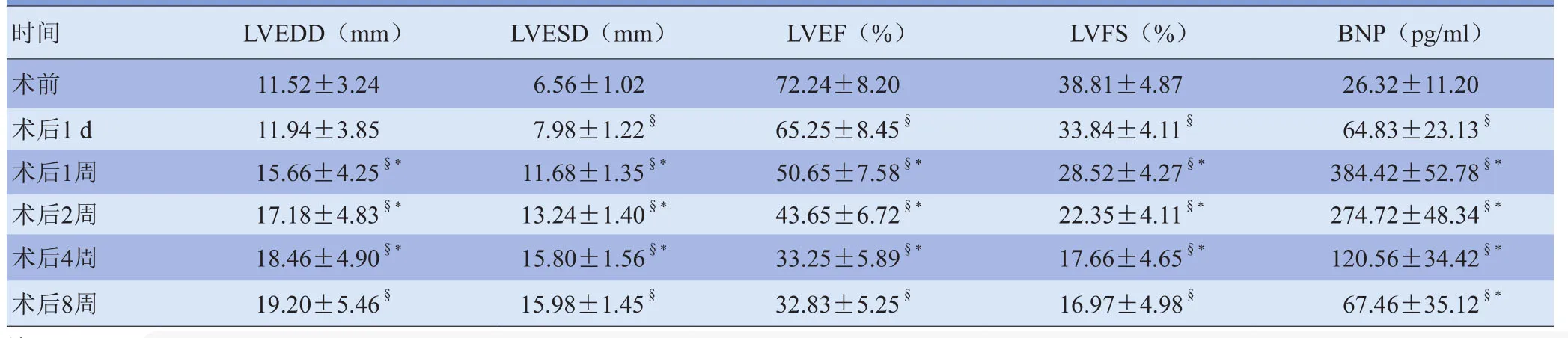
表1 兔手术前后常规超声心动图测值及BNP浓度比较(n=35)

图1 术后1 d M型超声心动图示室间隔中部运动减弱

图2 术后4周左心室扩张,心尖圆钝

图3 兔AMI后BNP各时间点动态变化

图4 术后1周心肌细胞凝固性坏死、变性,间质大量炎症细胞浸润(HE, ×400)
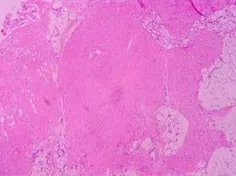
图5 术后4周梗死心肌呈片状纤维化,脂肪细胞呈小片状增生(HE, ×100)
3 讨论
动物心肌梗死模型对研究心肌梗死的病理生理和血流动力学有重要作用。新西兰大白兔心脏大小适宜,冠状动脉天然侧支循环较少(与人相似),阻断后发生致命的心律失常、死亡率低[7];而且兔具有双侧胸膜,可在非人工通气情况下进行开胸结扎手术,是复制心肌梗死模型的理想动物[1]。本研究经胸骨左缘切口开胸,保持胸膜腔完整,对呼吸和血流动力学影响较小;术中未使用气管插管,保持兔自主呼吸,避免了气管插管对呼吸道的损伤,因此操作较简便,死亡率较低。然而由于操作视野和空间的影响,仍有1只兔损伤了胸廓内血管引起大出血,2只兔损伤了胸膜引起大量气胸而死亡。此外,经胸手术切口导致8只兔术后1 d超声图像质量欠佳,影响了对心功能指标的精确测量。
本研究发现,兔AMI后左心室发生结构和功能改变,即左心室重构,病理学上也出现相应的变化,两者密切相关。冠状动脉结扎后1 d局部室壁可见节段性运动异常,梗死区域病理表现为心肌细胞大部分变性。心肌细胞对缺血非常敏感,结扎冠状动脉20~40 min即可形成不可逆的心肌坏死[8]。心肌细胞是左心室壁产生舒缩运动的基本单位,因此局部室壁失去产生舒缩运动的基础,导致LVEF和LVFS降低。心肌梗死1周后局部室壁开始重建,左心室逐渐增加,到术后4周呈球形扩张,部分出现室壁瘤,心功能进一步降低。心肌缺血坏死后,坏死的心肌组织失去正常的心肌张力,在左心室压力下发生伸展和变形,导致梗死区变薄并向外膨展。何振山等[9]研究发现,结扎兔冠状动脉4周后左心室内压力将发生改变,左心室中部收缩期压力由正常时的略高于流出道压力转为低于后者,收缩期压力升高的时间顺序由正常时室中略早于流出道变为迟于后者,这种逆转性变化可能是心肌梗死后左心室重塑的重要始动及增重因素。AMI术后1周病理主要表现为梗死心肌细胞凝固性坏死、变性,2周开始出现纤维化,4周出现钙化和瘢痕形成。瘢痕组织主要由I型胶原纤维组成,无舒缩功能,伸展性和弹性较小,硬度较大[10],最终梗死节段失去收缩功能。4周时瘢痕组织完全形成,梗死节段重建完成,故8周时左心室大小及心功能与4周时无明显变化。
BNP主要由心室分泌,当心室壁张力增加或容量超负荷时,BNP浓度明显升高。BNP是预测急性心力衰竭的最强指标[11],AMI后高水平的血浆BNP提示心室重构[12]。本研究发现,AMI模型兔血浆BNP于梗死后升高并呈现动态变化规律,梗死后1 d开始升高,1周达峰值,然后逐渐降低,至术后8周仍高于术前,与丁丽等[13]研究的AMI模型大鼠左心室肌组织中BNP mRNA和蛋白表达所表现出的动态变化类似。AMI兔血浆BNP增加并于梗死后1周达峰值,其主要原因可能是AMI后由于心肌细胞变性、坏死,导致梗死区扩大及室壁变薄拉长,非梗死区室壁压力增高,刺激心室肌细胞合成和分泌BNP,从而导致血浆BNP水平升高。AMI恢复期BNP的持续升高可能是心脏不断受到牵拉的结果,还可能是由一种心肌源性的抗纤维化因子所致[14]。AMI兔BNP明显升高并于1周达峰值,与其病理改变密切相关,可以为临床AMI后BNP最佳检测时间提供理论依据,发挥BNP的最大预测价值。
由于兔冠状动脉血管走行变异大,普遍较短,主要血管长短不一,结扎同一部位无法保证梗死面积一致;而且这种心肌梗死模型缺乏人类的动脉粥样硬化的病理学基础,与人类心肌梗死的病理过程有一定的差异,且人心肌梗死后往往采取治疗措施,因此,本研究结果与临床研究结果可能存在差异。
总之,兔AMI后心功能明显降低、BNP明显升高,其变化与病理演变密切相关。临床上可以应用超声心动图动态观察心肌梗死后心脏功能及形态学变化,同时动态监测血浆BNP浓度,两者综合评价,为后期治疗提供依据。
[1] Fujita M, Morimoto Y, Ishihara M, et al. A new rabbit model of myocardial infarction without endotracheal intubation. J Surg Res, 2004, 116(1): 124-128.
[2] 杨永辉, 李彤, 赵越, 等. 一种简易兔心肌梗死模型的建立.中国医学创新, 2012, 10(10): 1-3.
[3] 戴淑芳, 龙晓凤, 纪丽丽, 等. 建立一种家兔心肌梗死模型的新方法. 大连医科大学学报, 2012, 34(1): 97-100.
[4] 刘斌, 于海初. 冠状动脉结扎法与双极电凝法制备兔急性心肌梗死模型的对比. 齐鲁医学杂志, 2011, 26(6): 529-531, 533.
[5] 杨明, 高长青, 李力兵, 等. 兔心肌梗死模型的建立及心功能评价. 山西医科大学学报, 2011, 42(5): 370-374.
[6] Schiller NB, Shah PM, Crawford M, et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. Am Soc Echocardiogr, 1989, 2(5): 358-367.
[7] Lee BH, Kim WH, Choi MJ, et al. Chronic heart failure model in rabbits based on the concept of the bifurcation/trifurcation coronary artery branching pattern. Artif Organs, 2002, 26(4): 360-365.
[8] Skyschally A, Schulz R, Heusch G. Pathophysiology of myocardial infarction: protection by ischemic pre- and postconditioning. Herz, 2008, 33(2): 88-100.
[9] 何振山, 齐书英, 候云生, 等. 结扎兔冠脉4周后左室壁结构与室内压力的改变. 心功能杂志, 1998, 10(3): 14-16.
[10] Loftis MJ, Sexton D, Carver W. Effects of collagen density on cardiac fbroblast behavior and gene expression. J Cell Physiol, 2003, 196(3): 504-511.
[11] Mueller C, Breidthardt T, Laule-Kilian K, et al. The integration of BNP and NT-proBNP into clinical medicine. Swiss Med Wkly, 2007, 137(1/2): 4-12.
[12] Bavry AA, Kumbhani DJ, Rassi AN, et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials. J Am Coll Cardiol, 2006, 48(7): 1319-1325.
[13] 丁丽, 王如兴, 李肖蓉. 急性心肌梗死大鼠左心室心肌组织脑利钠肽表达变化. 中国微循环, 2009, 13(5): 374-377.
[14] Omland T, Aakvaag A, Bonarjee VV, et al. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction. Comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide. Circulation, 1996, 93(11): 1963-1969.
(本文编辑 张春辉)
Establishment of Myocardial Infarction Model in Rabbits with Dynamic Investigation of Cardiac Function and Pathological Changes
PurposeTo establish myocardial infarction model in rabbits and to evaluate cardiac function and pathological changes.Materials and MethodsIn 35 New Zealand white rabbits, the left anterior descending branch (LAD) of the coronary artery was ligated. The cardiac function was evaluated using echocardiography, and the blood serum brain natriuretic peptide (BNP) level was examined preoperatively, on postoperative day 1, and in 1 week, 2 weeks, 4 weeks and 8 weeks for comparison. Pathological sections and HE staining were performed to observe pathological changes.ResultsThe death rate was 28.6% (10/35). There was progressive increase in left ventricular end systolic diameter (LVESD) and left ventricular end diastolic diameter (LVEDD) at 1 week, 2 weeks and 4 weeks (P<0.05). There was progressive decrease in left ventricular ejection fraction (LVEF) and left ventricular fractional shortening fraction (LVFS) at 1 day, 1 week, 2 weeks and 4 weeks (P<0.05). The BNP level started increasing in 1 day, peaked in 1 week, then gradually decreased but remained higher than preoperative level in 8 weeks (P<0.01). Pathological section showed typical myocardial cell degeneration, necrosis, fbrosis, calcifcation and scar formation.ConclusionThis myocardial infarction model is satisfactory with signifcant decrease of cardiac function and increase of BNP level.
Myocardial infarction; Acute disease; Echocardiography, Doppler, color; Ventricular function; Natriuretic peptide, brain; Pathology, surgical; Disease models, animal; Rabbits
1.湖南省人民医院超声科 湖南长沙 410005
2.湖南省人民医院检验科 湖南长沙 410005
3.湖南省人民医院病理科 湖南长沙 410005
4.重庆医科大学附属第一医院超声科 重庆400016
龙湘党
Department of Ultrasound, Hu'nan Provincial People's Hospital, Changsha 410005, China
Address Correspondence to: LONG Xiangdang
E-mail: hnlxd1997@126.com
湖南省卫生厅科研计划项目(B2009071)。
R-33;R542.22
2014-04-09
修回日期:2014-08-10
中国医学影像学杂志
2014年 第22卷 第9期:655-658
Chinese Journal of Medical Imaging
2014 Volume 22(9): 655-658
10.3969/j.issn.1005-5185.2014.09.004

